鸡白汤多肽序列组成与乳化性能相关性研究
2019-01-17段娜娜张天睿廖永红周晓宏
段娜娜, 张天睿, 廖永红, 周晓宏,*
(1.北京理工大学 化学与化工学院, 北京 100081; 2.北京工商大学 食品学院, 北京 100048)
乳化是指互不相溶的两相液体,其中一相以液滴分散在另一相中[1]。在食品工业中,这两种互不混溶的液体通常是油和水,液滴的平均直径在0.1~100 μm。根据不同相的相对空间分布,乳液通常可分为水包油(O/W)乳液,例如牛奶、冰淇淋、汤、酱汁等;油包水(W/O)乳液,例如黄油、人造奶油等[2]。表面活性剂是一类能显著降低溶剂表面张力的物质,它的分子由两部分组成:一部分是亲水基,另一部分是疏水基。生物表面活性剂大多是由微生物产生的具有表面活性剂特征的化合物,与一般表面活性剂类似。生物表面活性剂同样具有两亲性结构,疏水端大多为长的脂肪酸链或烃链,亲水端一般为糖、多糖、环肽类、氨基酸类及多元醇等[3]。与化学合成表面活性剂相比,生物表面活性剂具有选择性好、用量少、无毒、能够被生物完全降解、环境友好等特点[4]。生物表面活性剂在食品工业中可作为食品添加剂,如乳化剂、增稠剂、保鲜剂等,改变食品的稠度、黏度、口感、新鲜度等,在人体消化过程中可以被分解、吸收或排出体外,对人体无毒副作用[5-7]。天然食品级乳化剂如蛋白质、多糖、磷脂、皂苷的鉴定、表征与应用已有不少研究报道。这些乳化剂的结构、性质与形成乳液稳定性的关系更是研究的重点和热点。人们还研究了pH值、温度、离子强度对天然乳化剂乳化作用的影响。这些研究有助于促进天然乳化剂在乳液基食品、饮料化妆品甚至药品中的广泛应用[8-10]。目前,对纯多肽表面活性剂的研究鲜有报道,研究多肽表面活性剂的结构和乳化机理对开发新型营养、安全、多功能多肽表面活性剂具有重要意义。
本研究基于我国炖制鸡白汤的传统,以鸡骨架为原料,拟通过传统方法炖煮鸡汤,获得均一、稳定的乳化体系,对该乳化体系进行乳化性能和乳化稳定性表征。将鸡汤多肽进行分离,采用高压液相色谱与高分辨率的Q-Extractive二级质谱联用技术分析乳化多肽的序列;研究高效多肽表面活性剂的序列特征,总结多肽表面活性剂的氨基酸序列组成与乳化性能之间的关系,希望为高效多肽表面活性剂的开发提供理论依据。
1 实验部分
1.1 实验材料
肉鸡鸡骨架购自北京新发地批发市场。
1.2 仪器与设备
XSP-605型生物显微镜,上海上天精密仪器有限公司;紫外分光光度计,北京瑞利分析仪器有限公司;NDJ-1型旋转式黏度计,上海高致精密仪器有限公司;JYW-200B型全自动界面张力仪,承德建德检测仪器有限公司;Vivaspin6型离心浓缩管、16532-K型针头滤器(0.22 μm)、17598-K型针头滤器(0.45 μm),德国Sartouris公司;UDK159型全自动凯氏定氮仪,意大利VELP公司;L8900型氨基酸分析仪,日本日立集团;DIONEX UltiMate 3000 RSLC型液相色谱仪、Q-Exactive型质谱仪,美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1鸡白汤炖煮及乳化多肽制备
鸡骨架用温水冲洗血污,去掉尾脂腺、肺和气管,剁成2 cm方块。称得净重后加入2倍质量的冷水,大火烧开,煮沸10 min,去掉血沫,转小火炖煮3 h,获得鸡白汤。鸡白汤4 000 r/min离心10 min后分为三层,最上层为油层,中间为乳液层,最下层有少量沉淀。用移液管吸取鸡汤中间乳化液,与环己烷1∶1混溶,充分振荡后加到分液漏斗内,去除上层环己烷萃取液,分离得到下层鸡汤多肽水溶液。取100 mL下层溶液,分5次与一定量的海砂在培养皿中混合,60 ℃干燥。干燥物经索氏抽提去除脂肪,得到鸡汤乳化层多肽固体样品。样品用100 mL蒸馏水溶解,再分别利用0.45 μm和0.22 μm针头滤器微滤处理,得到鸡汤乳化多肽溶液。取5 mL多肽溶液用于多肽序列分析,其余多肽溶液用凯氏定氮法测定蛋白含量,并测定不同浓度下多肽溶液的表面张力。
1.3.2鸡汤乳化体系性能表征
1.3.2.1 乳化稳定性测定
经2 000、3 000、4 000 r/min等不同转速离心10 min后的鸡汤,取中间乳化层,滴一滴于载玻片中央,利用光学显微镜观察,取中间视野15个颗粒并用测微尺统计颗粒直径大小。参考曾清清等[11]的方法,将离心后得到的乳化层稀释2倍,在540 nm波长下测定样品吸光度A0。在4 000 r/min条件下离心样品10 min,并在相同波长下测定离心后样品的吸光度值A1。设R值(稳定性系数)=A1/A0(R≤1)。R值越大,说明乳液的乳化稳定性越好[12-14]。
1.3.2.2 黏度测定
利用旋转式黏度计,选取合适的转子和转速,用250 mL烧杯盛装原鸡汤或离心微滤后的鸡汤乳化多肽样品,进行黏度测定。比较蒸馏水、鸡汤原液、鸡汤乳化多肽的黏度值。
1.3.2.3 表面张力测定
利用全自动界面张力仪[15],分析不同浓度离心微滤后的乳化多肽溶液表面张力的变化,以确定鸡汤乳化多肽的临界胶束浓度(cmc)值范围。
1.3.3总蛋白含量测定
取离心微滤后的乳化多肽溶液1 mL于消化管中,加入7 g混合催化剂(K2SO46.36 g,CuSO40.64 g)、20 mL浓硫酸,于420 ℃消化1.5 h,冷却至50~60 ℃。参考GB/T 601—2016的方法对配制的HCl溶液进行标定,HCl浓度为0.104 3 mol/L,利用全自动凯氏定氮仪测定总蛋白含量。
1.3.4氨基态氮含量的测定
采用甲醛滴定法,准确吸取离心微滤后的乳化多肽溶液5 mL,置于200 mL烧杯中,加60 mL水,用浓度为0.050 mol/L的氢氧化钠标准溶液滴定至pH值为8.2。加入10 mL甲醛,混匀,再用氢氧化钠标准溶液继续滴定至pH值为9.2,记下消耗的氢氧化钠标准溶液的体积,同时做空白对照。按照式(1)计算氨基态氮含量。

(1)
式(1)中,V1为样品加入甲醛后消耗氢氧化钠标准溶液的滴定体积,mL;V2为空白试样加入甲醛后消耗氢氧化钠标准溶液的滴定体积,mL;c为氢氧化钠标准滴定溶液的浓度,mol/L。
1.3.5游离氨基酸含量的测定
取500 μL离心微滤后的乳化多肽溶液,加入9.5 μL 5%磺基水杨酸混合均匀,静置2 h。取上清液500 μL在10 000 r/min条件下离心15 min。取上清液,稀释6倍,上机测试。氨基酸分析仪测试条件:色谱柱,流速0.4 mL/min,柱温57 ℃。茚三酮反应柱,反应温度135 ℃,流速0.35 mL/min,进样量20 μL,分析时间50 min,波长为570、440 nm。
1.3.6多肽组序列分析
将离心微滤后的多肽溶液,利用截留3 000 Da的超滤离心管进行超滤(3 000 r/min,10 min),于-20 ℃保存备用。利用0.1%TFA将样品复溶,并用液相色谱仪,与质谱仪直接相连,用构成的液质联用系统对样品进行梯度洗脱分离。洗脱流速为0.25μL/min,梯度洗脱分离时间为65 min。分析柱为150 mm×75 μm的熔融石英毛细管柱,将其与C18树脂组合形成自制分析柱。流动相A含有0.1%的甲酸,流动相B是含有100%乙腈和0.1%甲酸的混合液。MS 使用单一全扫描质谱 Orbitrap,并通过软件Xcalibur 2.2采集数据。用LC-MS/MS图谱检索UniProt数据库,获得鸡汤乳化多肽组序列。
2 结果与分析
2.1 鸡白汤离心乳化稳定性分析
在不同离心转速条件下,鸡白汤乳化颗粒直径大小分布和乳化稳定性如表1。从表1可以看出,随着离心转速增加,乳化颗粒更加细小,分布更加均匀,乳化稳定性也随之增加。从动力学角度解释,乳化颗粒越小,在液滴聚并[16]速度相同的情况下,由乳状液变成两相彼此分离的液体所需要的时间越长,即乳状液越稳定,且大小分布均匀的乳状液比具有较宽粒子分布的乳状液要稳定得多;因此,后续实验所用鸡汤乳化体系,均在4 000 r/min离心10 min条件下所得,以保证乳化液的最佳稳定性。
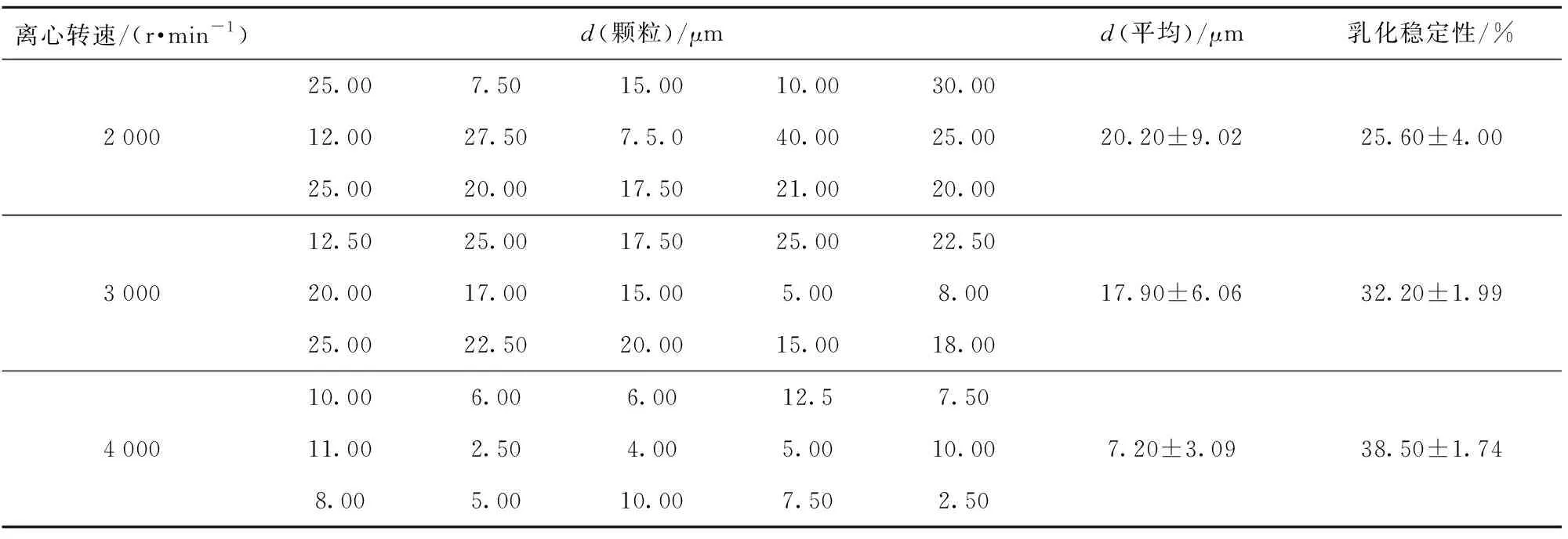
表1 不同离心条件下鸡白汤乳化颗粒直径与稳定性
2.2 鸡白汤乳化多肽蛋白含量及多肽平均长度分析
离心微滤后的乳化多肽溶液通过凯氏定法测得的总蛋白含量为1.3 g/100 mL,氨基酸分析仪测得游离氨基酸含量为0.15 g/100 mL,甲醛滴定法测得的氨基态氮含量为0.038 g/100 mL,按照式(2)计算多肽水解度。

(2)
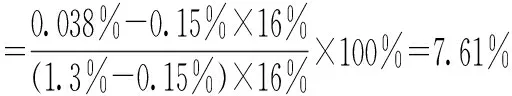
多肽的平均长度约为13个氨基酸残基。
2.3 黏度测定结果分析
在室温下,选用旋转式黏度计的1号转子进行测定,鸡汤原液黏度为4.2 mPa·s,原液稀释20倍后黏度为3 mPa·s,而离心微滤后的乳化多肽溶液黏度为2.5 mPa·s,其稀释20倍后与同体积蒸馏水黏度(1 mPa·s)相近。由黏度测定结果推测鸡汤原液中起增稠作用的主要是大分子蛋白、长肽以及油脂等大分子物质,这些分子在流体流动时将受到更大的摩擦力,表观黏度更高。
2.4 表面张力测定结果分析
表面活性剂的表面活性通常用加入表面活性剂后溶剂表面张力的降低及其形成胶束的能力两个性质来表征,而胶束化能力用cmc表示,cmc越小,表面活性剂越容易在溶液中自聚形成胶束[17]。本实验测定了离心微滤后的鸡汤多肽溶液的表面张力随浓度的变化关系,鸡汤多肽浓度通过凯氏定氮法测定,如图1。由图1γ-c曲线可看出,鸡汤多肽cmc值为4 mg/mL时溶液表面达到饱和吸附,开始有胶束形成;超过cmc后,尽管多肽浓度继续增加,但溶液的表面张力几乎不再下降,稳定在42 mN/m左右。

图1 鸡汤多肽γ-c曲线Fig.1 γ-c curve of chicken broth polypeptides
2.5 多肽序列疏水度分析
通过HPLC-MS分析鸡汤乳化多肽的二级质谱,利用UniProt数据库检索,获得1646条多肽序列。为了表征多肽的疏水度,从自由能角度考虑,采用Ney (1971) 提倡的Q规则[18],即Q=∑Δft/n,其中Q为多肽的平均疏水度,Δft为氨基酸侧链的相对疏水度,n为氨基酸残基数,Q值分析结果见图2。图2中,1 646条多肽的Q值均在9 000 kJ/mol以下,其中有1 349条多肽的Q值在3 000~6 000 kJ/mol,占多肽总数量的82%,而Q值在3 000 kJ/mol以下多肽数量最少,只有77条,占比5%。
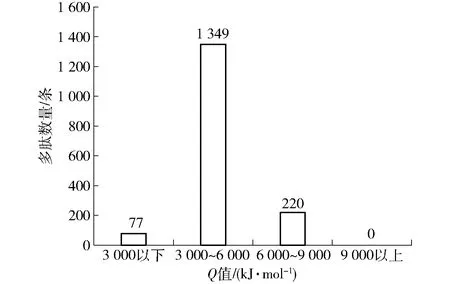
图2 鸡汤多肽平均疏水度分布Fig.2 Distribution of average hydrophobicity of chicken broth polypeptides
对1 349条多肽序列进一步统计分析,从多肽的平均疏水度来看,这些多肽的Q值平均值为4 791.70 kJ/mol。以丙氨酸的Δft值3 056 kJ/mol作为疏水性氨基酸的分界线,Δft值<3 056 kJ/mol为亲水性氨基酸,Δft值≥3 056 kJ/mol则为疏水性氨基酸。在1 349条多肽序列中,疏水性氨基酸残基的平均Δft值为8 034.87 kJ/mol,多集中于6 000~10 000 kJ/mol(1 236条),占比92%;疏水性氨基酸残基的平均Δft在10 000 kJ/mol以上(59条),仅占4%(图3);68%(即1 646条多肽的56%)的多肽序列中疏水性氨基酸占比主要集中于40%~60%(436+475=911条),说明鸡汤主体乳化多肽疏水性氨基酸与亲水性氨基酸的占比比较接近,疏水性氨基酸占比很高或亲水性氨基酸占比很高的多肽数量较少(图4)。图5为鸡汤多肽中各种疏水性氨基酸和亲水性氨基酸残基的占比,出现最多的疏水性氨基酸为Ala和Lys,最少的是Trp和Cys;出现最多的亲水性氨基酸为Glu和Gly,最少的是His和Asn。强亲水性氨基酸Gln、Asn和强疏水性氨基酸Trp、Tyr、Ile总体上占比不高。
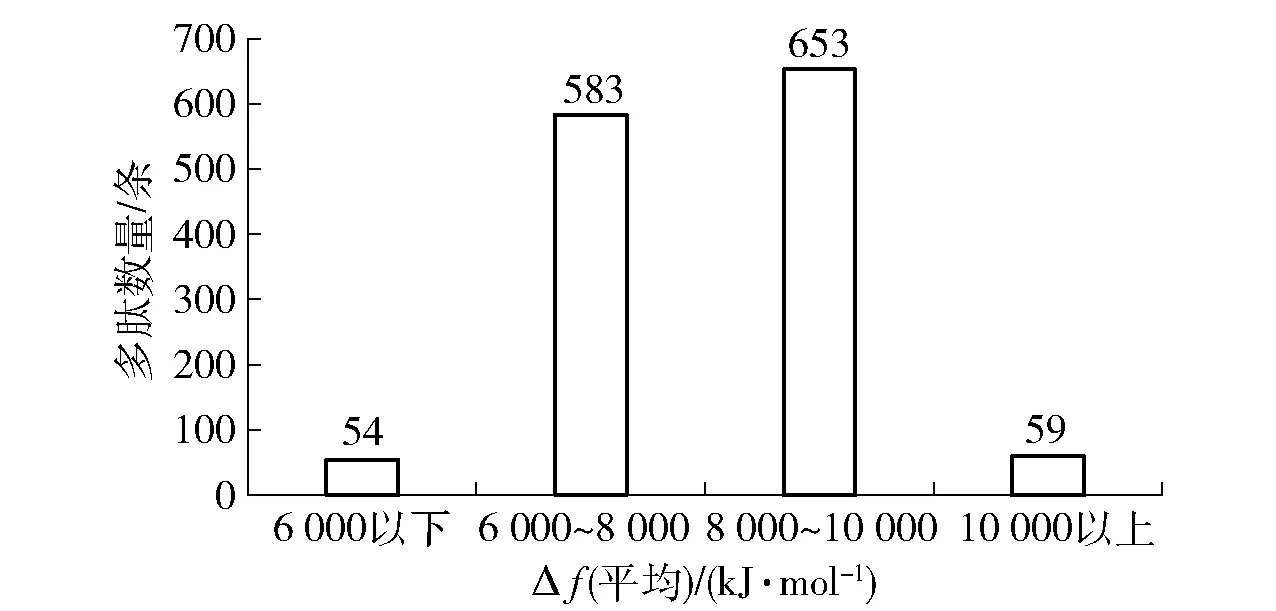
图3 鸡汤多肽疏水性氨基酸残基的疏水值分布Fig.3 Distribution of Δft value of hydrophobic amino acids of chicken broth polypeptides
从氨基酸残基在乳化多肽两端的分布来看,N端、C端均以亲水性氨基酸居多,N端为亲水性氨基酸的多肽有712条,占比53%;C端为亲水性氨基酸的多肽有739条,占比55%。N、C两端一端疏水、一端亲水(698条)的多肽所占比例为52%,两端同为亲水性氨基酸(377条)的多肽占比28%,同为疏水性氨基酸(274条)的多肽占比为20%。N、C端一端疏水、一端亲水的多肽中,N端以疏水氨基酸为主,且多为Lys、Ala和Pro,C端以亲水氨基酸为主,且多为Glu、Gly和Thr。

图4 鸡汤多肽疏水性氨基酸比例分布Fig.4 Distribution of hydrophobic amino acids in chicken broth polypeptides
3 结 论
鸡汤乳化多肽平均长度约为13个氨基酸残基,cmc值为4 mg/mL,具有较好的表面活性,能够明显降低溶液的表面张力。通过HPLC-MS分析得到1 646条鸡汤乳化多肽序列,多肽平均疏水度为4 791.70 kJ/mol,其中82%的乳化多肽Q值在3 000~6 000 kJ/mol;56%的乳化多肽序列中疏水性氨基酸占比主要集中于40%~60%,鸡汤主体乳化多肽疏水性氨基酸与亲水性氨基酸的占比接近,疏水性氨基酸占比很高或亲水性氨基酸占比很高的多肽数量较少。出现最多的疏水性氨基酸为Ala和Lys,最少的是Trp和Cys;出现最多的亲水性氨基酸为Glu和Gly,最少的是His和Asn;强亲水性氨基酸Gln、Asn和强疏水性氨基酸Trp、Tyr、Ile总体占比不高。乳化多肽N端、C端以亲水性氨基酸为多,两端均为疏水氨基酸的很少。与传统表面活性剂一边亲水、一边疏水的结构不同,鸡汤乳化多肽是一种疏水性基团和亲水性基团相互交织的结构。合成组成相同的两种多肽表面活性剂:一种为一边亲水、一边疏水的多肽表面活性剂,另一种为亲疏水性氨基酸残基相互交错的多肽表面活性剂,比较两种多肽表面活性剂特性,对进一步阐明多肽表面活性剂的构效关系将具有积极意义。研究结果对于开发新型多功能多肽表面活性剂具有一定的参考价值。
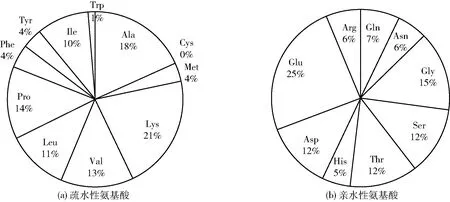
图5 鸡汤多肽各种氨基酸分布情况Fig.5 Ratio of amino acids of chicken broth polypeptides
