黄曲霉产胞外β-1,3-1,4-葡聚糖酶的发酵条件优化
2019-01-17陈瑶瑶刘杨柳李思霆贾英民
刘 璐, 陈 洲, 陈瑶瑶, 刘杨柳, 李思霆, 贾英民
(北京工商大学 食品学院, 北京 100048)
β-1, 3-1, 4-葡聚糖是由β-葡萄糖苷通过β-1, 3和β-1, 4-糖苷键混合连接而成的线性多糖,广泛分布于大麦、燕麦、高粱、大米和小麦等谷物的胚乳细胞壁中[1-2]。β-葡聚糖具有黏性高、水溶性差等特点,这给富含β-葡聚糖谷类作物的应用造成了众多不利影响[3-4]。例如,在啤酒酿造中,因β-葡聚糖的过量存在,使得麦芽汁黏度增加,造成过滤困难,降低了啤酒的产量和质量[5];在饲料工业中,过高的β-葡聚糖会造成动物胃液黏度的增加,阻碍动物的营养吸收,从而降低饲料的转化率,限制了谷物及其副产品在饲料添加中的应用[6-7]。可见,寻求β-葡聚糖的“绿色”、高效降解方法将成为有效提升其工业化应用的关键。一般来说,β-葡聚糖可通过酸解、碱解、酶解及其协同降解等多种方式转化生成小分子的葡萄糖或纤维寡糖。酶解法因具有安全高效、专一性强及无毒副产物生成等优势而成为β-葡聚糖降解的最理想方法[8]。β-1, 3-1, 4-葡聚糖酶(EC 3.2.1.73)属于糖苷水解酶,它能专一性水解β-葡聚糖主链中的β-1, 3/1, 4-葡萄糖苷键,是一类重要的工业化酶制剂,目前在啤酒酿造、饲料营养强化等领域中应用广泛[9]。
β-1, 3-1, 4-葡聚糖酶主要来源于动、植物及微生物,微生物因产酶量高、发酵周期短且易于实现工业化生产等优势而成为该酶的主要生产者。产β-1,3-1,4-葡聚糖酶的菌株种类繁多,其中,曲霉菌是最主要真菌来源。目前的研究主要集中于黑曲霉β-1, 3-1, 4-葡聚糖酶[10-11],有关其他曲霉来源的β-1, 3-1, 4-葡聚糖酶的报道还很少,因此,进一步挖掘产β-1, 3-1, 4-葡聚糖酶的曲霉菌种对促进该酶的生产和应用具有重要指导意义。
通过初步探索,本课题组获得了一株优良的黄曲霉菌株,并发现该菌株具备分泌胞外β-1, 3-1, 4-葡聚糖酶的能力。为深入了解该菌株发酵产β-1, 3-1, 4-葡聚糖酶的水平以及该酶的功能特性,本研究重点对该菌株产胞外β-1, 3-1, 4-葡聚糖酶的发酵条件进行了优化,并初步探索了该酶降解谷物内β-葡聚糖的应用潜能。
1 实验部分
1.1 实验材料
大麦葡聚糖,爱尔兰Megzyme公司;燕麦粉、大麦粉,北京永辉超市;酵母提取物、胰蛋白胨,英国Oxoid公司;吐温、曲拉通和十二烷基硫酸钠(SDS)等,中国国药集团化学试剂有限公司;玉米苞皮、小麦麸皮、稻壳、玉米芯、白酒酒糟、花生壳等农业废弃物,北京官园花鸟市场;其他试剂如无特殊说明均为分析纯。
黄曲霉(CICC No.2476,不产黄曲霉毒素)购买于中国工业微生物菌种保藏中心,保存于本研究室。
初始发酵培养基(g/L):玉米芯20,胰蛋白胨10,酵母提取物10,NaCl 5,MgSO4·7H2O 0.5,KH2PO40.75,自然pH,121 ℃灭菌20 min。
1.2 实验仪器
PDA培养基(g/L):马铃薯200,葡萄糖20,琼脂粉20,自然pH,121 ℃灭菌20 min。
MJPS- 150型霉菌培养箱,上海精宏有限公司;ZWF- 100型摇床,上海智诚分析有限公司;HH.S11- 4型电热恒温水浴锅,上海博讯医疗有限公司;TGL- 20BR型高速冷冻台式离心机,上海安亭科学仪器厂;TU- 1810PC型紫外可见分光光度计,北京普析通用仪器设备有限责任公司。
1.3 实验方法
1.3.1发酵产酶
将黄曲霉划线接种于PDA平板上,置于30 ℃下培养3~5 d。将大小为1 cm2黄曲霉菌块接种到含50 mL初始发酵培养基的250 mL锥形瓶中。在37 ℃、200 r/min的条件下培养4 d,离心(10 000r/min,10 min)取上清液,测定β-1, 3-1, 4-葡聚糖酶酶活力。
1.3.2发酵产酶的优化
采用单因素实验优化黄曲霉产酶条件。考察碳源对黄曲霉产酶的影响,包括碳源种类(玉米芯、麸皮、燕麦粉、大麦粉、稻草、玉米苞皮、白酒酒糟、花生壳、葡萄糖、木糖、蔗糖、乳糖、麦芽糖、可溶性淀粉和葡聚糖)及其添加量(质量浓度)0~50 g/L对产酶的影响;考察氮源种类(胰蛋白胨、酵母提取物、蛋白胨、牛肉膏、大豆蛋白胨、豆粕粉、硫酸铵和磷酸氢二铵)及其添加量(质量浓度)(0~35 g/L)对产酶的影响;考察表面活性剂种类(吐温-20、吐温- 40、吐温-60、吐温-80、曲拉通-110、曲拉通-114和SDS(十二烷基硫酸钠))及其添加量(质量浓度)(0~30 g/L)对产酶的影响。继续优化培养基初始pH值(5.0 ~ 8.5)和培养温度(25~40 ℃,每隔5 ℃),基于较佳培养基组成和较优培养条件的研究结果,考察该菌摇瓶发酵的产酶过程。
1.3.3β-1, 3-1, 4-葡聚糖酶酶活力及蛋白含量测定
酶活力测定参照Tang等[12]的方法:150 μL大麦葡聚糖(质量浓度为5 g/100 mL)底物置于45 ℃下预热3 min,加入50 μL适当稀释的酶液并在45 ℃下反应10 min;加入200 μL DNS(3,5-二硝基水杨酸)煮沸15 min显色,最后加入200 μL酒石酸钾钠溶液(质量浓度为40 g/100 mL),待冷却后测定A540 nm值,以葡萄糖为标准。β-1, 3-1, 4-葡聚糖酶酶活力单位(U)定义为:在上述条件下每分钟水解大麦β-葡聚糖生成1 μmol/L葡萄糖所需要的酶量。
蛋白含量的测定参照Lowry等[13]的方法,以牛血清白蛋白为标准。
1.3.4黄曲霉产胞外β-1, 3-1, 4-葡聚糖酶降解谷物中β-葡聚糖能力研究
水解条件:向1 g大麦粉/燕麦粉中加入9 mL MOPS(4-(N-morpholino) propanesulphonic acid)缓冲液(50 mmol/L,pH值7.5)混匀;加入10 U/mL的胞外β-1, 3-1, 4-葡聚糖酶进行水解反应,不同时间点取样并于沸水中蒸煮5 min灭活,10 000 r/min离心10 min后取上清液待测。
TLC检测条件:采用德国Merk公司60F 254型号硅胶板,展层剂为正丁醇/乙酸/水,三者体积比为2∶1∶1,显色剂为5%硫酸甲醇溶液,展层2次。
1.3.5响应面优化试验
基于单因素研究,选取麸皮浓度、吐温-60浓度和温度3个因素为自变量,以酶活为响应值,以单因素实验所得最适结果为响应面试验的中心,进行三因素三水平中心组合设计响应面试验(表1)。通过多元回归拟合,并对回归方程进行方差分析及拟合度检验,讨论响应面特征,确定优化的产酶条件。最终通过实验进行验证,将实验值与预测值进行比较,验证模型的有效性。
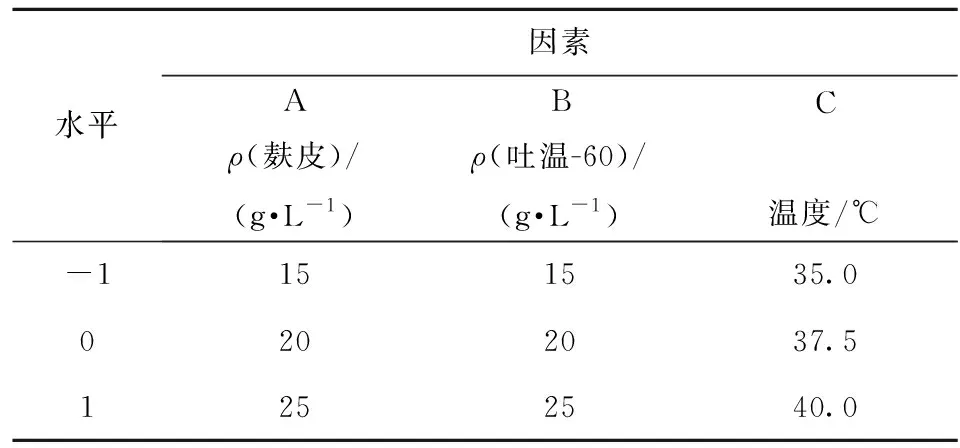
表1 响应面设计的因素及水平
2 结果与分析
2.1 碳源对黄曲霉发酵产胞外β-1, 3-1, 4-葡聚糖酶的影响
碳源对黄曲霉发酵产胞外β-1, 3-1, 4-葡聚糖酶的能力有重要影响,实验结果见表2。当以麸皮为唯一碳源时,黄曲霉产酶能力最强,且在麸皮添加量为20 g/L时达到最高酶活,为35.5 U/mL。

表2 碳源与黄曲霉发酵产β-1, 3-1, 4-葡聚糖酶的关系
碳源是微生物自身骨架合成过程中主要的营养物质和能源物质,提供菌体生长所需的碳骨架和维持菌体生命活动所需的代谢能量,是影响菌体生长和代谢产物合成的重要因子[14]。不同的微生物由于代谢酶系可利用的碳源不同,且不同碳源条件下微生物产生的代谢产物具有一定的差异[15-16]。β-1,3-1, 4-葡聚糖酶是一种诱导型酶,不同碳源诱导其产酶能力不尽相同。本研究发现,黄曲霉利用纤维质原料诱导产酶的能力明显强于其他单一糖类,可能是由于农业废弃物所富含的营养成分更丰富,利于黄曲霉的代谢利用。此外,农业废弃物价格低廉,用于发酵产酶还可以节约酶的生产成本。
2.2 氮源对黄曲霉发酵产胞外β-1, 3-1, 4-葡聚糖酶的影响
氮源同样能显著影响黄曲霉产β-1, 3-1, 4-葡聚糖酶的能力,实验结果见表3。由表3可知,当以磷酸氢二铵为氮源时,黄曲霉的产酶水平最高,酶活可达68.3 U/mL。进一步研究发现,添加30 g/L的磷酸氢二铵最为合适,此时的酶活为79.1 U/mL。

表3 氮源与黄曲霉发酵产β-1, 3-1, 4-葡聚糖酶的关系
2.3 表面活性剂对黄曲霉发酵产胞外β-1, 3-1, 4-葡聚糖酶的影响
表面活性剂对黄曲霉产胞外β-1, 3-1, 4-葡聚糖酶的影响结果如图1。非离子型表面活性剂对黄曲霉产酶的促进作用明显高于离子型表面活性剂,以吐温-60的作用效果最好。添加20 g/L的吐温-60时黄曲霉产酶水平最高,酶活可达123.3 U/mL。
吐温-60的添加显著促进了黄曲霉产酶的能力,可能是由于吐温-60能够有效增强细胞膜的通透性,有助于胞内酶透过细胞膜而分泌出来,从而提高胞外酶的产量[17]。另外,添加浓度的变化会对黄曲霉产酶能力造成较大影响,添加20 g/L的吐温-60时产酶水平最高,但继续增大吐温-60的添加量,酶活又出现下降的趋势,说明过高浓度的表面活性剂可能会一定程度上抑制菌株产酶。
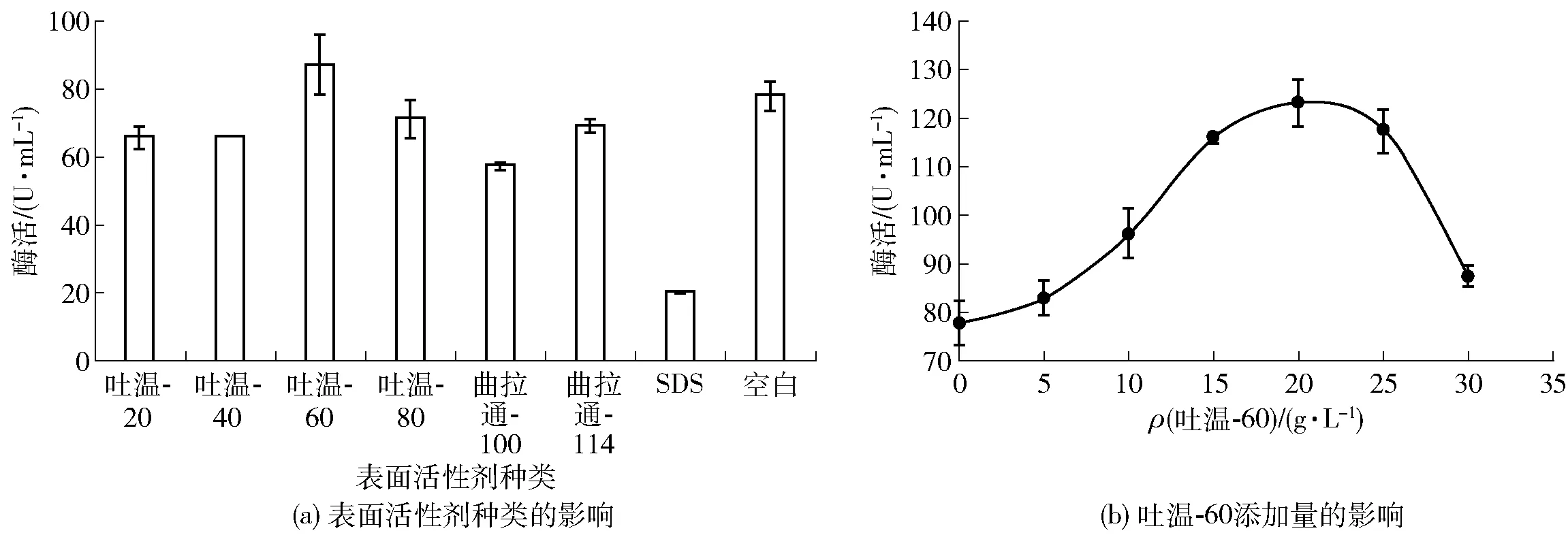
图1 表面活性剂与黄曲霉产胞外β-1, 3-1, 4-葡聚糖酶的关系Fig.1 Effect of surfactants on β-1, 3-1, 4-glucanase production

图2 初始pH值和温度与黄曲霉产胞外β-1, 3-1, 4-葡聚糖酶能力的关系Fig.2 Effects of initial pH and temperature on β-1, 3-1, 4-glucanase production
2.4 培养条件对黄曲霉发酵产胞外β-1, 3-1, 4-葡聚糖酶的影响
培养基的初始pH值及培养温度对黄曲霉发酵产酶的影响较大,实验结果见图2。研究发现,培养基初始pH值为8.0、发酵温度选择37 ℃时酶活最高,为121.5 U/mL。
pH值的变化会使微生物合成酶的类型和酶系的组成产生不同程度的改变,进而影响微生物的代谢活动;因此pH值是影响微生物代谢产物的产量及活性的重要因素[18]。由图2(a)可知,随初始pH值的增加,酶活不断增加,当pH值升至8.0时酶活最高,继续提高pH值时酶活又开始逐渐降低。温度是影响微生物生长代谢的重要因素,随着温度的升高微生物的生长不断加快,从而促进微生物代谢以加快分泌酶等活性物质。在37 ℃下培养黄曲霉,能够分泌最高活力的胞外β-1, 3-1, 4-葡聚糖酶,但随着温度的继续升高,酶活又开始出现较大幅度的下降。这可能是由于温度的升高一定程度上抑制了菌株的正常生长,造成代谢异常从而导致了酶活的降低。
2.5 黄曲霉发酵产胞外β-1, 3-1, 4-葡聚糖酶的过程分析
确定优化培养基及培养条件后,最终考察了培养时间对黄曲霉产β-1, 3-1, 4-葡聚糖酶的影响(图3)。β-1, 3-1, 4-葡聚糖酶的酶活力随着培养时间的延长而增长,发酵至第6天时酶活力最高,达155.4 U/mL。

图3 黄曲霉发酵产胞外β-1, 3-1, 4- 葡聚糖酶的产酶历程Fig.3 Time course of β-1, 3-1, 4-glucanase production from A. flavus
目前,国内外已报道的β-1, 3-1, 4-葡聚糖酶主要来源于细菌,如芽孢杆菌和类芽孢杆菌等[19-22],有关真菌产β-1, 3-1, 4-葡聚糖酶的研究还很少。曲霉菌是多数工业酶制剂生产的重要菌种,也是目前真菌源β-1, 3-1, 4-葡聚糖酶研究的主要对象,但关于黄曲霉分泌的β-1, 3-1, 4-葡聚糖酶的相关研究至今未见报道。
2.6 响应面优化结果分析
表4是依据响应面设计的不同因素及水平的试验结果。表5则是对模拟回归系数的方差分析结果。

表4 响应面试验结果

表5 响应面试验回归分析
表4、表5结果表明,因变量和自变量间的线性关系明显,线性回归系数值P<0.05,表现为显著性,说明该实验方案可行。同时,失拟项系数值P为0.069 8(>0.05),表现为不显著,表明试验模型拟合度较好,误差等偶然因素对试验的影响不显著。
进一步分析了各因素交互作用,响应面分析结果见图4。通过考察3个因素相互间作用对响应值的影响,再经Design-Expert 8.0软件分析获得优化条件为麸皮19.14 g/L、吐温-60 21.09g/L、温度37.87 ℃,相应的酶活为156.9 U/mL。最终经修正,选择麸皮19.0 g/L、吐温-60 21.0 g/L、温度38 ℃进行验证实验,测得酶活为155.9 U/mL,结果与预测值相当。
经单因素实验和响应面试验优化发酵条件后,黄曲霉产β-1, 3-1, 4-葡聚糖酶的最高酶活力达155.9 U/mL,产酶水平高于已报道的黑曲霉(20.0U/mL)[10],但低于泡盛曲霉的产酶水平[23]。与其他丝状真菌相比,黄曲霉产胞外β-1, 3-1, 4-葡聚糖酶的能力明显高于樟绒枝霉和嗜热拟青霉,但不如米黑根毛霉[12,24-25]。此外,本研究的黄曲霉还可利用农业废弃物(麸皮)来制备β-1, 3-1, 4-葡聚糖酶,这不仅有助于降低酶的生产成本,还利于增加农业废弃物的附加值。
2.7 黄曲霉产胞外β-1, 3-1, 4-葡聚糖酶降解谷物内β-葡聚糖的应用潜力初探
β-1, 3-1, 4-葡聚糖酶能够特异性水解β-葡聚糖,具备促进富含β-葡聚糖类谷物营养吸收的功能。为研究黄曲霉β-1, 3-1, 4-葡聚糖酶的应用潜能,重点考察了该酶降解大麦粉和燕麦粉水溶液(富含β-葡聚糖)的能力,实验结果见图5。由TLC分析结果显示,该酶能够直接降解大麦粉和燕麦粉中的可溶性β-葡聚糖;随着水解反应的进行,水溶液中的可溶性β-葡聚糖最终被降解成葡萄糖和少量低聚糖。
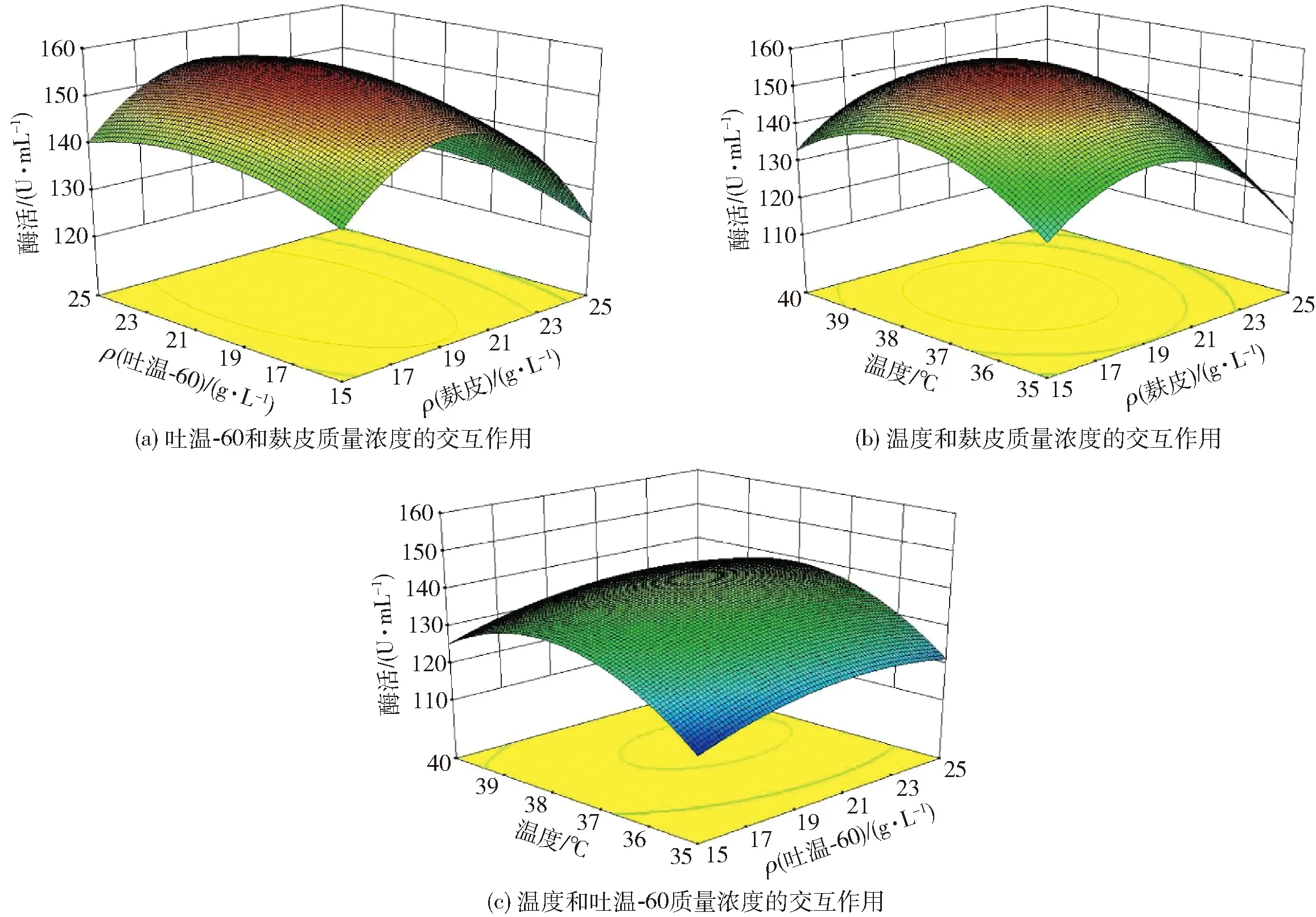
图4 各因素交互作用的响应面分析结果Fig.4 Response surface plot showing effects of interactions among three factors on enzyme activity
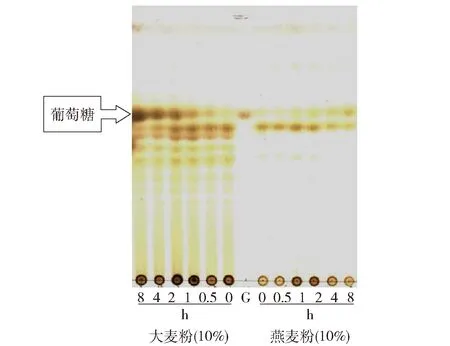
G:葡萄糖图5 黄曲霉产胞外β-1, 3-1, 4-葡聚糖酶降解谷物中葡聚糖的TLC分析Fig.5 TLC analysis of hydrolytic products of glucan from grain by β-1, 3-1, 4-glucanase from A. flavus
微生物源β-1, 3-1, 4-葡聚糖酶的主要功能是降解β-葡聚糖并生产纤维寡糖。纤维寡糖作为一种益生元,具有调节肠道菌群平衡的特殊功效,但纤维寡糖却并不能被机体消化和吸收,还有可能造成机体腹部胀气等不适反应。本研究发现,黄曲霉分泌的胞外β-1, 3-1, 4-葡聚糖酶不但能实现天然谷物中β-葡聚糖的有效降解,还能将β-葡聚糖降解成小分子的葡萄糖。这一独特属性对于该酶在葡萄糖制备和生产领域,以及促进人类或者动物机体消化、吸收富含β-葡聚糖类的谷物具有重要实用价值。
3 结 论
本研究通过单因素实验和响应面分析法优化了黄曲霉产β-1, 3-1, 4-葡聚糖酶的液体发酵条件,得到优化的发酵条件:麸皮19 g/L、磷酸氢二铵30 g/L、吐温-60 21 g/L、NaCl 5 g/L、MgSO4·7H2O 0.5 g/L、KH2PO40.75 g/L、培养基初始pH值8.0、培养温度38 ℃、培养时间6 d。在此条件下发酵,黄曲霉能产155.9 U/mL的β-1, 3-1, 4-葡聚糖酶,其产酶水平高于多数国内外报道的丝状真菌。麸皮是小麦制粉后的副产品,资源丰富且成本低廉,是微生物工业发酵的良好碳源。本研究发现黄曲霉可利用麸皮作为碳源生产β-1, 3-1, 4-葡聚糖酶,有效降低了生产成本。另外,水解实验发现,黄曲霉分泌的β-1, 3-1, 4-葡聚糖酶具有独特水解性能,不仅能有效降解天然谷物粉中的可溶性β-葡聚糖,还能将这些β-葡聚糖降解成葡萄糖,这对于促进天然谷物的消化和吸收具有重要意义。
