新生儿甲状腺功能指标生物参考区间的建立及验证研究
2019-01-16程琼杨妙琳张竞文蔡安季
程琼 杨妙琳 张竞文 蔡安季

【摘要】 目的:探讨适用于本实验室的新生儿甲状腺功能指标促甲状腺激素(TSH)、游离甲状腺素(FT4)、游离三碘甲状腺原氨酸(FT3)的生物参考区间。方法:依照美国临床实验室标准化协会(CLSI)C28-A3文件的方法,随机收集120例新生儿的新鲜血清,通过化学发光微粒子免疫分析法(CMIA)进行测定,测定结果依据C28-A3的方法用SPSS 19.0软件进行统计分析,从而建立相应的生物参考区间,另外随机抽取LIS系统60份新生儿科的标本结果对新参考区间进行验证。结果:新生儿甲状腺功能指标(TSH、FT4、FT3)的生物参考区间分别为0.606~13.863 mIU/L、9.29~23.05 pmol/L、2.75~5.60 pmol/L,经过与60份参考个体的对比,结果验证是相符合的。结论:通过验证,初步建立的生物参考区间基本符合本实验室的要求。
【关键词】 生物参考区间; 新生儿; 甲状腺功能; 化学发光微粒子免疫分析法
Establishment and Validation of Biological Reference Intervals for Neonatal Thyroid Function/CHENG Qiong,YANG Miaolin,ZHANG Jingwen,et al.//Medical Innovation of China,2019,16(25):0-044
【Abstract】 Objective:To explore the biological reference interval of thyroid stimulating hormone(TSH),free thyroxine(FT4)and free triiodothyronine(FT3)for neonates in our laboratory.Method:According to the C28-A3 method recommended by the American Clinical and Laboratory Standards Institute(CLSI),fresh serum 120 cases of newborns were collected randomly and measured by Chemiluminescence Microparticle Immunoassay(CMIA).The results were analyzed by SPSS 19.0 software,and the corresponding biological reference interval was established.In addition,60 samples of neonatal samples randomly selected from LIS system were used to validate the new reference intervals.Result:The biological reference intervals of TSH,FT4 and FT3 were 0.606-13.863 mIU/L,9.29-23.05 pmol/L and 2.75- 5.60 pmol/L respectively,the results were in agreement with the comparison of 60 reference individuals.Conclusion:The initial establishment of the new biological reference interval basically could meet the requirements of the laboratory by validating.
【Key words】 Biological reference interval; Neonatal; Thyroid function; CMIA
First-authors address:Nanshan District Peoples Hospital of Shenzhen,Shenzhen 518052,China
doi:10.3969/j.issn.1674-4985.2019.25.010
生物參考区间是实验室规范化的基本要求,亦是解释检验结果的基本尺度和依据,可靠的生物参考区间有助于患者和医生对人体健康状况的了解。根据医学实验室——质量和能力认可规则ISO15189:2012“实验室必须慎重建立出自己的生物参考区间,并定期评审”,以保证依据的生物参考区间的有效性[1]。美国临床实验室标准化协会(CLSI)文件《C28-A3:临床实验室如何定义、建立和确认生物参考区间》指出,确定参考值或参考区间应保证所选择的样品组来源于健康人群。然而出于不同的目的,确定参考值或参考区间的样品组,可来源于健康人群,也可来源于处于其他生理状态下或病理情况下的人群。研究发现,甲状腺激素参与人体的生长发育,以及糖、蛋白质和脂肪的代谢调节,对神经系统、骨骼系统、心血管活动等都有影响,特别是神经系统,在脑发育期间缺乏甲状腺激素可导致脑的生长率减低,脑细胞发育不全,若在脑发育成熟时发生甲低,可发生功能障碍,而在甲亢时则大脑皮层兴奋性增高[2-4]。近期研究表明,新生儿由于刚出生,身体发育尚未成熟,并且受到外界的环境影响而产生各种应激,导致新生儿甲状腺功能指标异于成年人[5-7]。为了进一步更好地评价新生儿甲状腺功能指标的生物参考区间,本研究依据CLSI C28-A3文件,拟建立适用于本实验室新生儿甲状腺功能指标的生物参考区间,并进一步运用临床标本进行验证,现报道如下。
1 资料与方法
1.1 一般资料 随机选取2016年1-12月在本院新生儿科出生7~22 d的120名新生儿,男66名,女54名。
1.2 仪器与试剂 雅培i2000SR化学发光免疫分析仪。TSH、FT4、FT3试剂均为仪器原装配套试剂及清洗液。TSH试剂63100UI00,校准品批号:65190UI00。FT4试剂批号:65404UI00,校准品批号:60264UI00。FT3试剂批号:62317UI00,校准品批号:62325UIOO。TSH、FT4、FT3的质控品均为美国伯乐Bio-Rad公司生产的,高、中、低值批号分别为40311、40312、40313。
1.3 方法
1.3.1 标本采集及检测 依照CLSI C28-A3文件,从LIS系统中获取新生儿的信息,并收集120例新生儿血液标本3 mL,3 500 r/min离心5 min,分离血清,采用雅培i2000SR全自动免疫分析仪及配套试剂用化学发光微粒子免疫分析法检测TSH、FT4、FT3水平,操作严格按说明书进行。
1.3.2 质量控制 雅培i2000SR全自动免疫分析仪新生儿甲状腺功能指标(TSH、FT4、FT3)检测项目均参加卫计委临检中心室间质评,结果均为满意。临床标本在检测前均进行室内质控品检测,结果需在控制范围内。所有检测步骤均参照《全国临床检验操作规程(第四版)》[8]。
1.3.3 剔除离群值 将疑似离群点和其邻近点的差值(D)和数据全距(R)计算出,若某个观测点的D值等于或大于1/3R值,则考虑为离群点。若有离群点被剔除后,应即将其他数据补上[2]。
1.3.4 生物参考区间的建立 采用SPSS 19.0软件对剔除后的数据进行分析,绘制频数分布图,了解数据的分布特性。若是数据结果呈现高斯正态分布,则可用(x±1.96s)表示95%数据分布范围,若是数据不呈高斯正态分布,则改用百分位数法确定2.5%和97.5%位数的参考限,以此确定参考区间。
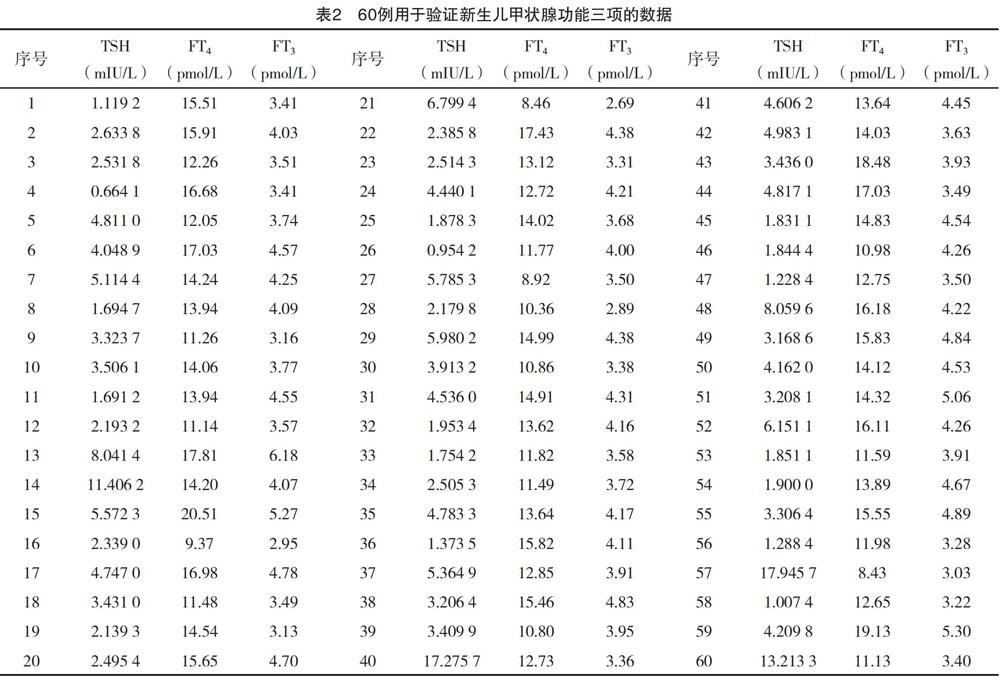
1.3.5 验证新建立的参考区间 从LIS系统随机抽取新生儿科60个已经测定甲状腺功能三项的结果,汇总数据,对建立的生物参考区间进行验证。若检测结果95%(57例)落在新建立的参考区间上,说明该参考区间有效。若超过5%(3例)落在新建立的参考区间以外,则说明该参考区间无效,需重新制定生物参考区间。
2 结果
2.1 新生儿甲状腺功能三项数据 新生儿科收集的120个新生儿血清标本测定结果,见表1。采用SPSS 19.0软件进行分析,目测TSH组有可疑离群值,用上述方法判断离群点,结果疑似离群值数值<1/3R,故不属于离群点。
2.2 新生儿各指标检测结果频数分布 将表1各项结果绘制成图1,通过数据统计分析,可知其区间均不呈高斯正态分布,依据C28-A3参考方法,生物参考区间不宜采用(x±1.96s)表示95%数据分布范围。将TSH、FT4、FT3分别按大小排列,以百分位数法确定2.5%和97.5%位数的参考值,以此确定参考区间。
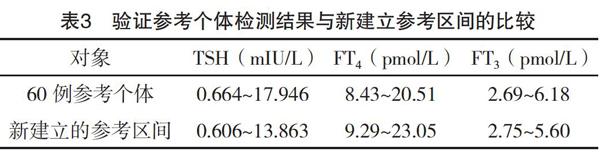
2.3 生物参考区间初步建立和验证结果 另外LIS系统中抽取新生儿科60例新生儿甲状腺功能三项结果(表2)进行验证,经分析TSH、FT4、FT3三者符合率分别为96.7%、95.00、95.00%,见表3。
3 讨论
甲状腺激素具有重要的生理作用。体内甲状腺激素的增高或减低均会提示疾病,如甲状腺功能低下、甲状腺功能亢进、毒性弥漫性甲状腺肿。在反映甲状腺功能紊乱上,血清TSH比甲状腺激素更敏感,国内外均推荐以血清TSH测定作为甲状腺功能紊乱的首选筛查项目。而FT4、FT3是具有生理活性的甲状腺激素,能真实反映甲状腺功能的状况和更重要的临床参考价值,故许多实验室常将TSH、FT4、FT3联合检测,以更好地评价甲状腺功能。
通过查阅相关资料和文献,目前国内外大多数实验室所建立甲状腺功能指标参考区间的尺度仅局限于成人,并未将新生儿这一特殊个体考虑在内,所以本研究通过在新生儿科收集的120份新鮮血清,建立新生儿甲状腺功能的生物参考区间。目前实验室TSH、FT4、FT3现用区间分别为0.350 0~4.940 0 mIU/L,9.01~19.05 pmol/L,2.63~5.70 pmol/L,而本研究新建立的TSH、FT4、FT3生物参考区间分别为0.606~13.863 mIU/L、9.29~23.05 pmol/L、2.75~5.60 pmol/L。对比可知,两者存在一定差异。除此之外,在初步建立新参考区间后,随机抽取LIS系统新生儿科中60个新生儿血清标本进行验证,检测结果显示甲状腺功能三项指标均有95%落在新参考区间,证明本研究新建立的参考区间通过验证,比原先参考区间更适用于本实验室,从以下几点可以看出。
新生儿处于快速生长发育期,甲状腺大量合成甲状腺激素,因此各类激素水平与TSH水平可同时增高。查阅相关文献,也并未提及新生儿与成人甲状腺结构有何不同,但血清TSH在新生儿出生后因受寒冷刺激迅速升高,于24 h内迅速下降,4 d内降至正常水平。血清游离FT4同TSH,亦在出生后很快升高,6周内降低[9-10]。而新生儿血清游离FT3在出生时较低,生后4 h可增高,于生后5~6 d内降至成人的正常高值,到青春期达成人水平。
近期有研究表明,无论母亲孕期甲亢或甲减,均可影响新生儿的甲状腺功能,导致胎儿、新生儿的生长及神经系统发育异常。可能是由于T4在胚胎期合成的能力有限,依赖于母体的供给,当孕母患有甲亢时,可造成新生儿甲亢、新生儿甲减及新生儿暂时性高促甲状腺激素血症[11-13]。妊娠期Graves病的患者,体内的促甲状腺激素受体抗体(TRAb)可以通过胎盘传递到胎儿,从而影响胎儿甲状腺的发育,可能导致胎儿宫内发育迟缓与新生儿甲亢。当孕母患甲减时,可引起新生儿甲状腺功能减低症及高促甲状腺激素血症[14]。由于甲状腺功能异常的孕妇会生出甲状腺功能异常的宝宝,所以可以推测新生儿的甲状腺功能指标会不同于成人。
本研究随机抽取的新生儿大多数均有高胆红素血症、呼吸窘迫综合征、早产儿等诊断,而这些变化大多是生理性的。但查阅资料发现,当甲状腺功能低下时,肝脏尿苷二磷酸葡萄糖醛酸转移酶(UDPGT)的活性會降低并可持续数周到数月,且影响肝脏胆红素的摄取和转运。高胆红素血症患儿T3水平较正常足月新生儿低,T3水平越低,黄疸程度越重[15-16],因此甲状腺功能低下与新生儿高胆红素血症存在一定的关联。有资料显示,甲状腺激素水平与早产儿成熟程度密切相关,早产儿甲状腺激素水平较足月儿低,而且胎龄越小,T4与FT4越低,可能是因甲状腺不成熟合成能力下降、组织脱碘酶活性低下、TBG相对缺乏等造成,而早产儿TSH无明显升高[17-19]。亦有资料显示,早产是早产儿暂时性低甲状腺素血症的根本原因,胎龄越小,早产儿甲状腺功能越低下,而孕母糖耐量异常、性别、出生体重比值、呼吸窘迫综合征也可能影响早产儿的甲状腺功能[20]。而新生儿窒息亦可导致甲状腺功能受损,且随着窒息加重程度而加重。以上资料表明,新生儿出生后的种种因素均可影响甲状腺功能的各项指标。
本研究使用的试剂盒是美国雅培制药有限公司生产的,它研究的人群范围是欧美国家成年人,但由于人种、地域环境、生物属性、饮食结构有所差异,其参考区间对亚洲人,尤其是新生儿,是否适合本实验室还有待于进一步探讨。其次,本研究收集的标本量不多,仅120例,不能完全准确地代表本地区新生儿甲状腺功能的状况,若要详细严谨地研究验证,应增加足够多参考个体的样本含量,提高对参考区间估计的精密度。
综上所述,生物参考区间是临床医生判断人体是否健康的标准之一,实验室必须建立适用于当地的生物参考区间并提供给临床,否则会导致误诊或过度治疗,因此实验室建立生物参考区间的意义和责任重大。
参考文献
[1]中国合格评定国家认可委员会.ISO15189:2012,IDT:医学实验室质量和能力认可规则[S].3版,北京:中国科学质量出版社,2012:1-47.
[2]汪吉梅,王雪峰,赵瑞芳,等.正常足月新生儿脐血甲状腺激素水平的研究[J].中国优生与遗传杂志,2013,21(12):109-116.
[3] Korevaar T I,Muetzel R,Medici M,et al.Association of maternal thyroid function during early pregnancy with offspring IQ and brain morphology in childhood:a population-based prospective cohort study[J].Lancet Diabetes Endocrinol,2016,4(1):35-43.
[4] Pemberton H N,Franklyn J A,Kilby M D.Thyroid hormones and fetal brain development[J].Minerva Ginecol,2005,57(4):367-378.
[5]刘凤媚,陈银娟,莫信爱,等.新生儿甲状腺功能低下筛查有利于早发现与早诊断的体会[J].当代医学,2012,18(36):5-6.
[6] Hisada A,Shimodaira K,Okai T,et al.Associations between levels of hydroxylated PCBs and PCBs in serum of pregnant women and blood thyroid hormone levels and body size of neonates[J].Int J Hyg Environ Health,2014,217(4-5):546-553.
[7] Solis J C,Valverde C.Neonatal hypothyroidism,pathophysiogenic,molecular and clinical aspects[J].Rev Invest Clin,2006,58(4):318-334.
[8]尚红,王毓三,申子瑜,等.全国临床检验操作规程[M].4版.北京:人民卫生出版社,2015:359-366.
[9] Leonardi D,Polizzotti N,Carta A,et al.Longitudinal Study of Thyroid Function in Children with Mild Hyperthyrotropinemia at Neonatal Screening for Congenital Hypothyroidism[J].Journal of Clinical Endocrinology & Metabolism,2008,93(7):2679-2685.
[10] Aktas O N,Gursoy T,Soysal E,et al.Thyroid hormone levels in late preterm,early term and term infants:a study with healthy neonates revealing reference values and factors affecting thyroid hormones[J].J Pediatr Endocrinol Metab,2017,30(11):1191-1196.
[11]刘红,刘长云,高琳芝,等.新生儿甲状腺功能异常的相关因素[J].山东医药,2016,56(15):92-94.
[12] Barjaktarovic M,Steegers E A P,Jaddoe V W V,et al.The Association of Thyroid Function With Maternal and Neonatal Homocysteine Concentrations[J].J Clin Endocrinol Metab,2017,102(12):4548-4556.
[13] Leeuwen L,van Heijst A F J,van Rosmalen J,et al.Changes in thyroid hormone concentrations during neonatal extracorporeal membrane oxygenation[J].J Perinatol,2017,37(8):906-910.
[14]林建春,陽红梅,张旋.未结合胆红素升高对新生儿甲状腺激素水平的影响[J].中国现代药物应用,2016,10(14):67-68.
[15] Koulouri O,Nicholas A K,Schoenmakers E,et al.A Novel Thyrotropin-Releasing Hormone Receptor Missense Mutation(P81R)in Central Congenital Hypothyroidism[J].J Clin Endocrinol Metab,2016,101(3):847-851.
[16]宋嘉,姚秀俊,杨波,等.早产儿甲状腺功能的临床研究[J].中国儿童保健杂志,2009,17(6):729-731.
[17] Kucharska A M,Beń-Skowronek I,Walczak M,et al.Congenital hypothyroidism-Polish recommendations for therapy,treatment monitoring,and screening tests in special categories of neonates with increased risk of hypothyroidism[J].Endokrynol Pol,2016,67(5):536-547.
[18] Dandamrongrak P,Chawanpaiboon S.Correlation between Iodine Supplement in Pregnancy and Neonatal TSH Level[J].J Med Assoc Thai,2016,99(12):1257-1262.
[19] Chauvet P,Terral D,Colombier M,et al.Iodinated contrast in pregnant women and neonatal thyroid function[J].Gynecol Obstet Fertil,2016,44(12):685-689.
[20]朱艳可,陈泗虎,王楸,等.早产儿甲状腺功能影响因素分析[J].中国优生与遗传杂志,2011,19(4):78-79,3.
(收稿日期:2018-09-20) (本文编辑:程旭然)
