解郁安神颗粒对卒中后抑郁小鼠模型的抗抑郁作用*
2019-01-16邹龑杜源傅风华
邹龑,杜源,傅风华,
(1.山东中医药大学药学院,济南 250014;2.烟台大学药学院,烟台 264005)
卒中后抑郁(post-stroke depression,PSD)是最常见的脑血管疾病并发症,是卒中后出现的以思维缓慢、情感低落、语言动作迟滞为主要表现的情感障碍性疾病[1],其卒中后发病率29%~70%[2]。PSD是一种继发性情感障碍,严重阻碍患者肢体功能和认知功能恢复,增加病死率[3]。针对PSD本虚标实的特点,临床治疗中多应用疏肝益气、活血解郁法组方用药[4-5]。
PSD的发病机制尚不明确。经典的单胺递质假说认为PSD的发生与去甲肾上腺素(norepinephrine,NE)、多巴胺(dopamine,DA)及5-羟色胺(5-hydroxytryptamine,5-HT)单胺递质的水平降低密切相关[6]。此外,5-羟色胺1A受体(5-HT1Areceptor,5-HT1AR)在大脑海马内分布最为广泛,且与抑郁发生密切相关,是临床抑郁症药物治疗的重要靶点[7]。目前临床上以选择性5-羟色胺再摄取抑制药(selective serotonin reuptake inhibitor,SSRIs)为一线用药,例如西酞普兰、氟西汀等[8-9]。解郁安神颗粒(JieyuAnshengranule,JY)为中药成方制剂,其处方组成为柴胡、大枣、石菖蒲、半夏(制)、白术(炒)、浮小麦、远志(制)、甘草(炙)、栀子(炒)、百合、胆南星、郁金、龙齿、酸枣仁(炒)、茯苓、当归。其功效为疏肝解郁,安神定志。本研究旨在评价JY对PSD小鼠抑郁样行为学,以及对海马单胺神经递质水平及5-HT1AR表达的影响,研究其抗抑郁作用及机制,为JY的临床应用提供实验依据。
1 材料与方法
1.1实验动物 无特定病原体(SPF)级昆明种小鼠,雄性,8周龄,体质量30~35 g,由济南朋悦实验动物繁育公司提供,许可证号:SYXK(鲁)20140007。自由摄食和饮水,饲养环境22~24 ℃,相对湿度为40%~60%。
1.2药品与试剂 JY(通化利民药业集团有限公司,规格:每袋5 g,批号:140607;艾司西酞普兰片(丹麦灵北药厂生产,西安杨森制药有限公司分装,规格:每片10 mg,批号:151218117);水合氯醛(国药集团化学试剂有限公司,批号 :20130426);羧甲基纤维素钠(天津市科密欧化学试剂有限公司,批号:20110809)。去甲肾上腺素(norepinephrine,NE)(批号:100169-201404)、DA(批号:100070-201507)及5-HT(批号:111656-200401)对照品均购自中国食品药品检定研究院。
1.3方法 PSD小鼠模型参照相关文献[10-11],采用双侧颈总动脉线栓再灌联合慢性不可预知性温和刺激(chronic unpredicted mild stress,CUMS)制备。具体操作:动物用乌拉坦麻醉后固定,颈部用聚维酮碘消毒,在其正中线作一纵行切口,钝性分离皮肤以及皮下组织,分离双侧颈总动脉,用止血钳夹闭双侧颈总动脉阻断血流5 min,随后松开止血钳使血复灌10 min,再次用止血钳夹闭双侧颈总动脉阻断血流5 min,随后松开止血钳,将切口缝合,消毒操作区域。在脑缺血后第2天起,进行CUMS以建立PSD模型,包括:4 ℃ 冰水游泳、过夜照明、禁水、禁食、夹尾、潮湿垫料及合笼。共计7种刺激方法。每天1或2种,连续刺激18 d。除正常对照组外,将PSD模型小鼠随机均分为模型对照组,艾司西酞普兰组(5 mg·kg-1),JY 小、中、大剂量组(JY0.75,1.50及3.00 g·kg-1),每组12只。正常对照组及模型对照组给予空白溶媒(0.5%羧甲基纤维素钠),其余各组每日灌胃给药1次,连续给药28 d,给药体积均为10 mL·kg-1。
1.4抑郁样行为学检测
1.4.1强迫游泳实验 实验在第20天进行。正式实验前小鼠在实验室首先适应环境至少1 h,然后将小鼠放入强迫游泳实验装置(高35 cm,直径15 cm的透明圆柱形桶,水深35 cm),使小鼠在水中前爪攀附于缸壁,并且不能以后爪支撑身体为标准,15 min后取出动物。正式实验时,将动物置于强迫游泳实验装置,保持水温(25±2) ℃。观察6 min,记录后5 min内累计不动时间。
1.4.2悬尾实验 实验在第21天进行。采用小鼠专用悬尾箱(30 cm×30 cm×40 cm,内有固定吊环),距尾尖2 cm处用医用胶布固定于吊环上,使其头部距离地面15 cm。实验时悬挂6 min,记录累计不动时间。
1.5小鼠海马NE、DA及5-HT水平检测 给药结束后,将小鼠处死,取脑,于冰上迅速剥离海马组织,称湿重,以1:9加入0.01 mol·L-1磷酸盐缓冲液(PBS),充分匀浆,再向匀浆液中加入其二分之一体积的6%高氯酸,充分涡旋, 4 ℃下16 000 r·min-1离心20 min(r=7.1 cm)。吸取上清液100 μL,过孔径0.45 μm滤膜滤过后用高效液相色谱法进行检测。
色谱条件:色谱柱为SHIMADZU VP-ODS C18柱(250 mm× 4.6 mm,5 μm);水相为0.01 mol·L-1醋酸钾缓冲液,流动相为甲醇-水(10:90),用0.2 mol·L-1柠檬酸调pH值至4.0等度洗脱;柱温为25 ℃;流速为1.0 mL·min-1;检测波长:275 nm。NE,DA及5-HT的保留时间分别为3.37,5.02及10.08 min。
1.6小鼠海马5-HT1AR表达检测 实验结束后,将小鼠处死,取脑,于冰上迅速剥离海马组织,称取海马组织20 mg,加入RIPA裂解液250 μL,于冰上匀浆,4 ℃下12 000 r·min-1离心5 min(r=7.1 cm),收集上清液,即为蛋白,测定蛋白浓度。随即将上清液加入5倍上样缓冲液,煮沸10 min。10% SDS-PAGE凝胶电泳后进行转膜,随即5%脱脂奶粉溶液封闭2 h,加入5-HT1AR一抗于4 ℃过夜孵育。TBST洗膜10 min × 3 次,加入二抗常温孵育1 h,同法洗膜,放入凝胶成像系统,曝光摄像。图像分析用ImageQuant LAS 4000软件计算吸光度值(A)。

2 结果
2.1JY对PSD小鼠抑郁样行为的影响
2.1.1JY对PSD小鼠游泳不动时间的影响 见图1,与正常对照组比较,模型对照组小鼠游泳不动时间明显增加(P<0.01)。与模型对照组比较,艾司西酞普兰组及JY小及中剂量组小鼠游泳不动时间明显减少(P<0.05),JY大剂量组小鼠游泳不动时间有一定程度减少,但差异无统计学意义。表明PSD小鼠绝望不动的时间明显增加,其表现出明显的绝望情绪;而给药后PSD小鼠不动时间减少,说明艾司西酞普兰及JY(小、中剂量)均能明显改善PSD小鼠的绝望情绪。

与正常对照组比较,*1P<0.05;与模型对照组比较,*2P<0.05

Compared with normal control group,*1P<0.05;Compared with model control group,*2P<0.05

2.1.2JY对PSD小鼠悬尾不动时间的影响 见图2,与正常对照组比较,模型对照组小鼠悬尾不动时间明显增加(P<0.01)。与模型对照组比较,艾司西酞普兰组及JY中、大剂量组小鼠悬尾不动时间明显减少(P<0.05)。结果表明PSD小鼠绝望不动时间明显增加,其表现出明显的绝望情绪;而给药后PSD小鼠的不动时间减少,说明艾司西酞普兰组及JY(中、大剂量)均能明显改善PSD小鼠的绝望情绪。
2.2JY对PSD小鼠海马NE、DA及5-HT水平的影响 见表1。与正常对照组比较,模型对照组小鼠海马NE、DA及5-HT水平明显均降低(P<0.05,P<0.01)。与模型对照组比较,艾司西酞普兰组小鼠海马5-HT,JY中剂量组小鼠海马NE、DA及5-HT,以及JY大剂量组小鼠海马NE水平明显升高(P<0.05,P<0.01)。结果表明PSD小鼠海马NE等单胺类神经递质水平均明显降低;而JY中、大剂量能明显增加PSD小鼠海马NE等单胺类神经递质水平,其对NE、DA及5-HT水平均有明显上调作用。艾司西酞普兰仅能明显增加PSD小鼠海马5-HT水平。

与正常对照组比较,*1P<0.05;与模型对照组比较,*2P<0.05,*3P<0.01

Compared with normal control group,*1P<0.05;compared with model control group,*2P<0.05,*3P<0.01

表16组小鼠海马NE、DA及5-HT水平比较
Tab.1ComparisonofNE,DAand5-HTinhippocampusamongsixgroupsofmice

组别NEDA5-HT正常对照组47.48±4.144.49±0.140.67±0.12模型对照组33.31±3.84*13.55±0.08*20.38±0.05*1艾司西酞普兰组44.95±7.793.25±0.410.74±0.07*3JY小剂量组45.74±4.393.64±0.280.46±0.07JY中剂量组47.75±3.34*44.92±0.62*40.53±0.06*4JY大剂量组55.88±4.56*33.40±0.330.46±0.06F26.53242.25840.523
与正常对照组比较,*1P<0.05,*2P<0.01;与模型对照组比较,*3P<0.01,*4P<0.05
Compared with normal control group,*1P<0.05,*2P<0.01;compared with model control group,*3P<0.01,*4P<0.05
2.3JY对PSD小鼠海马5-HT1AR表达的影响 见图3。与正常对照组比较,模型对照组小鼠海马5-HT1AR表达明显降低(P<0.01);与模型对照组比较,JY中、大剂量组小鼠海马5-HT1AR表达均明显升高(P<0.01)。结果表明PSD小鼠海马5-HT1AR表达明显降低;而JY中、大剂量均能够明显上调PSD小鼠海马5-HT1AR表达。
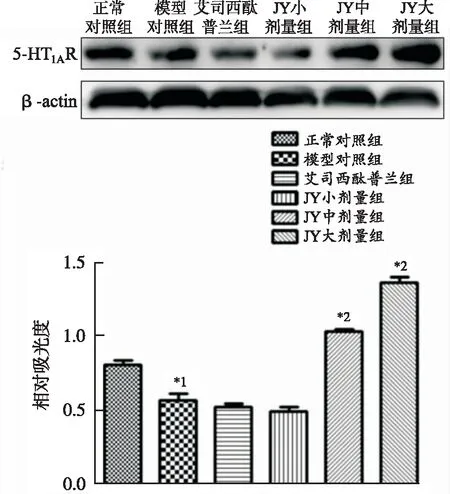
与正常对照组比较,*1P<0.01;与模型对照组比较,*2P<0.01

Compared with normal control group,*1P<0.01;Compared with model control group,*2P<0.01

3 讨论
PSD是发生于卒中之后的郁证,是在卒中基础上出现以情绪低落、兴趣减少、缺乏主动性、悲观、失望、食欲不振等症状[12]。中医学将其归属“郁证”与“卒中”之合病,该病病因为肝郁气滞,病理基础为肝肾衰弱,病理特点为肝肾下虚,风痰阻络[13]。西医对PSD的发病机制尚不明确,目前普遍接受包括神经内分泌机制和社会心理学机制[14]。抗抑郁药物可以快速有效地治疗PSD,显著改善患者的认知和预后,已成为治疗PSD的重要手段[15]。SSRIs是PSD的治疗首选药物,但大都需2~4周才能充分显效,且存在一定不良反应。中医药近年来在治疗PSD方面卓有成效,且因不良反应少易被人们接受。
PSD动物模型目前多采用卒中伴抑郁的复合模型,经典制备方法为结扎(或线栓)后联合CUMS模型,符合人脑卒中后抑郁的病理特点[16]。因此本研究采用双侧颈总动脉线栓再灌注法制备脑缺血小鼠模型,再给予CUMS联合制备PSD小鼠模型,其表现出绝望等抑郁核心症状。
绝望情绪是PSD患者临床表现的重要症状[17]。强迫游泳和悬尾实验是抑郁样行为学中评价药物抗抑郁作用的经典方法[18]。强迫游泳实验是利用动物无法逃脱水淹而诱导产生绝望行为,悬尾实验是利用动物无法克服不正常体位而诱导产生绝望行为,二者使动物产生绝望情绪的机制有一定差别[19]。本研究中,PSD小鼠在挣扎后表现出不动状态,其“无助”的行为程度能够反映其绝望状态。因此,在悬尾实验中,通过对PSD小鼠不动状态的行为学检测,包括游泳不动时间和悬尾不动时间,评价动物的抑郁样行为。本研究发现,艾司西酞普兰及JY均能明显减少PSD小鼠的游泳不动时间及悬尾不动时间。因此,艾司西酞普兰及JY均能明显逆转PSD小鼠的绝望情绪。
PSD发病机制中经典假说为单胺类递质系统失衡假说,即单胺类神经递质系统功能低下,尤其是NE及5-HT等单胺类递质水平的低下[20-21]。海马是参与调节情感、认知、行为的重要中枢[22]。NE、5-HT及DA作为中枢系统极其重要的神经递质,均可参与情感、情绪、行为、痛觉及睡眠等多项生理功能的调节[23]。以往研究发现PSD大鼠海马组织5-HT、NE 及DA水平与正常大鼠及单纯卒中大鼠比较均显著降低[24]。5-HT1AR主要分布于与情感调节密切相关的边缘系统(尤其分布于海马神经元和齿状回的突触后膜),其功能异常与PSD的发生密切相关[22]。据报道[25],与正常动物比较,抑郁动物模型的海马5-HT1AR表达显著降低,抗抑郁药能够通过上调抑郁动物海马5-HT1AR表达发挥抗抑郁的作用。本研究发现,PSD小鼠海马5-HT1AR表达明显降低,而JY能够明显上调其海马5-HT1AR表达,表明JY发挥抗抑郁的作用应与上调其海马5-HT1AR表达有关。
综上所述, JY对PSD小鼠的抑郁样行为具有明显的改善作用,可明显逆转PSD小鼠的绝望情绪,同时PSD小鼠海马NE等单胺类神经递质水平及5-HT1AR表达明显升高,说明JY对PSD小鼠模型具有抗抑郁的作用,其抗抑郁作用可能是通过提高海马NE、DA及5-HT水平,以及上调海马5-HT1AR表达来实现的。
