应用AG490阻断STAT3对系统性红斑狼疮Th17/Treg平衡的调控研究
2019-01-15黄可可周春燕颜志婷叶海燕
黄可可 周春燕 颜志婷 叶海燕


【摘要】 目的:研究應用免疫抑制剂AG490阻断信号传导与转录活化因子3(STAT3)对系统性红斑狼疮(SLE) 患者辅助性T细胞17(Th17)/调节性T细胞(Treg)平衡的调控。方法:选取本院于2018年10月-2019年6月收治的10例SLE(观察组)以及10例体检健康者(对照组),抽取所有受试者外周血约10 mL,采用免疫磁珠法提取CD4+T细胞,并用流式细胞术检测所有受试者Th17/Treg细胞亚群变化。用AG490(0、25、50、100 μM)处理患者CD4+T细胞,检测Th17/Treg细胞亚群以及细胞因子变化,并采用Q-PCR了解STAT3、Foxp3、RORγt水平。结果:观察组患者Th17显著高于对照组,而Treg水平显著低于对照组,两组患者Th17/Treg比较,差异有统计学意义(P<0.05)。随着AG490浓度的增加,Th17/Treg比值、IL-6、IL-17表达水平均逐渐降低,而IL-10、TGF-β水平均显著增加,各组间比较差异均有统计学意义(P<0.05)。经过不同浓度AG490处理后,STAT3、RORγt mRNA水平以及STAT3蛋白水平均显著降低,其中100 μM剂量组蛋白水平显著低于其他三组,而Foxp3 mRNA水平显著增加,各组mRNA水平比较,差异均有统计学意义(P<0.05)。结论:通过阻断STAT3信号通路,可诱导Treg分化以及抑制Th17分化,从而调控Th17/Treg平衡,可为系统性红斑狼疮的治疗提供新方向。
【关键词】 信号传导与转录活化因子3 系统性红斑狼疮 辅助性T细胞17 调节性T细胞
[Abstract] Objective: To study the regulation of Th17/Treg balance in systemic lupus erythematosus by blocking STAT3. Method: A total of 10 cases of SLE (observation group) and 10 healthy persons undergoing physical examination (control group) were selected in our hospital from October 2018 to June 2019. All subjects were drawn with peripheral blood of about 10 mL, CD4+ T cells were extracted by immunomagnetic beads method and the changes of Th17/Treg cell subsets were detected by flow cytometry. CD4+ T cells were treated with AG490 (0, 25, 50, 100 μM), the changes of Th17/Treg cell subsets and cytokines were detected and the levels of STAT3, Foxp3, RORγt were detected by Q-PCR. Result: The level of Th17 in the observation group was significantly higher than that in the control group, but the level of Treg was significantly lower than that in the control group, there was significant difference in Th17/Treg between the two groups (P<0.05). With the increase of AG490 concentration, the expression level of Th17/Treg ratio and IL-6, IL-17 decreased gradually, while the level of IL-10, TGF-β increased significantly, with significant difference among the groups (P<0.05). After AG490 treatment, the levels of STAT3, RORγt mRNA and STAT3 protein were significantly decreased, the levels of 100 μM dose group were significantly lower than those of the other three groups, while the level of Foxp3 mRNA was significantly increased, and the level of mRNA in each group was significantly different (P<0.05). Conclusion: Blocking STAT3 signaling pathway can induce Treg differentiation and inhibit Th17 differentiation, thus regulating Th17/Treg balance, which can provide a new direction for the treatment of systemic lupus erythematosus.
[Key words] Signal transduction and activator of transcription 3 Systemic lupus erythematosus Helper T cells Regulatory T cells
First-authors address: Pingxiang Peoples Hospital, Pingxiang 337000, China
doi:10.3969/j.issn.1674-4985.2019.34.036
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及多系统、多器官的自身免疫性疾病,其发病可能涉及环境因素、遗传因素、药物以及激素等多个方面[1]。尽管目前对于其的具体机制尚未明确,但越来越多研究表明T细胞功能过度活化在SLE发病机制中起着重要作用[2-3]。AG490(α-氰基-(3,4-羟基)N-苄苯乙烯胺)是JAK2(Janus蛋白酪氨酸激酶)的特異性拮抗剂,JAK2/STAT信号转导途径是Th细胞极化和增殖的重要通路,其中信号转导和转录活化因子3(signal transducer and activator of transcription 3, STAT3)是Th17细胞分化、增殖信号转导通路的核心,可调控辅助性T细胞17(T helper 17 cells, Th17)和调节性T细胞(regulator T cells,Treg)的平衡[4]。研究表明SLE的发生发展与Th17/Treg平衡失调,其中Th17可分泌IL-17,从而加强TNF-α的致炎作用,而Treg通过分泌负性调节因子(TGF-β、IL-10)发挥免疫抑制作用,从而降低机体炎症反应[5]。王慧莲等[6]研究发现通过升高Treg、降低Th17细胞的比例可发挥SLE治疗效果。目前针对细胞免疫异常的免疫干预治疗逐渐成为SLE研究热点,本课题组结合免疫学领域最新研究成果,提出应用AG490阻断STAT3后对SLE Th17/Treg平衡的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取本院于2018年10月-2019年6月收治的10例SLE患者(观察组)以及10例体检健康者(对照组),年龄18~60岁,男8例,女12例。该研究已获得伦理委员会批准。纳入标准:符合中华医学会风湿病学分会颁布的关于SLE诊断标准[7];年龄≥18岁,生命体征良好;对照组受试者均为同期于本院体检合格者,且随机选择,病历资料完整。排除标准:合并自身免疫性疾病、活动期的结核性疾病、严重感染者(危及生命);严重心肺功能不全者,凝血功能障碍,精神疾病者;入组前半年使用免疫抑制剂。
1.2 方法
1.2.1 样品收集 受试者入组后于清晨空腹抽取外周肘静脉血约10 mL,置于肝素钠抗凝管中,根据试剂盒操作步骤,采用免疫磁珠法分离,获取受试者外周血中的CD4+T细胞,流式细胞仪检测结果显示细胞纯度超过90%,并于CD4+T细胞中加入AIM-V Medium CTS培养基,置于饱和湿度培养箱(37 ℃×5% CO2)中培养,便可进行以下各项实验操作。
1.2.2 Th17与Treg细胞水平 采用流式细胞术检测两组受试者Th17、Treg水平,具体操作如下:分离得到CD4+T细胞后,加入表面染色FITC-IL-10或者FITC-IL-17,细胞经过固定、破膜后,加入PE-RORγt进行染色,于4 ℃温孵育30 min,用PBS洗涤3次后并悬浮于PBS中,采用流式细胞术检测即可。
1.2.3 AG490处理 观察组10例患者CD4+T细胞等体积混匀后平行取4×5份混合细胞,分别加入不同浓度的AG490(0、25、50、100 μM),即每个浓度平行5次,于饱和湿度培养箱(37 ℃×5% CO2)中培养72 h后可依次检测细胞活力、细胞因子水平以及STAT3 mRNA水平。
1.2.4 细胞因子水平 观察组10例患者CD4+T细胞等体积混匀后平行取4×5份混合细胞,分别加入不同浓度的AG490(0、25、50、100 μM),即每个浓度平行5次,取出经不同浓度处理后的CD4+T细胞,按照ELISA试剂合说明书操作检测IL-6、IL-10、IL-17和TGF-β的水平,采用多功能酶标仪测量每孔OD值,λ为450 nm,平行5份。
1.2.5 相关mRNA水平 观察组10例患者CD4+T细胞等体积混匀后平行取4×5份混合细胞,分别加入不同浓度的AG490(0、25、50、100 μM),即每个浓度平行5次,取出经不同浓度处理后的CD4+T细胞,采用Trizol提取细胞总RNA,取出2 μg反转录为cDNA,随后对反转录产物进行PCR反应,以GAPDH为内参基因,按照mRNA检测试剂盒提示建立PCR反应体系,具体条件:50 ℃、2 min;95 ℃、15 min;60 ℃、30 s;72 ℃、30 s,共40个循环,用2-ΔΔCt计算表示表达水平。见表1。
1.2.6 STAT3蛋白水平 采用Western blot测定STAT3蛋白水平。收集不同浓度处理后的CD4+T细胞,提取总蛋白,采用BCA法测定蛋白浓度。将待测蛋白液上样到十二烷基磺酸钠-聚丙烯酰胺(10%)凝胶电泳中,对蛋白质进行电泳分离,随即转移至PVDF膜,脱脂奶粉(5%)封闭1 h,将膜取出,清洗,分别加入稀释度为1︰1 000β-Actin、1︰1 000 STAT3的一抗孵育,4 ℃过夜,TBST洗涤3次,使用二抗辣根过氧化物酶标记物(浓度1︰2 000) 37 ℃孵育2 h,TBST洗涤3次,最后滴加ECL进行曝光显影,检测蛋白质条带,分析各条带灰度值,STAT3与β-Actin条带灰度值之比为蛋白相对表达量。
1.3 统计学处理 采用SPSS 19.0统计软件进行分析,计量资料采用(x±s)表示,比较采用t检验,多组间比较采用F检验,计数资料采用率(%)表示,比较采用字2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组基线资料比较 两组受试者基本资料比较,差异均无统计学意义(P>0.05),见表2。
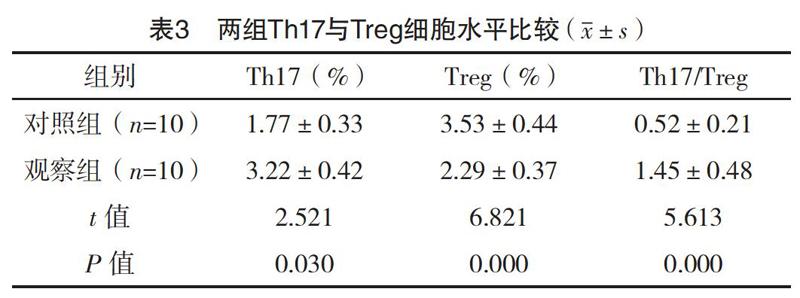
2.2 两组Th17与Treg细胞水平比较 观察组患者Th17显著高于对照组,而Treg水平显著低于对照组,两组患者Th17/Treg差异显著,两组比较差异均有统计学意义(P<0.05)。见表3。
2.3 不同浓度AG490对两组Th17/Treg细胞平衡的影响 给予不同浓度的AG490后Th17/Treg比值均显著低于空白观察组(未加AG490)的(1.45±0.48),AG490浓度分别为25、50、100 μM时,Th17/Treg比值分别为(1.07±0.32)、(0.78±0.21)、(0.62±0.14),各組Th17/Treg水平比较,差异均有统计学意义(F=16.298,P=0.000)。
2.4 不同浓度AG490对Th17与Treg细胞因子水平的影响 随着AG490浓度的增加IL-6、IL-17表达水平均显著降低,而IL-10、TGF-β水平均显著增加(P<0.05),见表4。
2.5 不同浓度AG490对相关mRNA水平的影响 经过不同浓度AG490处理后,STAT3、RORγt mRNA水平均显著降低,Foxp3 mRNA水平显著增加,其中加入不同浓度(0、25、50、100 μM)的AG490后,各组mRNA水平比较,差异均有统计学意义(P<0.05),见表5。
2.6 不同浓度AG490对STAT3蛋白水平的影响 经过不同浓度AG490处理后,STAT3蛋白水平显著低于未给予AG490组的(0.95±0.25),AG490浓度分别为25、50、100 μM时,STAT3蛋白水平分别为(0.75±0.18)、(0.57±0.09)、(0.45±0.06),各组STAT3蛋白水平比较,差异有统计学意义(F=8.931,P=0.000)。见图1。
3 讨论
SLE是临床常见的免疫系统疾病,多发于女性,可累及中枢神经、皮肤黏膜、骨骼肌肉、肾等[8]。
T淋巴细胞是机体重要的免疫细胞,可在特定环境中分化为Th1、Th2、Th17、Treg等细胞,共同调控机体免疫反应,其中Th17与Treg的分化发育相互制约,Treg细胞可分泌TGF-β和IL-10,从而抑制巨噬、淋巴细胞的免疫功能,维持机体免疫耐受,而Th17则分泌IL-17、IL-6,从而调节炎症细胞向组织局部浸润,引起系统损伤[9-10]。Th17/Treg平衡失调,则可反映SLE进展。此次研究结果显示,观察组患者Th17、Th17/Treg均显著高于对照组,而Treg水平均显著低于对照组(P<0.05),与胡伟等[11]报道一致,Th17/Treg的免疫平衡参与SLE的病理生理进程,其中Th17水平的增加可加剧机体炎性反应,促进SLE发展。
目前SLE的治疗通常采用以糖皮质激素为基础的免疫抑制剂联合疗法,但抑制不足导致病情迁延反复,尽管西罗莫司、霉酚酸酯等新型免疫抑制剂不断涌现,但是疗效欠佳,因此深入了解SLE的发病机制至关重要[12-13]。STAT3可通过调控JAK/STAT通路而参与细胞增殖、分化、免疫调节等过程,可与转录因子RORγt结合,调控Th17细胞分化增殖,还能与Treg细胞Foxp3基因转录启动子上特定部位结合抑制Foxp3的表达,诱导Treg向Th17转化,引起系膜细胞增殖、皮肤病变、瘙痒等[14-15]。陈曦等[16]报道显示阻断该信号通路可调控T细胞趋化活性,但具体作用机制并未明确。本次选用AG490作为JAK/STAT信号通路特异性阻断剂,通过给予不同浓度(0、25、50、100 μM)的AG490后,发现随着浓度的增加Th17/Treg比值逐渐降低,表明AG490抑制JAK/STAT信号通路后,Th17分化程度逐渐降低,而Treg分化程度逐渐增加,故而经过AG490处理后IL-6、IL-17表达水平均显著降低,而IL-10、TGF-β水平均显著增加(P<0.05)。其中Th17分泌的IL-17可加强TNF-α的致炎作用,以及促进机体中心粒细胞的增殖、分化以及趋化,从而发挥强大的促炎性作用,而IL6可诱导STAT3的活化,促进STAT3作用于IL-17启动区,诱导IL-17的分泌,两者相互作用,共同加快了Th17的分化,加重疾病进展[6,17]。IL-10、TGF-β是由Treg分泌的一类抑制性的细胞因子,通过加入AG490后使得Treg分化程度增加,故而IL-10、TGF-β表达水平显著增加。
RORγt、Foxp3分别为Th17、Treg细胞特异性转录因子[18],通过AG490处理后,Th17/Treg平衡向Treg失衡,故而RORγt mRNA表达水平显著降低,而Foxp3 mRNA水平显著增加,与王慧莲等[6]报道一致,即通过升高Treg以及降低Th17细胞的比例,可有效调控RORγt、Foxp3的水平,可为SLE治疗提供新的切入点。Foxp3、RORγt相互拮抗,经过AG490处理后,STAT3表达降低,Foxp3会优先表达,促进Treg细胞的分化,一旦抑制解除,STAT3则高表达,STAT3则会抑制Foxp3的表达,从而促进Treg向Th17转化,诱导IL-17的分泌[19]。故而应用AG490阻断STAT3信号通路后,可抑制Th17的分化,从而使得Th17细胞相关因子表达水平降低,可缓解缓、炎性反应,解除STAT3对Foxp3的抑制,有利于Treg分化,Treg分化相关因子表达的增加,使得使Th17/Treg平衡向Treg倾斜,从而稳定机体免疫应答和诱导免疫耐受,发挥SLE的治疗效果。
综上所述,通过阻断STAT3信号通路,可诱导Treg分化以及抑制Th17分化,从而调控Th17/Treg平衡,可为系统性红斑狼疮的治疗提供新方向。
参考文献
[1] Weidenbusch M,Kulkarni O P,Anders H J.The innate immune system in human systemic lupus erythematosus[J].Clini Sci,2017,131(8):625-634.
[2]李志,杨婷婷,李文哲,等.系统性红斑狼疮患者外周血Th17与Treg细胞及相关细胞因子表达的研究[J].中国实验诊断学,2015,19(2):253-255.
[3]蔡小燕,罗敏,林小军,等.Th17和Treg细胞在系统性红斑狼疮患者外周血中的表达[J].中华医学杂志,2012,92(7):460-463.
[4]潘志鹏,伦永志.JAK/STAT信号通路在机体免疫及相关疾病中的作用机制[J].中国免疫学杂志,2016,32(9):1395-1399.
[5]郝慧琴,张少然,李小峰,等.外周血Th17细胞及Treg细胞检测对系统性红斑狼疮病情的评估价值[J].中国实用内科杂志,2018,38(3):73-75.
[6]王慧莲,孟庆良,李松伟,等.茯苓多糖对系统性红斑狼疮患者Thl7/Treg平衡的影响[J].中国病理生理杂志,2017,33(8):1514-1519.
[7]中华医学会风湿病学分会.系统性红斑狼疮诊断及治疗指南中华医学会风湿病学分会[J].中华风湿病学杂志,2010,14(5):342-346.
[8] Dai C,Deng Y,Quinlan A,et al.Genetics of systemic lupus erythematosus: immune responses and end organ resistance to damage[J].Curr Opin Immunol,2014,31:87-96.
[9] Wen Z,Xu L,Xu W,et al.Detection of dynamic frequencies of Th17 cells and their associations with clinical parameters in patients with systemic lupus erythematosus receiving standard therapy[J].Clin Rheumatol,2014,33(10):1451-1458.
[10] Choi S C,Morel L.B cell contribution of the CD4+ T cell inflammatory phenotypes in systemic lupus erythematosus[J].Autoimmunity,2017,50(1):37-41.
[11]胡偉,王森,王贤,等.系统性红斑狼疮患者外周血Th1/Th2/Th17/Treg的表达水平及其临床意义[J].东南大学学报(医学版),2019,38(2):308-312.
[12]陆前进,罗帅,寒天.系统性红斑狼疮的诊疗进展[J].中华皮肤科杂志,2018,51(1):1-4.
[13]梁赵云,牛红青,郝美华,等.雷帕霉素通过调节T辅助细胞17/调节性T细胞平衡治疗系统性红斑狼疮的进展[J].中华风湿病学杂志,2018,22(6):423-426.
[14]项海燕,潘峰,鄢巨振,等.过表达miR-498通过下调STAT3抑制类风湿性关节炎患者Th17细胞分化[J].生理学报,2018,70(2):167-174.
[15] Sun G,Wang Z,Ti Y,et al.STAT3 promotes bone fracture healing by enhancing the FOXP3 expression and the suppressive function of regulatory T cells[J].Apmis,2017,125(8):752-760.
[16]陈曦,霍春波,陈广山,等.消银解毒方颗粒对Jurkat T细胞内JAK1/STAT3信号通路作用机制的研究[J].北京中医药大学学报,2017,40(2):119-124.
[17] Ohl K,Tenbrock K.Regulatory T cells in systemic lupus erythematosus[J].Eur J Immunol,2015,45(2):344-355.
[18]谢玉磊,刘坤鹏,乔孟晗,等.转录因子RORγt和Foxp3在玫瑰糠疹患者外周血单个核细胞中的表达[J].临床皮肤科杂志,2017,46(1):8-11.
[19] Li K,Bao H,Zhang P,et al.Inhibitory Effect of AG490 on STAT3 Signal Transduction Pathway in Nasopharyngeal Carcinoma Cells[J].J Coll Physicians Surg Pak,2017,27(11):699-702.
(收稿日期:2019-08-26) (本文编辑:周亚杰)
