双波长HPLC法测定防风通圣丸中6种成分的含量
2019-01-15缑慧君许雪峰
李 帆,缑慧君,许雪峰*
(1.四川大学生物治疗国家重点实验室,成都 610041;2.汉中市食品药品检验检测中心,汉中 723000)
防风通圣丸出自金代名医刘完素著名的《宣明论方》,由防风、薄荷、大黄、桔梗、川芎、白术、荆芥穗、麻黄、芒硝、滑石、当归和石膏等17味药组成,具有疏风解表、清热通便之功效,主治风热壅盛、表里俱实症[1-2]。其标准收载于《中国药典》2015年版一部。但药典中只收载了防风通圣丸中黄芩苷的含量测定,目前文献中使用HPLC法同时测定防风通圣丸4种以上有效成分尚未见报道[3-4]。本法采用双波长HPLC法对栀子苷、芍药苷、黄芩苷、连翘苷、甘草苷和甘草酸铵6种有效成分同时进行测定,方法简单、可靠,可更好地用于该产品的质量控制。
1 仪器与试药
1.1仪器 LC-2010A高效液相色谱仪,C18色谱柱(250 mm×4.6 mm,5 μm)(日本岛津公司);AS-10200BD超声波清洗仪(天津奥特赛恩斯仪器有限公司);BT25S,BS224S电子分析天平(赛多利斯科学仪器(北京)有限公司);JY10002电子分析天平(上海舜宁恒平科学仪器有限公司)
1.2试药 对照品:连翘苷(批号1110821-201213,质量分数95.3%),栀子苷(批号110749-201718,质量分数97.6%),芍药苷(批号110736-201539,质量分数96.4%),黄芩苷(批号110715-201720,质量分数93.5%),甘草苷(批号111610-201106,质量分数93.7%)和甘草酸胺(批号110731-201418,质量分数93.1%),均由中国食品药品检定研究院提供。防风通圣丸:内蒙古天奇中蒙制药有限公司(批号12160710),北京同仁堂科技发展股份有限公司制药厂(批号16080112),陕西利君现代中药有限公司(批号161002);甲醇,乙腈(色谱纯,美国Fisher公司);磷酸(分析纯,成都市科龙化工仪器厂);水为Millipore制水仪所制超纯水。
2 方法与结果
2.1色谱条件 日本岛津C18色谱柱(250 mm×4.6 mm,5 μm)。流动相:乙腈(A)-0.5 mL·L-1磷酸水溶液(B),梯度洗脱依次为:0~9 min 14%A,8~15 min 19%A,15~35 min 19%~50%A,35~36 min 50%~100%A,36~40 min 100%~14%A。 流速:1.0 mL·min-1;柱温:25 ℃;检测波长:237 nm(栀子苷、芍药苷、连翘苷、甘草苷和甘草酸铵),280 nm(黄芩苷)。
2.2溶液的制备
2.2.1混合对照品溶液 分别精密称取栀子苷、芍药苷、连翘苷、黄芩苷、甘草苷和甘草酸铵对照品10.36,12.63,10.95,10.76,16.97和10.69 mg,分别置于100,50,50,50,50和50 mL量瓶中,加甲醇超声溶解,放冷至室温,加甲醇定容,即得含栀子苷、芍药苷、黄芩苷、连翘苷、甘草苷和甘草酸铵质量浓度分别为103.6,243.51,284.19,208.71,318.02和398.09 μg·mL-1的单一对照品储备液。分别精密量取栀子苷、芍药苷、黄芩苷、连翘苷、甘草苷和甘草酸铵储备液2,1,1,1,1和1 mL,置于同一10 mL量瓶中,加甲醇定容至刻度,摇匀,即得含栀子苷、芍药苷、黄芩苷、连翘苷、甘草苷和甘草酸铵质量浓度分别为20.72,24.35,28.42,20.87,31.80和39.81 μg·mL-1的混合对照品溶液。
2.2.2供试品溶液 取防风通圣丸适量,研细,精密称取0.5 g,置于具塞锥形瓶中,精密加入体积分数为70%的乙醇50 mL,密塞,称定质量,超声处理45 min,放冷至室温,再称定质量,用体积分数为70%的乙醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2.3阴性样品溶液 按照防风通圣丸的制法和配比,制成缺栀子、白芍、连翘、黄芩和甘草的阴性样品,并按照2.2.2项下方法制备阴性样品溶液。
2.3专属性实验 取2.2项下制备好的混合对照品溶液、供试品溶液和阴性样品溶液,按照2.1项下方法分别进样分析,结果见图1。没有与对照品溶液保留时间相对应的色谱峰,表明阴性样品对所测的6种成分无干扰。
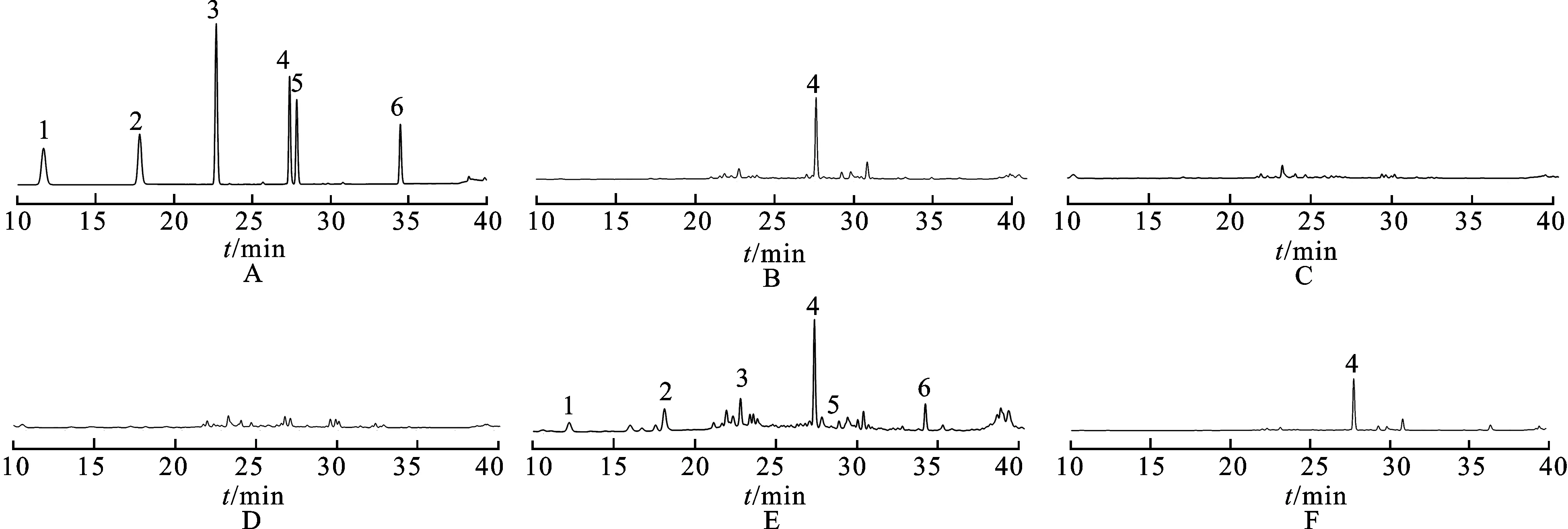
图1HPLC图
A.对照品(237 nm);B.对照品(280 nm);C.缺白芍、栀子、甘草、黄芩和连翘阴性样品(237 nm);D.缺白芍、栀子、甘草、黄芩和连翘阴性样品(280 nm);E.样品(237 nm);F.样品(280 nm);1.栀子苷;2.芍药苷;3.甘草苷;4.黄芩苷;5.连翘苷;6.甘草酸铵。
Fig.1 HPLC chromatograms
A.reference substance (237 nm);B.reference substance (280 nm);C.Paeony,Gardenia,Licorice,Scutellaria and Forsythia negative sample (237 nm);D.Paeony,Gardenia,Licorice,Scutellaria and Forsythia negative sample (280 nm);E.sample (237 nm);F.sample (280 nm);1.geniposide;2.paeoniflorin;3.liquiritin;4.baicalin;5.forsythia;6.ammonium glycyrrhizinate.
2.4稳定性实验 取防风通圣丸,按照2.2.2项下方法制备供试品溶液(批号16080112),室温放置,在制备后0,2,4,6,8,12,16和24 h按照2.1项下色谱条件进样20 μL,记录色谱图,计算得栀子苷、芍药苷、甘草苷、黄芩苷、连翘苷和甘草酸铵峰面积的RSD值分别为0.70%,0.24%,0.24%,0.90%,0.89%和0.19%。结果表明,供试品溶液在24 h内基本稳定。
2.5线性关系考察 取2.2.1项下制备的混合对照品溶液,按照2.1项下色谱条件分别进样2,5,10,15和20 μL,记录色谱图。以峰面积为纵坐标(y)、对照品溶液进样量为横坐标(x),绘制标准曲线,得栀子苷、芍药苷、甘草苷、黄芩苷、连翘苷和甘草酸铵的线性回归方程分别为:y1=32 145.68x1+3 134.841(r1=0.999 9),y2=36 934.61x2-7 678.1(r2=0.999 7),y3=69 791.79x3-1 585.78 (r3=0.999 9),y4=101 066x4+5 405.024(r4=0.999 9),y5=28 922.24x5+10 550.18(r5=0.995 8),y6=23 260.25x6+1 659.84(r6=0.999 9)。结果表明,栀子苷、芍药苷、甘草苷、黄芩苷、连翘苷和甘草酸铵分别在0.041~0.414,0.048~0.487,0.062~0.622,0.057~0.568,0.042~0.417和0.080~0.796 μg范围内线性关系良好。
2.6精密度实验 取2.2.1项下配制的混合对照品溶液,按照2.1项下色谱条件连续进样6次,测得芍药苷、栀子苷、黄芩苷、连翘苷、甘草苷和甘草酸铵峰面积的RSD值分别为1.17%,0.11%,0.11%,0.43%,0.11%和0.41%,结果表明,该仪器精密度良好。
2.7重复性实验 取同一批(批号12160710)防风通圣丸6份,按照2.2.2项下方法制备供试品溶液,用2.1项下色谱条件进样分析,测得栀子苷、芍药苷、黄芩苷、连翘苷、甘草苷和甘草酸铵的含量分别为0.689,0.869,10.170,0.829,0.869和3.207 mg·g-1,RSD值分别为1.04%,1.24%,0.27%,1.34%,0.89%和0.79%。
2.8回收率实验 取同一批防风通圣丸(批号12160710),精密称定质量为0.25 g的供试品6份,分别精密加入栀子苷、芍药苷、甘草苷、黄芩苷、连翘苷和甘草酸铵对照品溶液,按照2.2.2项下方法制备供试品溶液,用0.22 μm的微孔滤膜滤过,取续滤液,按照2.1项下色谱条件进样分析,进样量为10 μL,记录色谱图并计算回收率,结果见表1。
表1加样回收率测定结果
Tab.1 Determination results of recovery tests (n=5)
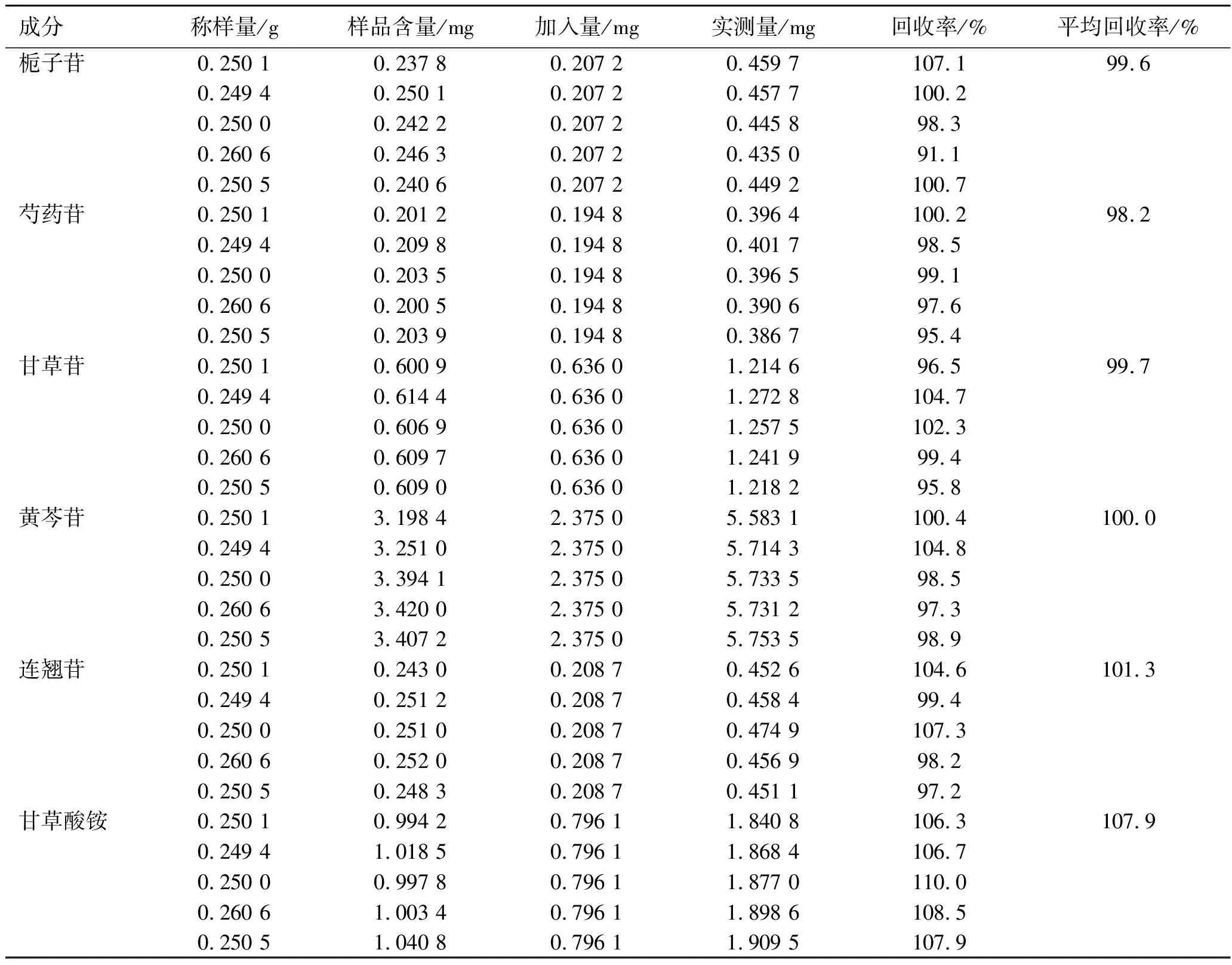
成分称样量/g样品含量/mg加入量/mg实测量/mg回收率/%平均回收率/%栀子苷0.250 10.237 80.207 20.459 7107.199.60.249 40.250 10.207 20.457 7100.20.250 00.242 20.207 20.445 898.30.260 60.246 30.207 20.435 091.10.250 50.240 60.207 20.449 2100.7芍药苷0.250 10.201 20.194 80.396 4100.298.20.249 40.209 80.194 80.401 798.50.250 00.203 50.194 80.396 599.10.260 60.200 50.194 80.390 697.60.250 50.203 90.194 80.386 795.4甘草苷0.250 10.600 90.636 01.214 696.599.70.249 40.614 40.636 01.272 8104.70.250 00.606 90.636 01.257 5102.30.260 60.609 70.636 01.241 999.40.250 50.609 00.636 01.218 295.8黄芩苷0.250 13.198 42.375 05.583 1100.4100.00.249 43.251 02.375 05.714 3104.80.250 03.394 12.375 05.733 598.50.260 63.420 02.375 05.731 297.30.250 53.407 22.375 05.753 598.9连翘苷0.250 10.243 00.208 70.452 6104.6101.30.249 40.251 20.208 70.458 499.40.250 00.251 00.208 70.474 9107.30.260 60.252 00.208 70.456 998.20.250 50.248 30.208 70.451 197.2甘草酸铵0.250 10.994 20.796 11.840 8106.3107.90.249 41.018 50.796 11.868 4106.70.250 00.997 80.796 11.877 0110.00.260 61.003 40.796 11.898 6108.50.250 51.040 80.796 11.909 5107.9
2.9样品的含量测定 取批号分别为161002,12160710和16080112的防风通圣丸,按照2.2.2项下方法分别制备供试品溶液,并按照2.1项下色谱条件进样分析,进样量为10 μL,分别计算样品中栀子苷、芍药苷、甘草苷、黄芩苷、连翘苷和甘草酸铵的含量。结果见表2。
表2防风通圣丸各组分含量测定结果
Tab.2 Determination results of Fangfengtongsheng Pills

批号栀子苷/mg·g-1芍药苷/mg·g-1黄芩苷/mg·g-1连翘苷/mg·g-1甘草苷/mg·g-1甘草酸铵/mg·g-11610021.0680.5259.4350.3410.5702.059121607100.6590.81910.1670.2450.8663.297160801120.6560.5378.7580.1511.1713.063
3 讨论
3.1流动相的选择 以《中国药典》2015年版一部为参考,比较了乙腈-水和甲醇-水2种不同的流动相体系,在实验中发现,与甲醇相比,乙腈的洗脱能力更强,系统分离效果更好。因此在本实验中使用乙腈-水体系要优于甲醇-水体系。同时在水中加入磷酸改性剂后,各组分的峰形和分离度均有明显提高[5],优化色谱条件为乙腈-0.5 mL·L-1磷酸水溶液。
3.2检测波长的选择 《中国药典》2015年版一部中防风通圣丸黄芩苷的含量测定波长选择为280 nm[1-2],故本方法选择280 nm为黄芩苷的测定波长[6-14],而栀子苷、连翘苷、芍药苷、甘草苷和甘草酸铵的最大吸收波长分别为238,277,230,237和237 nm[15-19],经过多次实验,最终选择237 nm为桅子苷、芍药苷、连翘苷、甘草苷和甘草酸铵的检测波长。
3.3供试品溶液制备方法的选择 由于芍药苷的热稳定性不好,故不考虑回流提取。在实验中,分别比较了体积分数为50%,70%和100%的甲醇溶液和体积分数为50%,70%和100%的乙醇溶液作为溶剂进行30,45和60 min的超声提取[20-23],最终结果以体积分数为70%的乙醇超声45 min的提取效果较好。因此选择该方法为供试品溶液的提取方法。
3.4温度的选择 分别比较了柱温为25和30 ℃条件下防风通圣丸供试品中各组分的分离度,发现柱温在25 ℃时甘草苷和连翘苷分离度较好,故选择柱温为25 ℃。
