鹿角珊瑚硼同位素组成与海水表面pH值的相关性研究
2019-01-14张艳灵肖应凯马云麒刘志启王俊林刘玉秀
张艳灵 肖应凯 马云麒 刘志启 王俊林 刘玉秀
1(中国科学院青海盐湖研究所 中国科学院盐湖资源综合高效利用重点实验室,西宁 810008)2(中国科学院青海盐湖研究所 青海省盐湖地质与环境实验室,西宁 810008) 3(宁夏大学,银川 750021)
1 引 言
硼以不同的形式广泛掺入到生物碳酸盐中,在此过程中,由于硼同位素的分馏作用,生物碳酸盐的硼同位素组成(11B)将会产生变化,而这种变化将会与生物碳酸盐形成时的海洋环境(pH值)有关,因此生物碳酸盐的11B值成为海洋环境的示踪剂[1],从而使海洋生物碳酸盐的11B值在重建古海洋pH值及计算当时大气中CO2浓度的研究中发挥了极其重要的作用[2~11]。
应用海洋生物碳酸盐硼同位素组成重建古海水pH值主要基于以下假设:(1)海水中B(OH)3和B(OH)4-间存在较大的硼同位素分馏效应,而且它们的相对丰度主要决定于海水的pH值。由于B(OH)3和B(OH)4-间分配函数的不同,10B将富集在B(OH)4-中[12,13]。B(OH)3和B(OH)4-的δ11Bcarb值受控于海水pH值。(2)海水中的硼仅以B(OH)4-形式掺入海洋生物碳酸盐,此时不发生硼同位素分馏或者分馏很小[14],因此海洋生物碳酸盐的11Bcarb值就是海水B(OH)4-的11Bc值,即反映了海水的pH值。(3)由于在海洋中硼具有很长的停留时间,在过去20 Ma期间,海水的硼同位素组成基本恒定在39.5‰[5,15,16]。
基于以上假设,文献[17~20]分别进行了有孔虫和珊瑚的培养实验和无机碳酸盐沉积以及海洋沉积吸附硼实验。结果表明,所有的11Bcarb值均随母液pH值升高而增加,基于此得出海水pH值是11Bcarb值的主要控制因素的结论,因此,可以采用11Bcarb值重建古海水的pH值。但是显然存在以下问题:(1)不同实验所得到的11Bcarb值都不相同,而且大部分11Bcarb值落在理论11B4-pH曲线(4-3=0.981)以下。这表明在不同实验条件下具有不同的海水B(OH)4-和B(OH)3间的硼同位素分馏系数4-3值。(2)实验11Bcarb-pH曲线与理论11B4-pH曲线是不平行的。(3)11Bcarb值随母液pH值的升高而增加,不能说明11Bcarb等于11B4值的假设是成立的。Pagani等[21]对包括海水11Bsw值的变化、4-3值以及11Bcarb是否等于11B4值等因素进行了综合性评论,发现有些研究结果偏离了按照11Bcarb=11B4的假设模型获得的理论曲线,这表明11Bcarb=11B4值的假设是不成立的,或随pH值变化4-3值不是恒定的。
本研究组在前期研究中[22],采用不同pH值(7.60~8.75)的真实海水和陆相咸水进行碳酸钙沉积实验,发现了异常的硼同位素分馏,即11Bcarb-pH与计算的11B4-pH曲线不平行,而是随母液pH值升高,偏离11B4-pH曲线越来越远,当pH值升高到一定值时,沉积相与母液间的硼同位素分馏系数大于1,甚至高达1.0178。这一结果与只有B(OH)4-参与进生物碳酸盐的假设相矛盾。11Bcarb11B4的原因可能是B(OH)3的掺入,实验中所有测定的海洋生物碳酸盐的11Bcarb值低于海水的值,这表明硼是以B(OH)4-的掺入为主,B(OH)3的掺入为辅。并且,B(OH)3和B(OH)4-掺入碳酸盐中比例受海水B(OH)3和B(OH)4-比例所控制,即与海水pH值有关。
文献[23,24]进行了无机碳酸盐沉积实验,结果表明,碳酸盐和海水B(OH)3间的分馏系数carb-3都不是恒定的,而是随海水pH值的升高而降低,而碳酸盐和海水间的分馏系数carb-sw呈相反的变化。固体的硼同位素组成11B不落在采用平均carb-3绘制的最佳理论曲线上,也不与理论曲线平行。因此,11Bcarb=11Bborate的假设在正常的海水pH值范围内是不成立的,carb-3的变化应归因于B(OH)3掺入比例的变化。以上结果表明,尽管利用古海洋生物碳酸盐的11Bcarb值计算古海水pH值研究取得了众多成果,但其中还有很多问题尚未解决[25],如δ11Bcarb=δ11B4的假设能否成立、4-3的理论值尚未确定,因此pH值的理论计算公式存在不确定性。
为了验证B(OH)3是否掺入生物碳酸盐,本研究组[22,26]基于海洋生物碳酸盐的硼同位素组成计算了古海洋pH值。因此,通过改变珊瑚的生长环境从而获得硼同位素在生物碳酸盐中的分馏规律,对重建古海洋环境及研究环境变化具有重要意义。本研究采集广西北海涠洲岛水域海水,进行不同pH值(7.8~8.4)的海水珊瑚养殖实验,研究了不同品种珊瑚的11Bcarb与宿生海水pH值的关系,采用正热电离质谱法测定了人工养殖珊瑚的硼同位素组成。研究了海水pH值对珊瑚碳酸盐(文石)硼同位素分馏的影响及珊瑚与海水B(OH)3间的硼同位素分馏系数carb-3与pH值的关系,证实了有B(OH)3掺入珊瑚文石,建立了珊瑚文石的11Bcarb-pH经验方程。
2 实验部分
2.1 珊瑚养殖系统
珊瑚养殖采用本研究组的发明专利[27],此装置的特点是将各水箱串联,同时将首尾连接成同一方向(顺时针或反时针)的水循环改为首尾断开沿来路反方向水循环的方式,如图1所示,文献[28]对此水循环体系进行了详细描述,并完成了不同表面海水温度下的珊瑚养殖实验。本实验养殖珊瑚时,V1和V2同时打开,经V1构成自循环,提供珊瑚生成的水流条件。此时只需采用pH控制器结合滴加NaOH溶液和通CO2气体的方法将6#水箱pH值升至实验最高点(pH=8.4),同时采用pH控制器结合滴加HCl溶液和通CO2气体的方法将1#水箱pH值调至实验最低点(pH 7.8),这样便会自动形成由1#~6#水箱的pH值提升梯度,通过V2调节水量,以达到调节中间各水箱水pH差值的目的。采用此水循环系统,即实现了所有水箱的整体水循环,使各水箱水化学条件保持基本一致,还实现了对各水箱pH值的控制。如果增加水箱数量,可进行更多pH值的珊瑚养殖,而不增加其对pH值控制的难度。
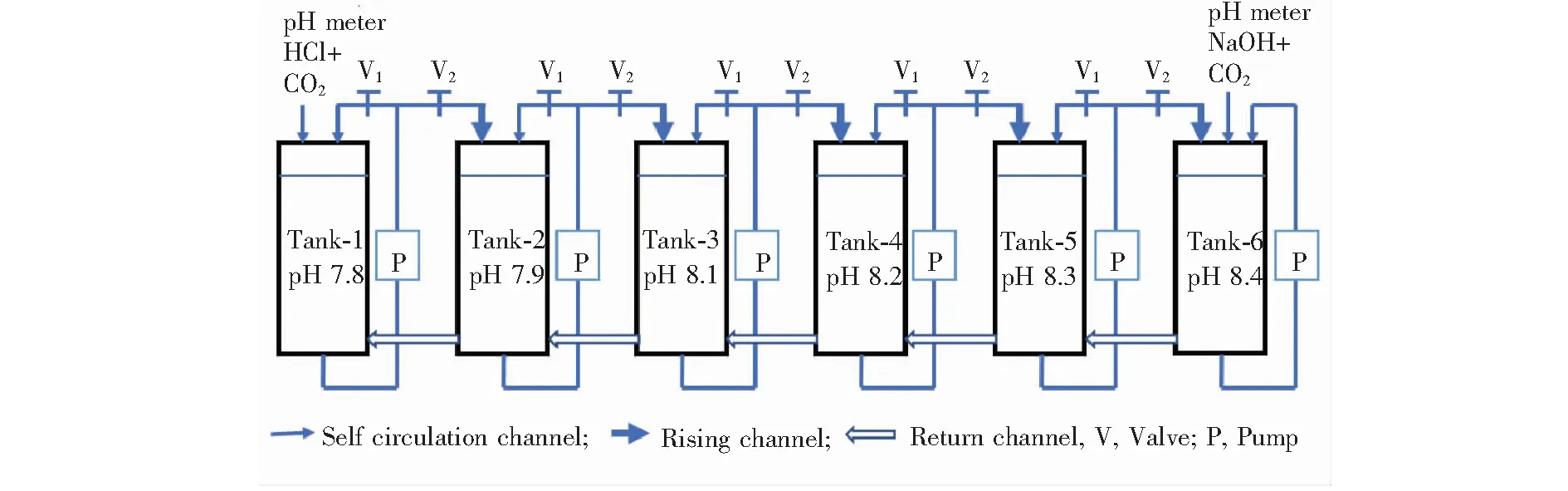
图1 珊瑚养殖中的水循环系统Fig.1 The water circulation system for coral culture
2.2 珊瑚养殖
用涠洲岛水域海水进行珊瑚养殖。按鹿角珊瑚枝条直径在聚乙烯片上钻孔,将从同一母体切割下来的珊瑚枝条分别固定在6块聚乙烯片的钻孔中[29],每个品种有3~4个枝条,再放入6个养殖水箱中,养殖两天后,对养殖水箱的pH值(7.8~8.4)进行调节。
2.3 珊瑚样品的预处理
对于硼同位素组成测定的样品预处理,称取适量新长出珊瑚样品装入45 mL塑料离心管中,各加入15 mL 10% H2O2,超声3 min,放置10 min后离心,去掉上层澄清液,再加入去硼水,摇匀再离心,共洗涤3次。向离心后的固体中加入20 mL 1.0 mol/L HCl,充分溶解。溶液中的B采用二次离子交换法进行B的分离与纯化[30]。
3 结果与讨论
3.1 珊瑚养殖水箱水化学参数变化的影响
采用此养殖系统能实现除pH值外的其它水化学参数基本一致,见表1。
由表1可知,养殖箱中的Mg/Ca、Li/Ca和B/Ca明显高于原海水的比值,而Sr/Ca偏低,这是因为与Mg和Li相比,Ca会更优先生成CaCO3沉积,而Sr生成SrCO3的能力更强,高B/Ca比值可能来自CO2气体中B的污染,同时造成珊瑚养殖海水的11B值明显低于原海水的11B值,以下事实得到证明。本研究组前期进行的不同温度下的珊瑚养殖实验[28],采用同一位置的海水,但没有通入CO2,6个养殖水箱海水δ11Bsw平均值为40.01‰,与原始涠洲海水δ11Bsw值(39.90‰)基本一致。后期进行的 不同pH值条件下的滨珊瑚的养殖实验,改用超纯CO2,其它条件不变,6个水箱养殖海水δ11Bsw平均值为38.51‰,与原始涠洲海水δ11Bsw值(38.28‰)相比变化较小。以上实验结果表明,本实验采用工业级CO2,是养殖海水δ11Bsw值明显降低的主要原因,其它因数影响很小,但是工业级CO2中硼的含量未进行测定。
表1 6个珊瑚养殖水箱基本水化学参数
Table 1 Basic hydro-chemical parameters of culture seawater in six coral culture tanks
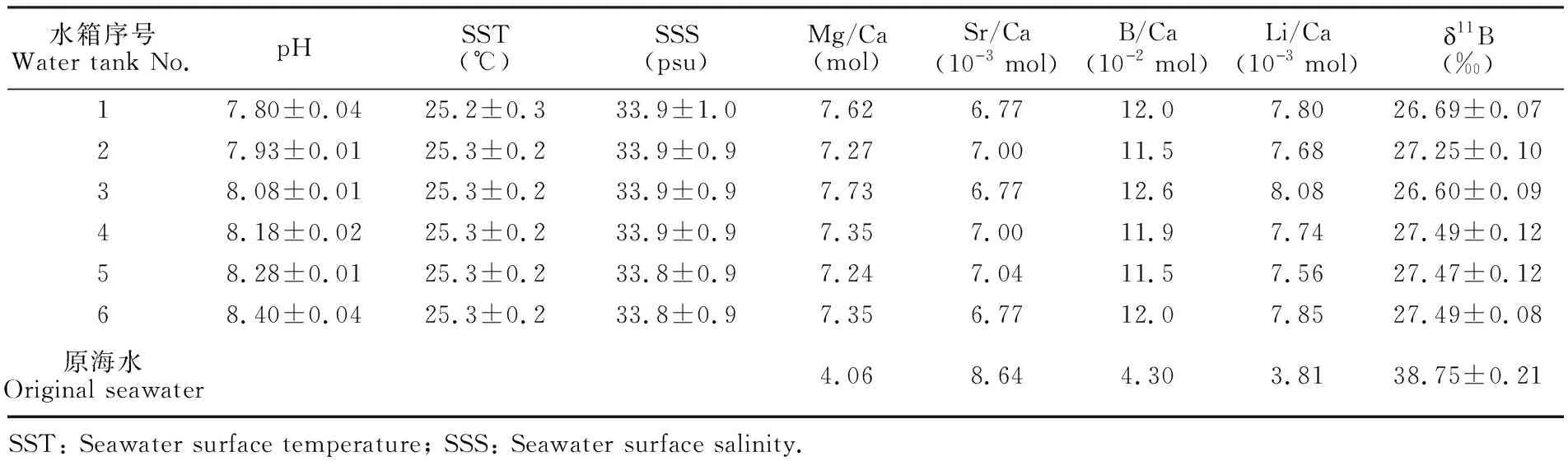
水箱序号Water tank No.pHSST(℃)SSS(psu)Mg/Ca(mol)Sr/Ca(10儊3 mol)B/Ca(10儊2 mol)Li/Ca(10儊3 mol)䔊11B(‰)17.80±0.0425.2±0.333.9±1.07.626.7712.07.8026.69±0.0727.93±0.0125.3±0.233.9±0.97.277.0011.57.6827.25±0.1038.08±0.0125.3±0.233.9±0.97.736.7712.68.0826.60±0.0948.18±0.0225.3±0.233.9±0.97.357.0011.97.7427.49±0.1258.28±0.0125.3±0.233.8±0.97.247.0411.57.5627.47±0.1268.40±0.0425.3±0.233.8±0.97.356.7712.07.8527.49±0.08原海水Original seawater4.068.644.303.8138.75±0.21SST: Seawater surface temperature; SSS: Seawater surface salinity.
由6个珊瑚养殖水箱中pH值(A)、温度(B)和盐度(C)随时间变化的关系图(图2)可见,6个水箱的参数是同步变化的。不同海水pH值下养殖珊瑚,采用不同水循环体系时,各养殖水箱水化学参数的变化情况见图3,串联水箱中的水循环系统可实现各养殖水箱水化学参数的基本一致,可保证在其它水化学参数不变的情况下,不同pH值下珊瑚养殖实验的顺利进行。与串联水箱相比,采用分立水箱中的水循环系统时,除Li元素外,其余元素随pH值的升高呈明显的下降趋势,特别是Ca和Sr在高pH值时浓度降低很多,这是由于在高pH值环境下这些元素更容易沉积。

图2 珊瑚养殖水箱的pH值(A)、温度(B)和盐度(C)的变化情况Fig.2 Variations of pH (A), SST (B) and SSS (C) of culture seawater in six coral culture tanks during coral culture
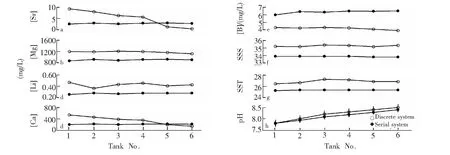
图3 不同海水pH值下珊瑚养殖,采用不同水循环体系时,各养殖水箱水化学参数的变化Fig.3 Variations of the hydro-chemical parameters of seawater with different pH values using different cycle systems during coral culture
3.2 珊瑚养殖的生长

图4 不同时期的鹿角珊瑚的生长情况(pH=8.08)Fig.4 Growth situations of coral Acoroporas in different periods (pH=8.08)
鹿角珊瑚按2.2节养殖的生长情况见图4。20天后,在聚乙烯板上开始出现新生长的珊瑚骨骼沉积环,随后沉积环不断扩大,表明珊瑚生长正常,84天后,沉积环直径已约3 cm。
如图5所示, 在聚乙烯板的正反两面均有新生长的珊瑚沉积环,因此在相同的养殖期间能获得更多的珊瑚骨骼沉积样品供测试用,这是采用将珊瑚枝条粘接在玻璃板上的方法无法实现的。

图5 84天时在聚乙烯片上正(上)反(下)面新生长的鹿角珊瑚环(pH 7.80)(下图环深色部分表明反面新生长的珊瑚沉积环)Fig.5 Ring forms of new-growing coral Acroporas on polyethylene board (pros and cons, pH 7.80) in 84 days (the brunet part in the picture below are new-growing corals)
3.3 养殖珊瑚的硼同位素测定
所有样品的硼同位素比值均在Triton热电离同位素质谱仪上采用基于加石墨的Cs2BO2+正热电离质谱法测定[31]。在不同养殖海水pH值下,珊瑚和养殖海水的硼同位素组成(δ11Bcarb和δ11Bsw)及其两者间的硼同位素分馏系数(carb-sw)见表2。
由于实验中通入的CO2气体纯度不高,带入的杂质B可能导致珊瑚和养殖海水硼同位素组成普遍偏低,但是总体的变化趋势是一致的。为便于比较,利用表2的carb-sw数据,采用将11Bsw归一于39.5‰后的11Bcarb(Normalized)值 (11Bcarb(Normalized)=(39.5/)得到不同pH值下养殖的3种鹿角珊瑚的11Bcarb(Normalized)-pH曲线。如图6所示,所有的曲线均不平行于采用各自的carb-3平均值计算的理论11B4-pH曲线,而是与之相交,δ11Bcarb值在低pH值区位于11B4-pH曲线之上,在高pH值位于11B4-pH曲线之下,且δ11Bcarb值随海水pH值的升高而增加。这表明海水pH值是δ11Bcarb值的主要控制因素,与无机碳酸盐沉积实验的结果基本一致。
表2 鹿角珊瑚骨骼沉积的硼同位素组成
Table 2 Boron isotopic compositions of skeleton deposition of coralAcoporas

样品SamplespHδ11Bcarb (‰)δ11Bsw (‰)㤸carb-sw㤸carb-3华伦鹿角珊瑚Acropora valenciennesi粗野鹿角珊瑚Acropora humilis小丛鹿角珊瑚Acropora verweyi7.80±0.04-26.69±0.07--7.93±0.0110.03±0.2727.25±0.100.98320.97978.08±0.0110.26±0.2026.60±0.090.98410.97938.18±0.0210.49±0.5327.49±0.120.98350.97718.28±0.0111.22±0.1727.47±0.120.98420.97658.40±0.0412.12±0.2027.49±0.080.98560.97607.80±0.0412.83±0.6126.69±0.070.98650.98427.93±0.0113.46±0.3627.25±0.100.98660.98358.08±0.0113.83±0.1126.60±0.090.98760.98398.18±0.0214.72±0.2227.49±0.120.98760.98268.28±0.0113.57±0.4127.47±0.120.98650.97948.40±0.0415.68±0.1727.49±0.080.98910.98167.80±0.0415.50±0.2526.69±0.070.98910.98717.93±0.0115.71±0.1127.25±0.100.98880.98628.08±0.0115.94±0.2926.60±0.090.98960.98618.18±0.0215.95±0.2427.49±0.120.98880.98418.28±0.0116.11±0.3827.47±0.120.98890.98318.40±0.0416.54±0.0927.49±0.080.98990.9836
按照Pagani等[21]的公式(公式(1)和(2))分别计算了碳酸盐和海水B(OH)3间的分馏系数carb-3、 碳酸盐和海水间的硼同位素分馏系数carb-sw,结果见表2。
carb-3= [(Rcarb/Rsw)(1+10pKB-pH)-1]/10pKB-pH
(1)
carb-sw=Rcarb/Rsw=(δ11Bcarb+1000)/(δ11Bsw+1000)
(2)
其中,Rcarb/Rsw分别为珊瑚骨骼和海水的11B/10B比值,KB为海水中B(OH)3的电离常数, pKB=8.58[32]。carb-3、carb-sw与溶液pH值的关系绘于图7。结果表明,所有的carb-3都不是恒定的,而是随海水pH值升高而降低,而carb-sw呈相反的变化,由1、2和3号珊瑚的11Bcarb计算的carb-3平均值分别为0.9777、 0.9825和0.9851。以上研究表明,珊瑚养殖实验中得到的1、2和3号珊瑚的carb-3平均值差别较大,范围为0.977~0.985,3号珊瑚最高,1号珊瑚最低,即其分馏效应最强,这反映了不同种属珊瑚在相同的pH值下会产生截然不同的硼同位素分馏,这是在B(OH)4-掺入的同时,不同比例B(OH)3掺入的结果。3号珊瑚中可能有更高比例的B(OH)3掺入,而1号珊瑚中B(OH)3掺入的比例最低。
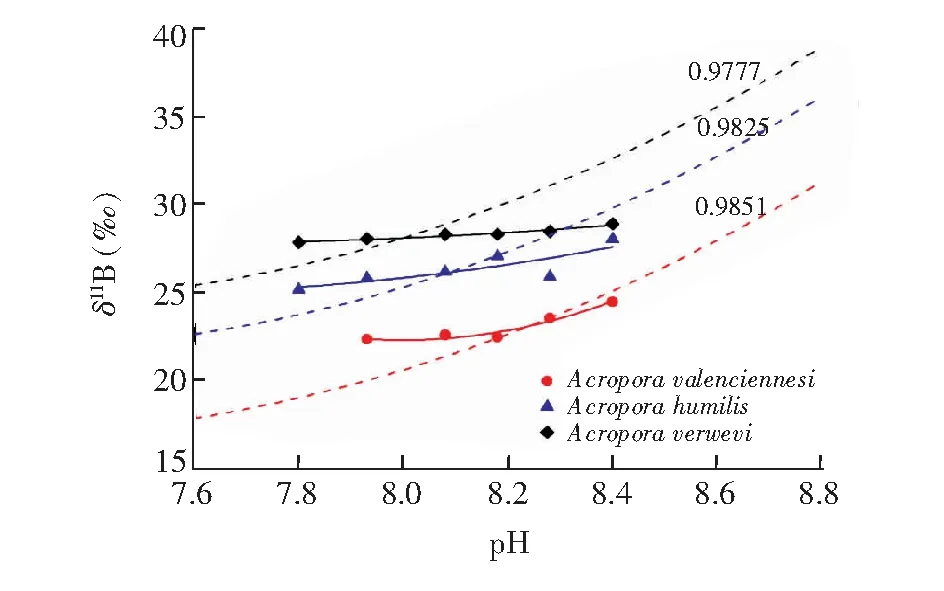
图6 养殖鹿角珊瑚的11Bcarb值与养殖海水pH值的关系Fig.6 Relationship between 11B of cultured coral Acroporas and pH of seawater

图7 计算的3种珊瑚的carb-3和carb-sw与养殖海水pH值的关系Fig.7 Relationship between carb-3, carb-sw of No.1,2,3 corals and pH of seawater
文献[17,19,20,33]进行的有孔虫和珊瑚的培养实验和无机碳酸盐沉积以及海洋沉积吸附硼实验结果表明,如果只有B(OH)4-进入生物碳酸盐,那么碳酸盐与海水B(OH)3间的分馏系数carb-3应是恒定的。但本研究结果与之不同,说明11Bcarb=11B4的这种假设可能不成立。Pagani等[21]对11Bcarb-pH技术,包括海水的11Bsw值的变化、4-3以及11Bcarb是否等于11B4的假设等因素进行了全面评述,并对Sanyal等[33]的结果进行了详细地分析,指出Sanyal等[33]的结果偏离了基于11Bcarb=11B4假设而建立的理论曲线,说明这种假设可能错误的,或者是B(OH)3同时也掺入了碳酸盐。目前,越来越多的研究表明,B(OH)3同时也掺入了碳酸盐,因此11Bcarb=11B4的假设可能不成立。B(OH)3和B(OH)4-掺入碳酸盐的比例受海水B(OH)3和 B(OH)4-比例所控制,即与海水pH值有关,并随海水pH值的增高而降低。由于海水中B(OH)3始终存在,因此B(OH)3的掺入不可能为零。
本结果与文献[23,34]进行的无机碳酸盐沉积实验结果一致,再一次证明了carb-3不等于理论的4-3,而与溶液的pH 值有关,这说明δ11Bcarb=δ11B4的假设并不成立,理论的4-3未知,而且又不等于carb-3,表明有B(OH)3掺入进碳酸盐。同时,所有测定的海洋生物碳酸盐的11Bcarb值都低于11Bsw值,表明硼是以B(OH)4-的掺入为主、B(OH)3的掺入为辅。肖军等[35]研究了硼掺入珊瑚的形式,结果表明,B以B(OH)3和B(OH)4-两种形式以变化的比例同时掺入进珊瑚,并以B(OH)4-优先掺入为主。
上述结果表明,采用理论公式由生物碳酸盐的δ11Bcarb值进行pH值的重建存在不确定性,有必要建立pH值和δ11Bcarb值间的经验方程。新生长珊瑚的硼同位素组成结果与母体珊瑚的硼同位素组成和现代珊瑚的δ11Bcarb值(16.4‰~29.3‰, 平均值 22.6‰)差别较大,对于1号珊瑚的δ11B值,通过采用海水δ11B=39.5‰和表2中的分馏系数校正后,由图7得出的新生长的珊瑚的δ11Bcarb与宿生海水pH值的关系,建立出珊瑚文石的δ11Bcarb-pH的经验方程见公式(3):
pH=-16.16+1.935δ11Bcarb-0.0381δ11Bcarb2,r2=0.715
(3)
根据现代珊瑚的δ11Bcarb值的平均值22.6‰,采用图8的二次拟合式计算的现代海水的平均pH=8.12,与实际值比较接近。
3.4 Mg(OH)2对珊瑚δ11B值的影响
在珊瑚养殖期间,发现在高pH值的水箱滴加NaOH溶液的水体周围有无机白色固体沉积析出,对这些样品进行了化学成分和硼同位素组成的测定,结果列于表3。
表3 培养水箱中白色固体化学成分和硼同位素测定结果
Table 3 Determination of chemical composition and boron isotope of white solid in water tank
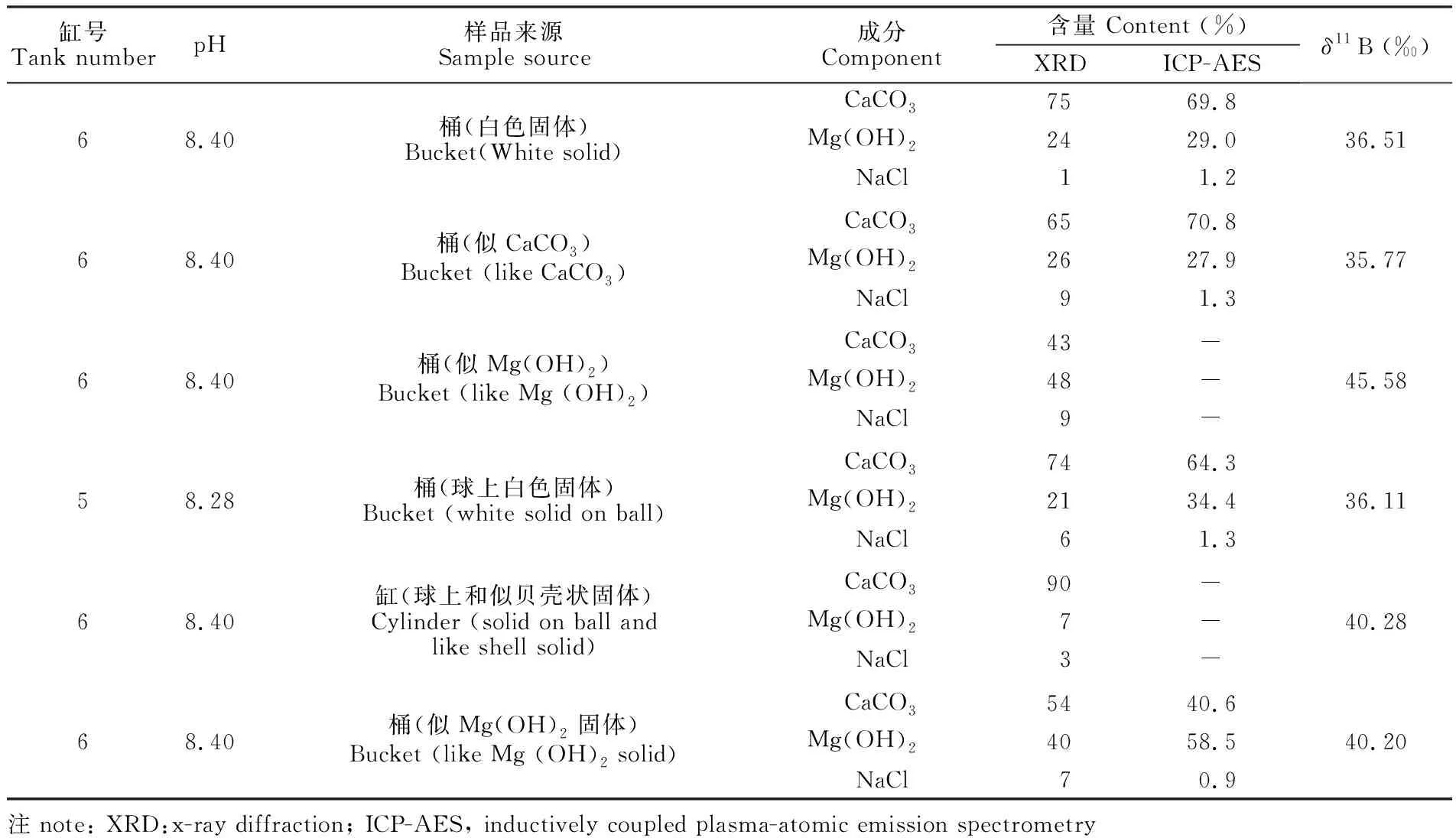
缸号Tank numberpH样品来源Sample source成分Component含量 Content (%)XRDICP-AESδ11B (‰)68.40桶(白色固体)Bucket(White solid)68.40桶(似CaCO3)Bucket (like CaCO3)68.40桶(似Mg(OH)2)Bucket (like Mg (OH)2)58.28桶(球上白色固体)Bucket (white solid on ball)68.40缸(球上和似贝壳状固体)Cylinder (solid on ball andlike shell solid)68.40桶(似Mg(OH)2固体)Bucket (like Mg (OH)2 solid)CaCO37569.8Mg(OH)22429.0NaCl11.2CaCO36570.8Mg(OH)22627.9NaCl91.3CaCO343-Mg(OH)248-NaCl9-CaCO37464.3Mg(OH)22134.4NaCl61.3CaCO390-Mg(OH)27-NaCl3-CaCO35440.6Mg(OH)24058.5NaCl70.936.5135.7745.5836.1140.2840.20注note: XRD:x-ray diffraction; ICP-AES, inductively coupled plasma-atomic emission spectrometry
XRD和ICP-AES的测定结果表明,这些无机白色固体主要由CaCO3和Mg(OH)2组成,其δ11B值均高于养殖海水的δ11B值,并且与Mg(OH)2的相对含量成正比关系(图9),说明B掺入Mg(OH)2时,会引起固体的δ11B值升高,这是11B在固体中优先掺入的结果[34,36]。Nothdurft等[37]的研究指出,Mg(OH)2普遍存在于现代珊瑚中,珊瑚中Mg(OH)2的出现是极端微环境高pH值和低CO2含量的产物,是一种极端微环境的指示剂,同时珊瑚中异常高的11B值,可能反映了极端海洋微环境高pH值的存在,这只是局部的极端环境下出现的情况,与海洋大环境的pH值不存在对应关系。Vengosh等[1]报道的来自日本和大堡礁珊瑚的11B值高达28‰~32‰,是否与Mg(OH)2的存在有关,需要进行更深入的研究。这种极端的局部环境一旦发生,会有Mg(OH)2和CaCO3的共沉淀出现,从而影响硼同位素组成。本研究中,珊瑚中存在Mg(OH)2的可能性很小,因为6个养殖缸的水化学参数比较均一,养殖珊瑚生长的水域不会出现极端环境。
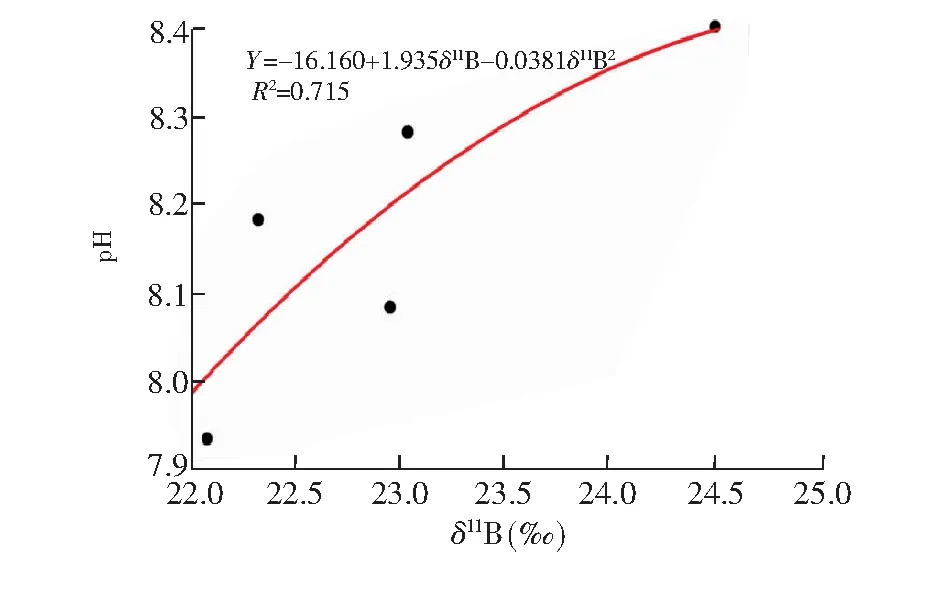
图8 由养殖鹿角珊瑚实验得到的δ11Bcarb-pH经验方程Fig.8 Empirical equation of δ11Bcarb-pH obtained from coral culture experiments

图9 固体δ11B值与XRD和ICP-AES测定的Mg(OH)2含量之间的关系Fig.9 Relationship between δ11B value of solid and content of Mg(OH) 2 measured by XRD and ICP-AES
4 结 论
采用串联式水循环系统和新生长珊瑚的培植方法完成了在不同海水pH值环境下的珊瑚养殖实验,获得了珊瑚硼同位素组成与海水pH值关系的实验数据。由珊瑚的acarb-3和acarb-sw与养殖海水pH值的关系可知,acarb-3不是常数,而是随pH值升高而降低,说明B(OH)3同时也掺入了珊瑚生物碳酸盐。研究结果表明,采用理论公式,由测定的海洋生物碳酸盐的δ11Bcarb值进行海水pH值计算,具有不确定性,采用实验获得的经验方程进行海水pH值的计算可能是替代的方法。珊瑚养殖过程中,在高pH值下所生成的无机沉积物的δ11B值远高于海水,这是Mg(OH)2中B(OH)3的优先掺入的结果,Mg(OH)2的存在对无机沉积物的硼浓度及硼同位素组成具有显著的影响。
