基于毛细管电泳-质谱联用的PTEN缺失诱导代谢重编程研究
2019-01-14王志超朴海龙
王志超 刘 静 朴海龙*
1(中国科学院分离分析化学重点实验室,中国科学院大连化学物理研究所, 大连 116023)2(中国科学院大学, 北京 100049)
1 引 言
前列腺癌(Prostate cancer,PCa)是男性最常见的恶性肿瘤之一,致死率在所有男性肿瘤中排第三[1]。尽管在早期前列腺癌患者中很少出现,但约60%的晚期前列腺癌患者存在染色体10q23缺失[2]。染色体10q23中起到重要抑癌作用的基因即PTEN(Phosphatase and tensin homolog)[3]。PTEN催化磷脂酰肌醇-3,4,5-三磷酸(Phosphatidylinositol (3,4,5)-trisphosphate,PIP3)去磷酸化,并生成磷脂酰肌醇-4,5-二磷酸(Phosphatidylinositol (4,5)-bisphosphate,PIP2),进而抑制PI3K/AKT通路。PTEN缺失的前列腺癌患者常具有不良预后[4]。因此,研究PTEN缺失引起的细胞功能改变,可能发现潜在的治疗靶点,并提供特异性治疗PTEN缺失前列腺癌的手段。PTEN缺失调控细胞能量代谢,如β氧化[5]及谷胱甘肽代谢[6]。Naguib等发现PTEN缺失的细胞对线粒体复合物I抑制剂更敏感[7],从而说明研究PTEN突变诱导的代谢变化对靶向治疗PTEN缺失肿瘤有重要意义。
生物体内的代谢物种类难以计数,仅Human Metabolome Database统计的存在或可能存在的代谢物已超过40000个[8]。在非靶向筛查生物大分子对代谢的影响中需要对生物体内的代谢物进行系统性的分析。代谢组学(Metabolomics)是指“系统全面地对生物体系内代谢物进行定性定量分析”[9]。目前,代谢组学检测的主流技术为色谱-质谱联用技术及核磁共振法。根据色谱分离方式色谱可分为液相色谱、气相色谱、毛细管电泳。代谢重编程是肿瘤细胞的一大特征[10],其中广泛存在着能量代谢的变化,而这些代谢物普遍具有强极性。毛细管电泳-质谱联用(CE-MS)弥补了其它色谱-质谱联用技术对极性及中等极性代谢物分离差的缺点,可用于生物体内极性及中等极性代谢物分析[11]。CE-MS的研究集中在接口技术的改进,接口技术主要分为鞘流接口和无鞘流接口[12]。鞘流接口具有稳定性高的优点,但鞘流的稀释使分析灵敏度降低。无鞘流接口具有更高的灵敏度,但稳定性较低,目前仍在发展中[13]。
在特定遗传背景下基因才能发挥特定功能,因此治疗靶点的筛选需要在特定遗传背景下进行。如Kim等发现CPS1(Carbamoyl phosphate synthetase-1)在KRAS/LKB1突变的肺癌细胞中调控嘧啶合成[14],而维生素C只有在KRAS/BRAF突变的结直肠癌细胞中才能靶向GAPDH,并杀死细胞[15]。因此,基于代谢组学筛选潜在的治疗靶点时需要考虑不同遗传背景的影响。
为降低癌症治疗过程中的毒副作用,研究在正常细胞及癌细胞中PTEN缺失改变的不同代谢变化,并探究针对癌细胞中所特有的代谢变化,对临床治疗具有积极的指导意义。Chow等[16]在蛋白水平对PTEN在正常细胞及癌细胞中的不同功能作了系统描述,但在代谢物研究领域缺少相关研究。本研究采用CE-MS,通过比较前列腺癌细胞DU145与正常前列腺细胞RWPE1分别敲除PTEN后的代谢变化,阐释PTEN调控的代谢重编程,并确定PTEN在肿瘤中引起的特异性的代谢变化。
2 实验部分
2.1 仪器与试剂
搭配电喷雾离子源(G1607A)的毛细管电泳(G7100A)-飞行时间质谱(G6224A)系统(美国安捷伦公司)用于代谢组学分析。电泳分离采用熔融石英毛细管柱(50 μm i.d.× 80 cm,日本HMT公司)进行。
甲醇(色谱纯,德国Merck公司); 氯仿(色谱纯,韩国Duksan公司); 氨水(28%)、甲酸(≥95%)、乙酸铵(≥98%)、甘露醇(≥98%)购自美国Sigma公司; CE-MS所用内标1(含10 mmol/L蛋氨酸砜、D-樟脑-10-磺酸钠盐)及内标3(含10 mmol/L 3-氨基吡咯烷二盐酸、N,N-二乙基-2-苯基乙酰胺、苯均三酸、3-萘酚-2,7-二磺酸钠)购自日本HMT公司; RPMI 1640(C11875500BT)培养基(美国Invitrogen公司); 胎牛血清(P30-3302,德国PAN公司); 超纯水由Mili-Q超纯水系统(美国Millipore公司)制备。超滤管(5 kDa,美国Millipore公司)。
2.2 实验方法
2.2.1样品制备及代谢物提取前列腺癌细胞DU145及正常前列腺细胞RWPE1购自美国ATCC(American Type Culture Collection),均培养于含10%胎牛血清的RPMI 1640培养基中。用于PTEN敲除的shRNA及空载体购自美国Sigma公司,序列为:CCGGAGGCGCTATGTGTATTATTATCTCGAGATAA-TAATACACATAGCGCCTTTTTT(TRCN0000002745)、CCGGACATTATGACACCGCCAAATTCTCGAGAATT-TGGCGGTGTCATAATGTTTTTTG(TRCN0000355946)。
分别在DU145、RWPE1两种细胞系中构建稳定敲除PTEN的细胞系。使用Lipofectamine 2000(Invitrogen,11668027,美国)将质粒转染进细胞48 h后,在含0.5 μg/mL嘌呤霉素的培养基中培养筛选。当作为阴性对照的未转染质粒的同种细胞在0.5 μg/mL嘌呤霉素筛选中全部死亡时,筛选结束,得到稳定低表达细胞系。
细胞培养至80%汇合度后进行代谢物提取。快速弃去培养基后,以5%甘露醇洗去残留培养基,洗3次,每次10 mL。洗净后,快速将培养皿投入液氮中进行淬灭。淬灭5 min后,在培养皿中加1 mL甲醇(含体积比1∶400的内标1),将细胞随着甲醇刮下并转移至5 mL Ep管中。涡旋30 s后,加入1 mL氯仿并继续涡旋1 min。最后再加入0.4 mL水并涡旋1 min。冰上静置10 min后,在4℃以15000 g离心15 min。每个样品分别取两份各0.45 mL上清液至超滤管中,4℃ 12000 g离心至上清液全部透过滤膜。滤液冻干,于-80℃保存。样品测定时用20 μL超纯水复溶(含体积比1∶200内标3)。
2.2.2CE-MS分析仪器参数与文献[11]相同,电泳参数:阳离子模式:流动相为1 mol/L甲酸,电泳电压27 kV,进样量为5 kPa压力下进样3 s(约3 nL); 阴离子模式:流动相为25 mmol/L乙酸铵(以氨水调至pH 8.5),电泳电压30 kV,并施加1.5 kPa的压力,进样量为5 kPa压力下进样25 s(约25 nL)。质谱参数如下:雾化气压力(Nebulizer pressure)135.8 kPa,干燥气温度(Dry gas temperature)300℃,氮吹(Nitrogen flow)7 L/min,离子传输管电压(Skimmer) 50 V,采集速度1.5/s,正负离子模式下毛细管电压(Capillary voltage)分别为 4.0和3.5 kV,裂解电压(Fragmentor)分别为105和125 V。
2.3 数据处理
使用安捷伦公司自带软件Quanlitative analysis(B.06.00)、Quantitative analysis(B.06.00)及HMT公司Method Maker软件对数据进行定性和定量分析。具体步骤如下:(1)通过保留时间与质荷比进行定性分析 HMT公司(日本)提供含1000个代谢物、内标理论质荷比及理论保留时间的数据库。使用Method Maker软件,通过代谢物及内标理论保留时间、内标实际保留时间计算在此内标保留时间下代谢物理论保留时间。阳离子模式下使用内标蛋氨酸砜、3-氨基吡咯烷二盐酸、N,N-二乙基-2-苯基乙酰胺,阴离子模式下使用内标D-樟脑-10-磺酸钠盐、苯均三酸、3-萘酚-2,7-二磺酸钠。在Quantitative analysis软件中,将此理论保留时间与代谢物实际时间进行比对,以偏差在±0.2 min以内且质荷比与理论值偏差在±0.01 Da的标准进行鉴定。(2)定量分析 定性分析后,导出定性的代谢物的峰面积数据,删除在80%以上样品中峰面积小于400的代谢物。代谢物峰面积使用对应样品所有代谢物的总峰面积校正,校正后的数据用于后续分析。使用GraphPad Prism 7(美国)进行绘图及t检验。t检验中p<0.05的代谢物使用MetaboAnalyst(http://www.metaboanalyst.ca)[17]作热图及通路富集分析。
3 结果与讨论
3.1 PTEN缺失诱导的代谢重编程
通过与含1000个代谢物标样的数据库中保留时间及精确质量数进行比对,实现了代谢物准确的定性分析。为考察分析方法对易降解物质准确检测的能力,CE-MS分析后,根据公式([ATP] + 0.5 × [ADP])/([AMP] + [ADP] + [ATP])(ATP,腺嘌呤核苷三磷酸; ADP,腺嘌呤核苷二磷酸; AMP,腺嘌呤核苷一磷酸)计算胞内能荷,DU145、RWPE1两种细胞中能荷均为0.96,达到正常生物体内能荷水平[18],表明在分析测试过程中易降解代谢物得到准确检测。
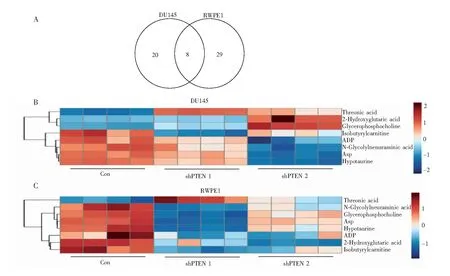
图1 PTEN诱导的代谢重编程。(A) DU145和RWPE1两种细胞系中PTEN缺失改变的相同及不同的差异代谢物个数。相同的差异代谢物在DU145(B)及RWPE1(C)中变化热图。腺嘌呤核苷二磷酸(ADP),天冬氨酸(Asp)Fig.1 Metabolic reprogramming induced by phosphatase and tensin homolog (PTEN) in DU145 and RWPE1 cells. (A) Common and specific differential metabolites number in two cell lines. Heatmaps of common metabolites changes in DU145 (B) and RWPE1 (C) after PTEN silencing. ADP, adenosine diphosphate; Asp, aspartate
采用CE-MS分析DU145和RWPE1两种细胞系,分别定性得到200和214种代谢物。DU145和RWPE1敲除PTEN后相比对照细胞分别得到28种和37种差异代谢物,两种细胞共同的差异代谢物有8种(图1A和1B)。PTEN敲除后苏糖酸(Threonic acid)显著升高,异丁基肉碱(Isobutyrylcarnitine)、二磷酸腺苷(ADP)、N-羟乙酰神经氨酸(N-Glycolylneuraminic acid)、天冬氨酸(Asp)、亚牛磺酸(Hypotaurine)显著下降,而甘磷酸胆碱(Glycerophosphocholine,GPC)、2-羟戊二酸(2-Hydroxyglutaric acid,2-HG)在两种细胞中变化相反。
DU145细胞中2-羟戊二酸、甘磷酸胆碱在PTEN敲除后显著升高,而在RWPE1细胞中则显著下降(图2)。

图2 PTEN缺失引起的2-羟戊二酸(2-HG)及甘磷酸胆碱(GPC)变化:2-羟戊二酸在DU145(A)及RWPE1(B)中的变化; 甘磷酸胆碱在DU145(C)及RWPE1(D)中的变化。Fig.2 2-Hydroxyglutaric acid (2-HG) and glycerophosphocholine (GPC) changes in two independent PTEN shRNAs transduced cells. 2-HG changes in DU145 (A) and RWPE1 (B). GPC changes in DU145 (C) and RWPE1 (D). *, **, ***, **** represent p<0.05, p<0.01, p<0.001, p<0.0001, respectively. n=4. Data was normalized by average of control
在偏酸性或缺氧条件下,细胞通过酶(乳酸脱氢酶、苹果酸脱氢酶)的非特异性催化合成L型2-羟戊二酸[19,20]。肿瘤细胞中普遍存在偏酸性或缺氧环境[21,22],因此推测PTEN缺失后引起相关酶活性变化,但是只有在肿瘤细胞中才能通过酶的非特异性催化合成L-2-羟戊二酸,而在正常细胞中则不存在这种环境。在乳腺癌中,侵袭性更强的癌细胞有更高的甘磷酸胆碱[23,24],但Stewart等[25]报道升高甘磷酸胆碱引起肿瘤转移能力下降。结合前列腺癌中肿瘤细胞和正常细胞缺失PTEN后相反的甘磷酸胆碱变化,推测PTEN与其它基因共同作用调控甘磷酸胆碱,在不同遗传背景下,甘磷酸胆碱引起的效应不同。
综上所述,PTEN缺失在肿瘤细胞中引起促癌代谢物2-羟戊二酸和甘磷酸胆碱的积累,而在正常细胞中反而引起两种代谢物下降。
3.2 PTEN缺失在癌症细胞中改变的特异性代谢重编程
20种代谢物在DU145细胞中敲除PTEN后有显著差异,而在RWPE1中无显著变化(图1A),即这20种差异代谢物为特定肿瘤遗传背景下PTEN缺失诱导的。20种差异代谢物如表1所示。对这20种差异代谢物进行通路富集分析发现,硫胺(维生素B1)代谢途径(Thiamine metabolism)及谷胱甘肽代谢途径(Glutathione metabolism)变化最为显著(图3A)。
两种代谢途径均涉及硫代谢并调节细胞内还原势。PTEN敲除后维生素B1升高,而硫胺素焦磷酸降低(图3B)。维生素B1作为多种因子的辅酶能够促进肿瘤增殖及增强对化疗的抗性,且肿瘤会更多的从体内摄取维生素B1[26]。谷胱甘肽代谢途径从半胱氨酸合成谷胱甘肽,DU145中PTEN缺失后半胱氨酸、烟酰胺腺嘌呤二核苷酸磷酸(NADP+)下降(图3C),还原型谷胱甘肽与氧化型谷胱甘肽比值(GSH/GSSG)上升(图3D)。谷胱甘肽合成前体半胱氨酸下降、GSH/GSSG上升可能是由于谷胱甘肽合成速度加快,但半胱氨酸来源不足。PTEN缺失后GSH/GSSG上升,说明细胞内氧化压力降低。谷胱甘肽可维持细胞内还原势,增加肿瘤细胞对化疗的抵抗性[27]。Lien等报道激活PI(3)K/Akt通路促进谷胱甘肽合成通路上调,并增强对氧化压力抵抗能力[6]。
表1 DU145中PTEN缺失后改变的特有差异代谢物
Table 1 Specific metabolites changes in DU145 induced by PTEN

化合物名称Name变化倍数 RatioshPTEN1shPTEN2显著性 p valueshPTEN1shPTEN2辛基肉碱 Octanoylcarnitine0.860.324.15×10儊26.54×10儊6乙酰神经氨酸 N-Acetylneuraminic acid0.790.581.24×10儊37.26×10儊5甘油酸 Glyceric acid0.620.604.31×10儊31.48×10儊3黄素单核苷酸 FMN0.640.611.30×10儊58.78×10儊6氧化型谷胱甘肽 GSSG0.850.654.50×10儊38.62×10儊5烟酰胺腺嘌呤二核苷酸磷酸 NADP+0.840.653.53×10儊22.55×10儊3肌肽 Carnosine0.710.673.85×10儊23.50×10儊3硫胺素焦磷酸 Thiamine diphosphate0.780.743.75×10儊29.78×10儊3半胱氨酸 Cys0.650.795.05×10儊31.97×10儊2烟酸腺嘌呤二核苷酸 Deamido-NAD+0.230.833.04×10儊81.02×10儊3维生素B1 Thiamine1.541.193.24×10儊51.36×10儊2谷氨酸-谷氨酸二肽 Glu-Glu1.131.273.22×10儊21.72×10儊3肌酸酐 Creatinine1.181.321.53×10儊42.22×10儊5吡哆醇 Pyridoxine1.251.361.83×10儊29.76×10儊5N8-精胺 N8-Acetylspermidine1.851.431.30×10儊43.89×10儊21-磷酸核糖 Ribose 1-phosphate1.281.687.26×10儊41.65×10儊2丁基肉碱 Butyrylcarnitine1.151.991.78×10儊23.07×10儊5N-乙酰谷氨酸 N-Acetylglutamic acid1.512.083.73×10儊44.37×10儊3鸟苷 Guanosine1.804.574.07×10儊31.15×10儊5XA0055*1.221.482.44×10儊29.71×10儊3*表示确定为代谢物,但未定性出结果。*Means that it is authenticated metabolite, but not identified.

图3 DU145中特有的PTEN缺失改变的代谢变化:(A)通路富集分析DU145中特有的PTEN缺失诱导的代谢变化; (B)硫胺代谢通路中的差异代谢物; (C)谷胱甘肽通路中的差异代谢物; (D)DU145中PTEN诱导的GSH/GSSG比例变化Fig.3 Metabolites changes induced by PTEN and specific in DU145. (A) Pathway enrichment analysis of the changed metabolites specific in DU145; (B) Metabolites changes in thiamine metabolism pathway; (C) Metabolites changes in glutathione metabolism pathway; (D) Ratio changes of GSH/GSSG induced by PTEN. *, **, ***, **** represent p<0.05, p<0.01, p<0.001, p<0.0001, respectively. n=4. Nicotinamide adenine dinucleotide phosphate (NADP+). Data was normalized by average of control
肌酸酐(Creatinine)在PTEN缺失后升高(图4A)。血清中肌酸酐上升预示前列腺癌发病几率上升[28]。肌肽(Carnosine)在PTEN缺失后降低(图4B)。肌肽通过降低缺氧诱导因子1表达起到抗增殖的作用[29]。有研究表明,乙酰神经氨酸(N-Acetylneuraminic acid)上调可以作为头颈部癌及非小细胞肺癌的标志物[30,31],但本研究中PTEN突变后乙酰神经氨酸下降(图4C)。

图4 DU145中特有的PTEN缺失改变的代谢变化中与肿瘤诊断或预后相关的代谢物: (A)肌酸酐; (B)肌肽; (C)乙酰神经氨酸Fig.4 Cancer diagnosis and prognosis related metabolites changes induced by PTEN and specific in DU145. (A) Creatinine; (B) Carnosine; (C) N-Acetylneuraminic acid. *, **, ***, **** represent p<0.05, p<0.01, p<0.001, p<0.0001, respectively. n=4. Data is normalized by average of control
4 结 论
通过对前列腺癌细胞系DU145及正常前列腺细胞系RWPE1分别敲低PTEN后进行CE-MS分析,研究了PTEN在癌细胞及正常细胞中生物学功能的异同。PTEN缺失引起的代谢变化中DU145所特有的为L-2-羟戊二酸、甘磷酸胆碱、维生素B1、GSH/GSSG等。这些代谢物或比值在PTEN缺失的DU145细胞中均上升,进而对肿瘤细胞增殖、侵袭、抗化疗都有促进作用。这些变化只出现在PTEN缺失的前列腺肿瘤细胞DU145,而并未出现在PTEN缺失的正常前列腺细胞RWPE1中,因此推测癌细胞中PTEN可通过特定的代谢物含量改变促进肿瘤的发生发展。但是,PTEN与其它肿瘤相关基因的相互作用有待进一步研究。
