利格列汀干预2型糖尿病一级亲属的临床研究
2019-01-14杨传梅吕霄王晓梅罗琼王婷婷郝清顺费大东
杨传梅 吕霄 王晓梅 罗琼 王婷婷 郝清顺 费大东
遗传因素参与了T2DM的发病过程, 糖尿病(DM)患者一级亲属发生DM的风险远远高于无DM家族史者[1]。IGR包含了空腹血糖受损(IFG)、糖耐量减低(IGT)及二者同时存在的状态, IGR患者极易发展为DM。作者的前期研究证实, 糖尿病的一级亲属早相胰岛素分泌已存在缺失, 血糖时间序列异常, 餐后血糖升高, 血糖漂移, 如何更好地保护胰岛细胞, 纠正早期的胰岛素分泌异常及糖调节异常, 对于降低及延缓糖尿病发病尤为重要。利格列汀作为二肽基肽酶(Dipeptidyl peptidase, DPP)-4 抑制剂的一种 , 因疗效确切、心血管安全性高等优势, 目前已被国内外多项权威指南推荐用于治疗T2DM。本文旨在探讨利格列汀在T2DM的IGR一级亲属中的临床疗效, 寻求糖尿病一级预防的方法与干预靶点。
1 资料与方法
1. 1 一般资料 研究对象选取2015年12月~2017年8月在本院查体的T2DM一级亲属, 经口服糖耐量试验(OGTT)确诊为 IGR 者 86例 , 其中 IFG 18 例 , IGT 48例 , IFG+IGT 20例;男 47 例 , 女 39 例 , 年龄 35~55 岁 , 平均年龄 (43±12)岁。研究人群随机分为干预组(46例)及对照组(40例), 两组运动量持平, 观察1年。纳入本研究患者均签署知情同意书,经枣庄市立医院伦理委员会同意。干预前, 两组年龄、性别、WC、HC、BMI、HbA1c、FPG、2 h PG、SBP、DBP、UA、TC、TG、LDL-C、HDL-C、FINS、2 h INS、HOMA-IR、△I30/△G30、NAGE、MODD比较, 差异均无统计学意义(P>0.05), 具有可比性。见表 1。
表1 两组干预前一般资料比较(±s, n)
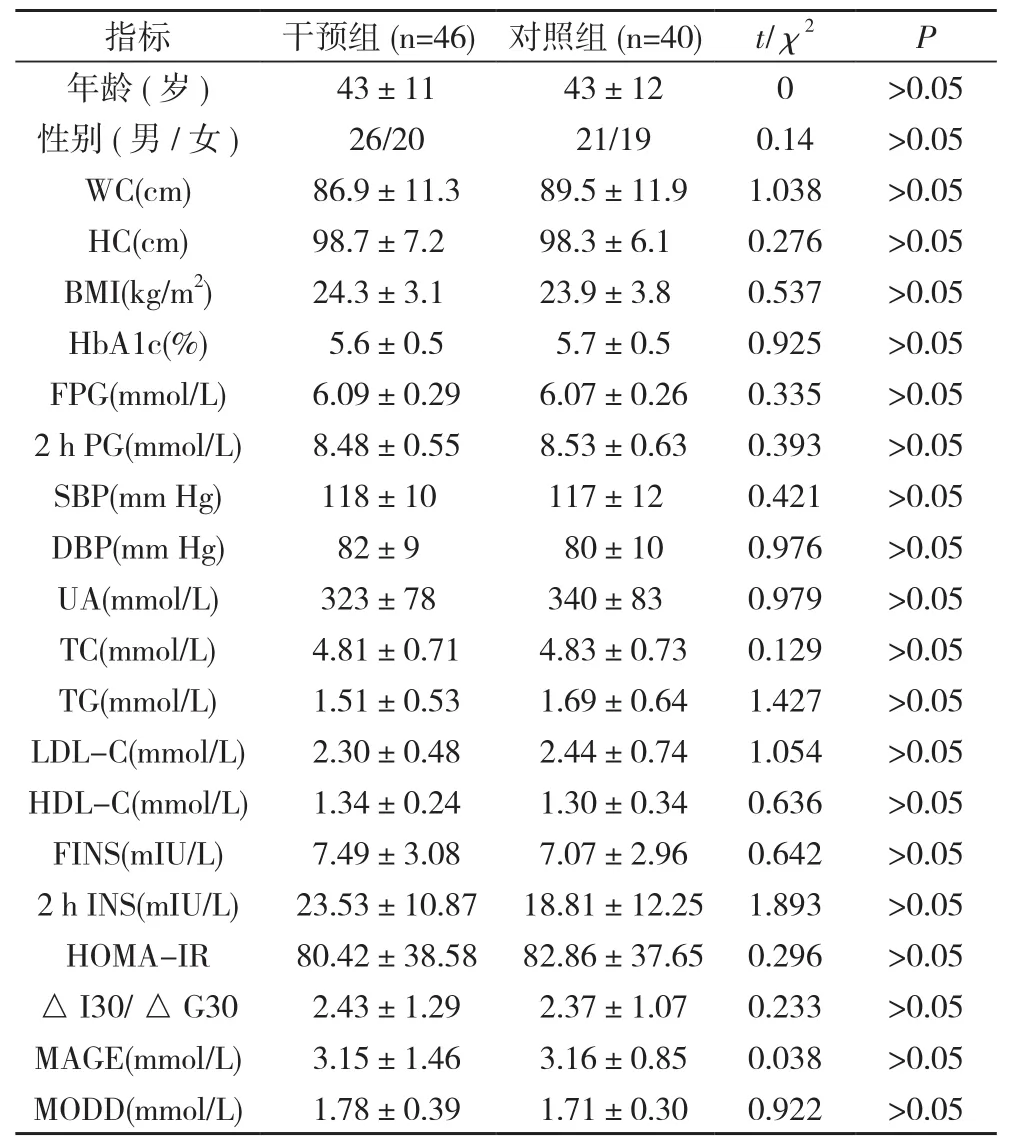
表1 两组干预前一般资料比较(±s, n)
注 :两组比较 , P>0.05 ;1 mm Hg=0.133 kPa
指标 干预组(n=46) 对照组(n=40) t/χ2 P年龄(岁 ) 43±11 43±12 0 >0.05性别(男/女) 26/20 21/19 0.14 >0.05 WC(cm) 86.9±11.3 89.5±11.9 1.038 >0.05 HC(cm) 98.7±7.2 98.3±6.1 0.276 >0.05 BMI(kg/m2) 24.3±3.1 23.9±3.8 0.537 >0.05 HbA1c(%) 5.6±0.5 5.7±0.5 0.925 >0.05 FPG(mmol/L) 6.09±0.29 6.07±0.26 0.335 >0.05 2 h PG(mmol/L) 8.48±0.55 8.53±0.63 0.393 >0.05 SBP(mm Hg) 118±10 117±12 0.421 >0.05 DBP(mm Hg) 82±9 80±10 0.976 >0.05 UA(mmol/L) 323±78 340±83 0.979 >0.05 TC(mmol/L) 4.81±0.71 4.83±0.73 0.129 >0.05 TG(mmol/L) 1.51±0.53 1.69±0.64 1.427 >0.05 LDL-C(mmol/L) 2.30±0.48 2.44±0.74 1.054 >0.05 HDL-C(mmol/L) 1.34±0.24 1.30±0.34 0.636 >0.05 FINS(mIU/L) 7.49±3.08 7.07±2.96 0.642 >0.05 2 h INS(mIU/L) 23.53±10.87 18.81±12.25 1.893 >0.05 HOMA-IR 80.42±38.58 82.86±37.65 0.296 >0.05△ I30/△ G30 2.43±1.29 2.37±1.07 0.233 >0.05 MAGE(mmol/L) 3.15±1.46 3.16±0.85 0.038 >0.05 MODD(mmol/L) 1.78±0.39 1.71±0.30 0.922 >0.05
1. 2 纳入标准 符合1999年WHO制定的 IGR 诊断标准,即包括 IFG和(或)IGT。采取静脉血浆评定标准:IFG 指FPG为 6.1~7.0 mmol/L 且葡萄糖负荷后 2 h PG<7.8 mmol/L, IGT 指FPG<7.0 mmol/L 且葡萄糖负荷后 2 h PG 为 7.8~11.1 mmol/L。
1. 3 排除标准 ①糖尿病、高血压、冠心病史;服用影响糖代谢药物者;②肝肾功能受损者;③甲状腺功能亢进等内分泌疾病、自身免疫病、肿瘤或任何严重致命性疾病者;④妊娠和哺乳期女性。
1. 4 方法
1. 4. 1 受试者干预前测量 SBP、DBP、BMI、WC、HC、HbA1c(离子交换层析法)、UA、TC、TG、HDL-C、LDL-C(GPO-PAP 法 )。进行 75 g OGTT, 测定 0、30、60、120 min血糖(葡萄糖氧化酶法)、胰岛素(化学发光法), 计算HOMA-IR, 反映早相胰岛素分泌指数的糖负荷状态下30 min净增胰岛素与葡萄糖比值 △I30/△G30。干预1年后重复检测上述指标, 同时观察1年后糖代谢转归情况。
1. 4. 2 对照组为生活方式干预, 采取饮食运动干预[2-5]。干预组为利格列汀联合生活方式干预, 干预组在饮食运动的基础上每人服用5 mg/d的利格列汀。每个月发药1次。两组每3个月复查1次, 干预1年后明确治疗效果。
1. 4. 3 时间序列血糖:采用动态血糖监测系统CGMS(美国MedtronicMiniMed公司)评估, 对受试者进行连续3 d的血糖监测, 通过监测皮下组织间液的葡萄糖浓度反映血糖水平,范围为 2.2~22.2 mmol/L。感应探头置于腹部皮下 , 每 10 秒接收1次电信号, 每24 小时可获得288个测定值。同时, 每天至少输入4次指端血糖值进行校正。监测期间, 受试者的进餐时间及内容相对统一。CGMS的准确度标准为:当指端血糖值之间的差值≥5.6 mmol/L时, 平均绝对差(MAD)≤28%且相关系数≥0.79;当指端血糖值之间的差值<5.6 mmol/L时, MAD ≤18%。测定平均值及其标准差(SD)。血糖波动幅度(AGE)的评价:①MAGE:取受试者CGMS 24 h监测期间AGE大于1个SD的为有效波动, 以波动峰值到谷值的方向计算AGE, MAGE为所有有效波动AGE的平均值, 并统计其波动次数(NGE)。②MODD:取受试者CGMS 2个连续24 h监测期间测定值, 其相匹配测定值间的平均绝对差为MODD。
1. 5 统计学方法 采用SPSS17.0统计学软件进行统计分析。以K-S检验和Levene方法分别检测各组计量资料的正态性和方差齐性, 正态分布计量资料以均数±标准差(±s)表示,组内干预前后比较采用配对t检验, 组间比较采用独立样本t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2. 1 两组干预前后临床指标比较 干预1年随访:干预组6例不能坚持而退出, 40例资料完整;对照组2例失访,38例资料完整。①干预组干预后 HbA1c、FPG、2 h PG、TG、2 h INS、HOMA-IR、MAGE、MODD 均较干预前明显降低, △I30/△G30较干预前明显升高, 差异均具有统计学意义 (P<0.05)。干预前后年龄、性别、WC、HC、BMI、SBP、DBP、UA、TC、LDL-C、HDL-C、FINS比 较 , 差 异均无统计学意义(P>0.05)。②对照组干预前后年龄、性别、WC、HC、BMI、HbA1c、FPG、2 h PG、SBP、DBP、UA、TC、TG、LDL-C、HDL-C、FINS、2 h INS、HOMA-IR、△I30/△G30、MAGE、MODD比较, 差异均无统计学意义(P>0.05)。③干预后干预组 WC、BMI、HbA1c、FPG、2 h PG、TG、LDL-C、HDL-C、2 h INS、HOMA-IR、MAGE 均低 于对照组, △I30/△G30高于对照组, 差异均具有统计学意义(P<0.05)。见表 2。
表 2 两组干预前后临床指标比较 (±s, n)

表 2 两组干预前后临床指标比较 (±s, n)
注:与本组干预前比较, aP<0.05;与对照组干预后比较, bP<0.05
指标 干预组(n=40) 对照组(n=38)干预前 干预后 干预前 干预后年龄 (岁 ) 43±11 42±13 43±12 43±11性别 (男 /女 ) 26/20 22/18 21/19 20/18 WC(cm) 86.9±11.3 82.8±7.9b 89.5±11.9 91.1±11.8 HC(cm) 98.7±7.2 96.6±5.6 98.3±6.1 97.6±6.6 BMI(kg/m2) 24.3±3.1 23.2±2.2b 23.9±3.8 24.6±3.2 HbA1c(%) 5.6±0.5 5.2±0.2ab 5.7±0.5 5.9±0.4 FPG(mmol/L) 6.09±0.29 5.52±0.23ab 6.07±0.26 6.16±0.42 2 h PG(mmol/L) 8.48±0.55 6.75±1.03ab 8.53±0.63 8.84±0.94 SBP(mm Hg) 118±10 116±10 117±12 120±8 DBP(mm Hg) 82±9 79±6 80±10 82±8 UA(mmol/L) 323±78 328±40 340±83 353±115 TC(mmol/L) 4.81±0.71 4.76±1.01 4.83±0.73 5.03±1.10 TG(mmol/L) 1.51±0.53 1.20±0.46ab 1.69±0.64 1.90±0.70 LDL-C(mmol/L) 2.30±0.48 2.18±0.38b 2.44±0.74 2.77±0.76 HDL-C(mmol/L) 1.34±0.24 1.37±0.26b 1.30±0.34 1.20±0.30 FINS(mIU/L) 7.49±3.08 7.58±3.93 7.07±2.96 6.78±3.01 2 h INS(mIU/L) 23.53±10.87 13.64±11.23ab 18.81±12.25 22.46±13.64 HOMA-IR 80.42±38.58 62.58±32.46ab 82.86±37.65 85.35±38.47△I30/△G30 2.43±1.29 3.13±1.53ab 2.37±1.07 2.17±0.95 MAGE(mmol/L) 3.15±1.46 2.52±0.98ab 3.16±0.85 3.09±1.03 MODD(mmol/L) 1.78±0.39 1.52±0.25a 1.71±0.30 1.62±0.30
2. 2 随访1年后两组糖代谢转归情况比较 干预组40例IGR 患 者 中 , 16 例 (40.0%)转 为 正 常 糖 耐 量 (NGT), 24 例(60.0%)仍为IGR。对照组 38例 IGR 者中 , 4例 (10.5%)转为 NGT, 4 例 (10.5%)发生 T2DM, 30 例 (78.9%)仍为 IGR。两组糖代谢转归情况比较, 差异具有统计学意义(χ2=11.826,P=0.003<0.05)。见表 3。

表3 随访1年后两组糖代谢转归情况比较(n,%)
3 讨论
T2DM由遗传与环境因素共同在其发病过程中发挥作用。T2DM的一级亲属与T2DM患者有相同的遗传背景及相似的生活环境, 强烈提示T2DM的防治应从T2DM一级亲属开始。IGR是由正常糖代谢转变为DM的中间状态, 及早对该人群干预可能减少或延缓糖尿病的发生[6-9]。
近年来研究发现, DPP-4抑制剂除能改善胰岛功能外,还可改善血糖波动, 降低血管炎症反应及氧化应激, 从而延缓T2DM的进程。利格列汀作为新一代的DPP-4抑制剂, 同样具有保护胰岛细胞、延缓胰岛细胞凋亡的充分试验证据,使血糖控制更稳定[10-12]。本研究提示利格列汀可以较好地促进饮食负荷刺激的β细胞胰岛素早相分泌, 同时改善胰岛素敏感性, 与文献[7]报道一致。表明利格列汀可以减小血糖波动幅度, 使血糖控制更稳定。研究结果还表明利格列汀干预可显著降低T2DM一级亲属糖尿病发生率, 并能增加正常糖耐量的逆转率, 效果显著[13-15]。
综上所述, 利格列汀干预可显著降低各代谢异常者的患病率, 增加控制达标率, 减轻胰岛素抵抗, 改善β细胞胰岛素早相分泌及改善胰岛功能。但该研究时间尚短, 规模较小,应在停止干预后进一步随访, 观察干预治疗的效果究竟是预防糖尿病的发生还是仅仅延迟糖尿病的进展。
