盐度应激下刺参4个转运相关基因的适应表达研究
2019-01-12,,,,
,,,,
(大连海洋大学 农业农村部北方海水增养殖重点实验室,辽宁 大连 116023)
刺参Apostichopusjaponicus因食用价值和药用价值均较高,已在中国得到广泛养殖,是中国北方重要的海水养殖品种,具有重要的经济效益和社会效益。中国北方多用池塘养殖模式养殖刺参,雨季、潮汐变化及冰冻都会导致海水盐度急剧变化,江河入海口附近,雨季易受到江河径流的影响,池塘中的海水可能数日处于低盐状态[1],盐度变化对刺参的存活和生长发育具有重要影响,也是对刺参养殖产业造成较大威胁甚至造成重大经济损失的因素之一[2]。
刺参的盐度耐受范围较小,极限生长盐度范围为15~40,适宜生长的盐度为20~35,最适生长盐度为25~30。龚海滨等[3]研究发现,刺参对低盐度和高盐度海水极度不适应,会导致刺参大量死亡,且在低盐度海水中,其死亡速度快于高盐度海水。张少华等[4]研究表明,盐度骤降会使刺参出现吐肠排脏或个别化皮等应激反应。在海水盐度为18时达到最低耐受限,低盐时间过长,刺参会大量死亡。庚宸帆等[1]研究发现,盐度胁迫对刺参渗透调节能力有显著影响,体腔液渗透压与体腔液Na+、K+、Cl-离子浓度有一定的相关性。Geng等[5]研究了盐度对刺参不同组织结构的影响,发现不同盐度下刺参各器官及组织会发生显著变化,其中肠、管足及纵肌变化最明显。盐度越低,对组织的破坏程度越明显,损伤程度也会更大。
近年来,对水产动物盐度调控相关基因的研究取得了一定的进展。有研究表明,水通道蛋白(AQP)在三疣梭子蟹Portunustrituberculatus[6]、花鳗鲡Anguillamarmorata[7]、萨罗罗非鱼Sarotherodonmelanotheron[8]、尼罗罗非鱼Tilapianilotica[9]、刀鲚Coilianasus[10]和香港牡蛎Crassostreahongkongensis[11]等物种中的渗透调节作用已被证实。离子转运酶,如Na+/K+-ATPase、V-H+-ATPase、F-H+-ATPase和碳酸酐酶等在渗透调节器官中起主要作用,可维持机体正常的生理代谢水平,并通过参与主动调节体内的离子含量和细胞体积[12]。NKA基因在高盐和低盐适应过程中均起到维持体内渗透平衡的作用,NKA基因在海水虾[13]和大西洋鳕Gadusmorhua[14]、金头鲷SparusaurataL.[15]、漠斑牙鲆Paralichthyslethostigma[16]、尼罗罗非鱼[17]等硬骨鱼类渗透调节中的作用已被证实。Na+/H+-exchanger蛋白基因在三疣梭子蟹低盐环境下发挥重要的渗透调节功能[18]。胞质碳酸酐酶基因(Cytoplasmic carbonic anhydrase,CAc)在凡纳滨对虾Litopenaeusvannamei和三疣梭子蟹高低盐环境下均响应,而磷脂酰肌醇连(Clycosyl-phophatidylinostitol-linked Carbonic Anhydrase,CAg)只对低盐响应[19]。囊性纤维化跨膜传导调节因子(CFTR)基因在舌齿鲈Dicentrarchuslabrax机体对水环境盐度变化的应激反应和调节中发挥作用[20]。免疫球蛋白M (Immunoglobulin M, IgM) 在红鳍东方鲀Takifugurubripes幼鱼的盐度渗透调节过程中发挥作用[21]。热休克蛋白70(Hsp70)和钠钾氯协同转运蛋白1(Na-K-Clcotransporter 1, NKCC1)基因在黑点青鳉鱼Oryziasdancena[22]、吉丽罗非鱼[23]和红鳍东方鲀[21]幼鱼中参与渗透压调节。其中,NKCC1基因能通过维持细胞较高的钠钾离子渗透梯度,从而提高海水虾在高盐环境的适应能力,而RhoGDI基因可通过调整细胞内离子浓度,使细胞在淡水环境下得以生存,在调控淡水虾的渗透调控中起到重要作用[13]。
AMPK 3个亚基参与凡纳滨对虾低盐渗透胁迫[24]和大菱鲆Scophthalmusmaximus盐度渗透胁迫过程[25]。胞内氯离子通道蛋白基因PtCLIC[26]、几丁质酶基因PtChtc[27]在三疣梭子蟹的渗透压调节中发挥作用。Commd1基因(Copper Metabolism Murr 1 Domain)在香港牡蛎发育和渗透压调节方面可能发挥作用[28]。花鲈LateolabraxmaculatusGH/IGF轴可能是通过增加GHRs,进而激活下游IGF-1表达而实现参与低渗调控[29]。
目前,国内外对刺参盐度适应机制相关基因的研究相对较少。DD104基因的表达可能与刺参渗透胁迫有关[30]。有研究表明,Hsp70及Hsp90基因是刺参在盐度胁迫下的重要响应因子[31]。甘氨酸转运蛋白、锌转运蛋白基因、Hsp70和神经乙酰胆碱受体基因参与刺参的低盐调节适应过程[2]。本研究中,选取刺参单羧酸转运蛋白家族16a13(Monocarboxylate Transporters 13,SLC16a13)基因、单羧酸转运蛋白家族6a8(Solute Carrier Family 6 Member 8,SLC6a8)基因、甲壳素受体蛋白(Fibrinogen C Domain-Containing Protein 1,FIBCD1)基因和AMPA型谷氨酸受体1(Glutamate Ionotropic Receptor AMPA Type Subunit 1,Gria1)基因,通过实时荧光定量技术,探究4个基因在刺参体腔液、肠和呼吸树中不同胁迫时间下的表达,以期丰富刺参的生理学理论,为刺参健康养殖提供科学依据。
1 材料与方法
1.1 材料
试验用刺参取自辽宁省大连市瓦房店附近海域,暂养于大连海洋大学北方海水增养殖重点实验室同一养殖池中,水温保持在(16.0±1.0)℃,试验前称量其体质量,刺参的平均湿质量为(16.93±3.08)g。
1.2 方法
1.2.1 试验设计 将正常养殖条件下(盐度为30,低盐胁迫0 h)的刺参作为对照组,低盐胁迫不同时间段的刺参作为试验组。试验用水为自来水曝气24 h后与天然海水配制成盐度为18的海水。将刺参放入盐度为18的海水中进行胁迫,并分别在胁迫后1.5、3、6、12、24、48和72 h进行取样,每个时间点随机取3头刺参,分别取对照组及不同胁迫时间点刺参的肠、呼吸树、体腔液,体腔液以3000 r/min离心10 min,获得体腔细胞。最后将各组织保存于超低温冰箱(-80 ℃)中备用。
1.2.2 引物设计与筛选 从刺参被盐度胁迫后的转录组数据库表达谱中筛选出SLC16a13、SLC6a8、FIBCD1和Gria1 4个基因,以β-actin作为内参基因。以上引物均由生工生物工程(上海)股份有限公司合成。试验所用引物见表1。
1.2.3 荧光定量 PCR 总RNA提取后分别检测其浓度和完整性,然后反转录合成cDNA第一条链,之后保存于冰箱(-20 ℃)中,合成的模板等量混合,以减少个体差异,使用SYBR®Premix ExTaqTMII(TaKaRa),在ABI 7500 Real-Time PCR扩增仪上进行实时定量PCR扩增反应。
1.3 数据处理
以正常盐度30为对照组,每一个时间点设置3个重复,对于任意一个样品,计算目标基因和内参基因(β-actin)的△△Ct值,取平均值后再用2-△△Ct法计算基因的相对表达量。用SPSS 19.0软件对数据进行显著性检验,差异显著性水平设为0.05。
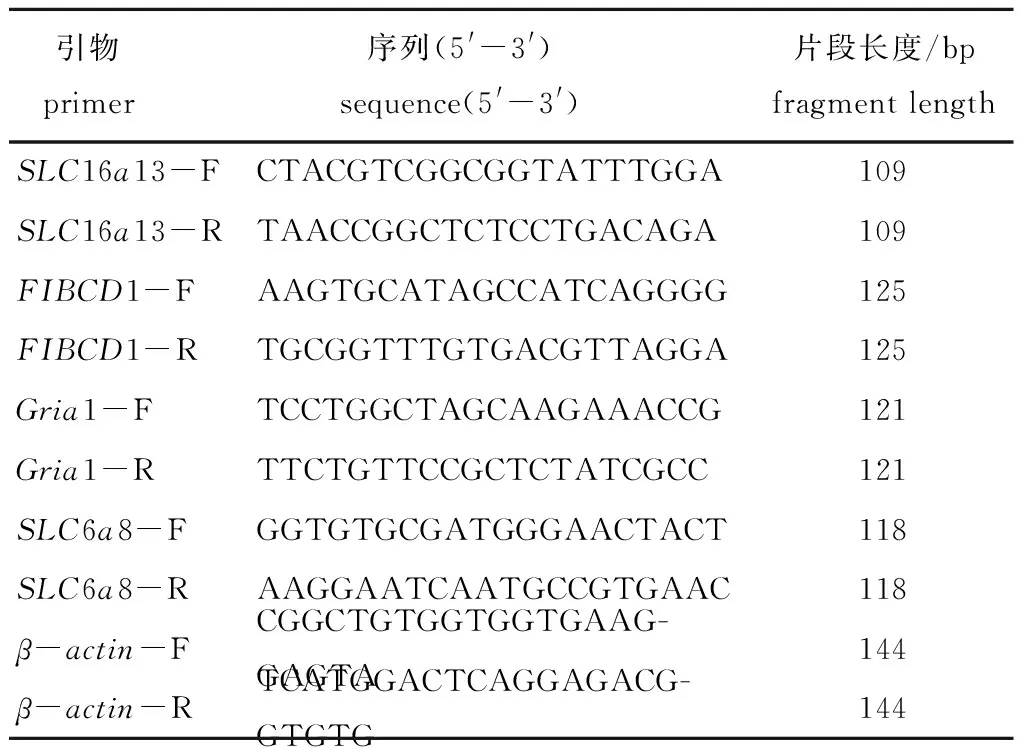
表1 荧光定量PCR所用引物Tab.1 Primers for Real-time PCR used in the experiment
2 结果与分析
2.1 低盐胁迫下SLC16a13基因在刺参组织中的表达差异
刺参受低盐胁迫后,SLC16a13基因在刺参各组织中的表达情况如图1所示。在体腔液中,与对照组(0 h,盐度为30)相比,SLC16a13基因的表达量在1.5、3、24、72 h时间点无显著性变化(P>0.05),在6、12、48 h时间点表达量显著上调(P<0.05);在肠组织中,SLC16a13基因的表达量在1.5、3 h时间点无显著性变化(P>0.05),在其余时间点表达量均显著上调(P<0.05),在72 h时达到最高;在呼吸树组织中,SLC16a13基因表达量在各时间点均显著上调(P<0.05),在72 h时表达量达到最高。在同一胁迫时间段,1.5、3 h时体腔液和呼吸树中表达量显著高于肠组织(P<0.05),72 h时肠组织中表达量最高,其他时间段SLC16a13在体腔液中表达量均最高,显著高于肠和呼吸树(P<0.05)。
2.2 低盐胁迫下SLC6a8基因在刺参各组织中的表达差异
刺参受低盐胁迫后,SLC6a8基因在肠和呼吸树组织中的表达情况如图2所示,在体腔液中的表达情况如图3所示。在肠组织中,与对照组(0 h,盐度30)相比,SLC6a8基因在3、48 h时表达量上调,在其余时间点该基因表达量下调;在呼吸树组织中,在3、12、24 h时该基因表达量上调,12 h时达到最高,在其余时间点表达量下调,72 h时达到最低;在体腔液中,各个时间点该基因表达量均高于对照组,其中在3 h时表达量显著上调(P<0.05),其余时间段表达量均无显著性差异(P>0.05)。在低盐胁迫同一时间段中,体腔液中表达量均显著高于肠和呼吸树(P<0.05)。

注:不同小写字母表示同一组织在低盐胁迫不同时间段存在显著性差异(P<0.05);不同大写字母表示同一低盐胁迫时间段不同组织之间存在显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同Note: Different lowercase letters indicate significant difference (P<0.05) within the same tissue in different periods of low salinity stress;different capital letters indicate significant difference (P<0.05) among different tissues in the same stress period, and the means with the same letters are not significant differences(P>0.05),et sequentia图1 低盐(18)胁迫下单羧酸转运蛋白家族16a13基因在刺参各组织中不同胁迫时段的表达Fig.1 SLC16a13 gene expression in different issues of the sea cucumber exposed to low salinity (18) stress for various period
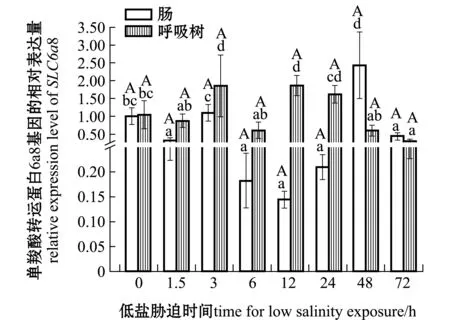
图2 低盐(18)胁迫下单羧酸转运蛋白家族6a8基因在刺参肠和呼吸树各组织中不同胁迫时段的表达Fig.2 SLC6a8 gene expression in intestine and respiratory tree the sea cucumber exposed to low salinity (18) stress for various period
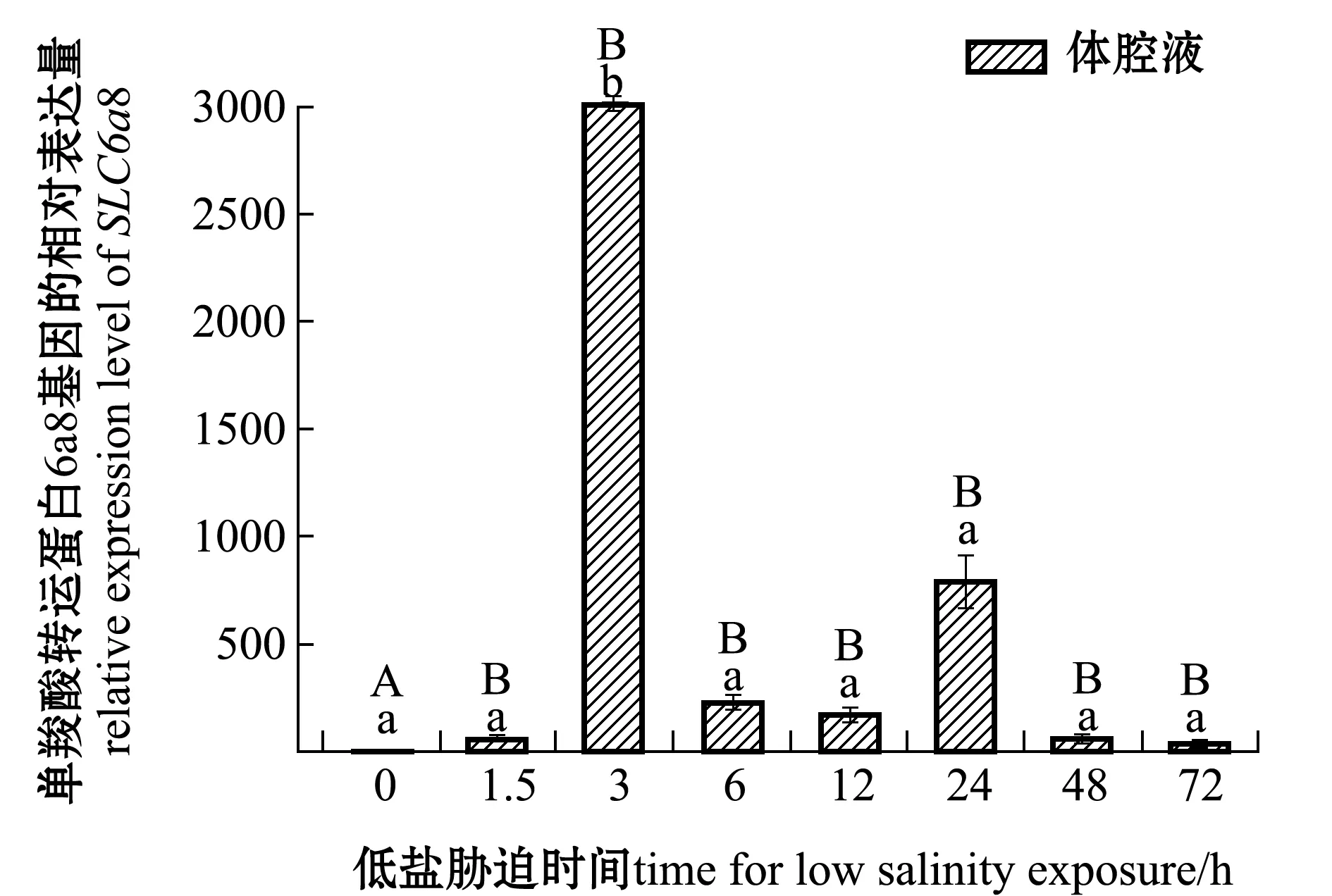
图3 低盐(18)胁迫下单羧酸转运蛋白家族6a8基因在体腔液中不同胁迫时段的表达Fig.3 SLC6a8 gene expression in coelomic fluid of the sea cucumber exposed to low salinity (18) stress for various periods
2.3 低盐胁迫下FIBCD1基因在刺参组织中的表达差异
刺参受低盐胁迫后,FIBCD1基因在刺参各组织中的表达情况如图4所示。在体腔液中,与对照组(0 h,盐度30)相比,除72 h时表达量下调外,其余各时间点表达量均上调,在1.5、6、12 h时表达量均显著升高(P<0.05),在其他各时间点该基因表达量无显著性变化(P>0.05)。在肠组织中,与对照组相比,在1.5 h时表达量无显著性变化(P>0.05),在12 h时表达量显著上调(P<0.05),在其余各时间点表达量均显著下调(P<0.05)。在呼吸树组织中,在24、72 h时表达量下调,但与对照组无显著性差异(P>0.05),在其余时间点表达量均有所下调。在同一胁迫时间段,胁迫前期(1.5~24 h)体腔液中表达量显著高于肠和呼吸树(P<0.05),后期72 h时表达量下调至低于肠和呼吸树(P<0.05)。
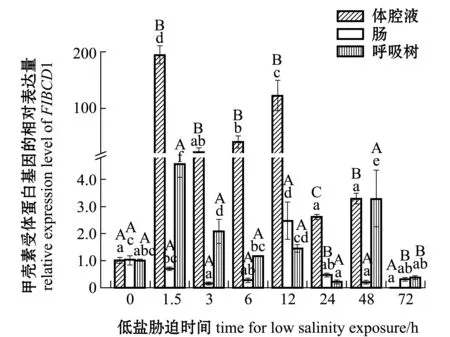
图4 低盐(18)胁迫下甲壳素受体蛋白基因在刺参各组织中不同胁迫时段的表达Fig.4 FIBCD1 gene expression in different issues of the sea cucumber exposed to low salinity (18) for various periods
2.4 低盐胁迫下Gria1基因在刺参各组织中的表达差异
刺参受低盐胁迫后,Gria1基因在各组织中的表达情况如图5所示。与对照组(0 h,盐度30)相比,在体腔液中,表达量在3、6、24 h时无显著性差异(P>0.05),在1.5、48 h时显著上调(P<0.05),72 h时显著下调(P<0.05)。在肠组织中,该基因表达量总体趋势为上调,并于6 h时达到最高。在呼吸树组织中,除72 h以外,在其他时间点该基因表达量均下调,且显著低于对照组(P<0.05),72 h时表达量略高于对照组(P>0.05)。同一胁迫时间点,1.5 h时体腔液中Griai的表达量显著高于其他组织(P<0.05),其他时间点(12 h时除外),Gria1在肠组织的表达量均显著高于其他组织(P<0.05)。

图5 低盐(18)胁迫下谷氨酸离子受体AMPA型亚基1基因在刺参各组织中不同胁迫时段的表达Fig.5 Gria1 gene expression in different issues of the sea cucumber exposed to low salinity (18) for various periods
3 讨论
3.1 低盐胁迫下单羧酸转运蛋白家族16a13基因的组织表达
单羧酸转运蛋白家族16a13,又称MCT13,属于溶质运载蛋白家族SLC16A亚家族成员,是一类跨膜蛋白,负责转运乙酰乙酸、酮体和乳酸等物质,在维持细胞正常pH值环境和能量代谢方面发挥着重要作用[32]。目前,已发现该家族有14个成员。研究表明,MCTs具有偶联转运细胞新陈代谢中产生的单羧酸与质子的功能[33]。Hirai等[34]研究发现,MCT13在小鼠肝脏和小肠中被PPAR-α激动剂诱导,表明该转运蛋白可能参与营养摄取。Nowik等[35]研究调查小鼠肾脏转录组的变化,检测到SLC16家族的SLC16a13(MCT13)mRNA表达水平有变化。Patel等[36]在研究溶质转运蛋白在重要组织中的作用中多个溶质转运蛋白均表现出上调表达,其中包括MCT13基因在肝脏组织中被上调表达,由此认为多种组织中的各种溶质转运蛋白的稳态表达是精心调控的。本研究结果表明,刺参受低盐胁迫后SLC16a13基因在各组织中总体表现为上调表达,说明该基因参与刺参的盐度适应过程。
3.2 低盐胁迫下单羧酸转运蛋白家族6a8基因的组织表达
单羧酸转运蛋白家族6是通过将溶质耦合到氯与钠转运体,沿着电化学梯度共转运介导溶质穿过质膜[37]。SLC6a8属于单羧酸转运蛋白家族6成员之一,是一种质膜蛋白,其功能是将肌酸转入或者转出细胞,也称为肌酸转运蛋白。其相关途径包括蛋白激酶介导的磷酸化和脱蛋白,具备神经递质和钠同向转运体活性,是摄取肌酸的必需品[38]。肌酸和磷酸肌酸在磷酸盐结合能的储存和传输中起到重要作用,为细胞提供能量[39]。
有研究表明,肌酸在Na+/K+-ATP酶活性、神经递质释放、维持膜电位、Ca2+稳态和离子梯度恢复方面具有重要作用[40]。研究表明,SLC6a8基因在包括骨骼肌、肾脏、小肠、心脏、脑和视网膜在内的各种组织中表达[41]。由于肌酸可逆地结合磷酸盐,可能会补充机体短期内ATP能量的耗竭[42],其细胞的积累能够支持细胞具备储存代谢能量的能力。本研究结果表明,低盐胁迫过程中,SLC6a8基因在肠和呼吸树中的表达总体呈现先上升后下降的趋势,这说明在盐度胁迫过程中,刺参可能需要SLC6a8基因的表达变化来调节刺参机体中肌酸的运输,进而为刺参的盐度适应过程提供能量需求。SLC6a8基因在体腔液的表达一直呈现出上调状态,高表达量说明其在刺参盐度适应过程中发挥重要作用,也说明刺参在盐度适应过程中体腔液对肌酸提供能量的需求大,在体腔液、肠和呼吸树中SLC6a8达到最大表达量的时间点有所不同,说明其在体腔液、肠和呼吸树对肌酸提供能量的需求不同。总之,刺参在盐度胁迫下肌酸转运蛋白基因SLC6a8的表达模式说明,SLC6a8基因可能参与刺参的盐度适应过程,此推测还需要进一步进行试验验证。
3.3 低盐胁迫下谷氨酸离子受体AMPA型亚基1基因的组织表达
谷氨酸离子受体AMPA型亚基1(Gria1/AMPA1)与L-谷氨酸结合后诱导构象改变,导致阳离子通道的打开,进而对Na+、K+有通透性,在中枢神经系统的许多突触中起着重要作用[43]。有研究表明,暴露于急性应激条件下,大鼠的前额皮质椎体神经元AMPA受体调节的突触电流有显著上升趋势[44],谷氨酸受体转运增强,谷氨酸受体在膜上表达升高[45]。在应激刺激下,增加突触传递,突触传递是可逆、迅速的,可能会使突触前膜上的谷氨酸释放增加[46],同时,突触后膜上盐皮质激素受体快速增加,会影响细胞膜AMPA受体的数量,导致海马迅速活跃及神经递质增强。
本研究结果表明,刺参受低盐胁迫后谷氨酸受体蛋白基因Gria1在不同组织和时间点有不同的表达模式,这种结果说明在刺参对盐度的适应过程中,Gria1/AMPA1基因参与其中。
3.4 低盐胁迫下甲壳素受体蛋白基因的组织表达
FIBCD1属于甲壳素受体蛋白家族,其纤维蛋白原结构域可以选择性地与钙依赖的乙酰化组分结合,并且在胞吞作用及免疫防御和免疫反应调制中起到作用[47]。本研究结果表明,刺参受低盐胁迫后FIBCD1基因在各组织中均检测到其表达,说明刺参对盐度的适应过程中可能需要在免疫过程中发挥作用的FIBCD1参与,由于刺参缺乏完善的免疫系统,可能需要免疫相关基因参与其过程,进而达到适应盐度应激的过程。有研究表明,作为重要免疫因子的热休克蛋白基因Hsp70及Hsp90也是刺参在盐度胁迫下的重要响应因子[31]。
综上所述,SLC16a13、SLC6a8、FIBCD1和Gria1 4个基因均参与刺参的盐度适应过程。本研究结果可为刺参的健康养殖提供重要的科学依据,下一步需要进一步验证4个基因在刺参盐度适应过程中发挥的具体功能。
