镍离子催化零价锌去除水中双氯芬酸
2019-01-12,,,,,,
,,, ,, ,
(1.浙江工业大学 建筑工程学院,浙江 杭州 310023;2.浙江工业大学 环境学院,浙江 杭州 310014)

本研究采用镍离子催化零价锌还原水中双氯芬酸,考察了镍离子投加量、pH值、溶解氧以及转速对镍离子催化零价锌还原双氯芬酸的影响并探讨其降解机制。
1 材料与方法
1.1 试剂和仪器
双氯芬酸钠(0.1 g,纯品,德国Dr. Ehrenstorfer公司),锌粉(分析纯,天津市巴斯夫化工有限公司),六水氯化镍(99.99%,上海阿拉丁生化科技股份有限公司),甲醇(色谱纯,德国CNW科技公司),甲酸(色谱纯,上海阿拉丁生化科技股份有限公司);Agilent 1200高效液相色谱仪,配有G1314C型号的紫外检测器(美国安捷伦公司);旋转培养器QB-328(海门市其林贝尔仪器制造有限公司),扫描电镜(日立SU8010)。
1.2 试验方法
在40 mL棕色萃取瓶中加入40 mL超纯水(Milli-Q制备),之后加入一定量的0.1 mol/L的氯化镍,调节溶液pH值,再加入20 μL的0.1 g/L的DCF的母液使得DCF的起始质量浓度为500 μg/L,最后加入10 g/L的锌粉,盖紧瓶盖,放置到旋转培养器中以一定的转速避光旋转。定时取样,所取样品采用真空泵经0.45 μm滤膜抽滤,分离未反应的锌粉从而终止反应,所得水样用于对DCF质量浓度的分析测试,计算DCF的降解去除率。抽滤后的锌粉颗粒放置在40 ℃的真空干燥箱内3 h,烘干水分,用于扫描电镜分析。
1.3 分析方法
采用Agilent 1200高效液相色谱仪对双氯芬酸浓度进行测定,操作条件:C18柱(5 μm,4.6 mm×150 mm),紫外检测器(检测波长为276 nm),流动相为V(甲醇)∶V(0.1%甲酸)=75∶25,流速:1 mL/min,进样量:100 μL,柱温:30 ℃。
1.4 数据分析
拟一级动力学方程为
C=C0e-kt
(1)
式中:C0为DCF的起始质量浓度;C为某一反应时间点DCF的质量浓度;t为反应时间;k为拟一级反应速率常数。
对式(1)两边取对数后可得
ln(C0/C)=kt
(2)

图1 镍离子催化零价锌去除水中DCF的效能Fig.1 Efficiency of nickel ion catalyzed reduction of DCF with zero-valent zinc in water
2 结果与讨论
2.1 镍离子催化零价锌去除水中DCF的效能
图1为镍离子催化零价锌去除DCF的效能。实验条件:镍离子的投加量为1.0 mmol/L,溶液初始pH值为7.0,溶解氧质量浓度为8 mg/L,转速为45 r/min。如图1所示,单独投加锌粉或镍离子对DCF的去除不显著,反应进行72 h,DCF的去除率分别为25.4%和1%。采用镍离子催化零价锌的反应体系中,反应72 h DCF的去除率达到99.8%,相较单独用零价锌还原DCF的去除率有了大幅提高。同时较单独零价锌和单独镍离子对DCF的去除率的加和高出73个百分点。这说明镍离子对零价锌还原DCF具有催化活性。
2.2 镍离子投加量的影响
考察了镍离子投加量对反应的影响,实验条件:镍离子浓度为0.1,0.5,1.0,2.0 mmol/L,初始pH为7.0,溶解氧质量浓度为8 mg/L,转速为45 r/min。结果如图2所示,在0~6 h,初始镍离子浓度对DCF的去除基本上没有影响,但当反应进行到12 h后,随着镍离子浓度的增加,反应体系对DCF的去除效率不断增加。但当镍离子的投加量超过1.0 mmol/L时,反应速率增大不明显。因此,从成本角度考虑,镍离子的投加量选定为1.0 mmol/L。
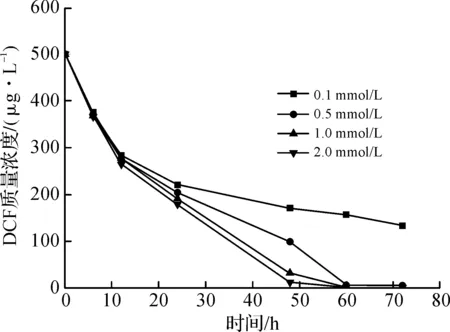
图2 镍离子浓度对Zn/Ni2+体系去除DCF的影响Fig.2 Effect of nickel ion concentration on the removal of DCF with Zn/Ni2+
已有的过渡金属离子催化零价金属的研究将过渡金属离子对反应速率的提高归因于其与零价金属生成了双金属。锌粉表面附着的镍,可能会与锌粉形成原电池,提高锌粉的腐蚀速度,同时还能起到催化加氢的作用,它能使金属表面形成一种活性氢原子,这种活性氢原子能吸附在Zn/Ni表面对目标物进行催化加氢[13-15]。这种氢原子有两种途径形成:1) Ni加速锌和水的反应生成H2,之后催化H2生成活性氢原子;2) Ni催化H+接收锌腐蚀给出的电子直接生成活性氢原子。增加镍离子的投加量,其催化零价锌腐蚀的速率加快,产生了更多的活性氢原子,这些活性氢使镍表面的DCF中的氯原子被活性氢原子取代。但因为DCF的初始质量浓度不变,所需要的活性氢原子是一定的,镍离子增加到一定量后活性氢原子的增加不会显著影响DCF的去除率。表1是对不同镍离子投加量条件下还原DCF的反应拟合的拟一级反应动力学方程。从图2和表1中可以看出:当Ni2+的投加量为0.1 mmol/L时DCF的最终去除率为73.5%,且反应速率较低。这说明Ni2+催化金属锌生成的活性氢原子数量少,因此阻碍了对DCF的去除;当Ni2+的投加量分别为0.5,1.0,2.0 mmol/L时,反应符合拟一级反应动力学,且随着Ni2+投加量的增多,反应速率常数(k值)也随之增加。这说明,随着Ni2+投加量的增多,催化金属锌产生的活性氢原子也在增加,Ni2+能明显提高锌粉对DCF的去除率并加快锌粉对DCF的去除速率。
表1不同离子投加量条件下还原DCF的动力学
Table1KineticsofDCFreductionunderdifferentNi2+concentrations

序号Ni2+投加量/(mmol·L-1)ln(C0/C)k值R210.10.021 7t0.021 70.882 220.50.034 6t0.034 60.960 031.00.053 9t0.053 90.960 742.00.063 2t0.063 20.986 8
2.3 溶液pH值的影响
考察了溶液初始pH值对镍离子催化零价锌还原DCF反应的影响。实验条件:溶液初始pH值为4.0,7.0,8.0,10.0,12.0,溶解氧质量浓度为8 mg/L,镍离子投加量为1.0 mmol/L,转速为45 r/min,结果如图3所示。从图3可以看出:溶液pH值越低,反应进行越快。在反应60 h后,pH范围在4.0~8.0时,DCF的去除率均超过98%,但当pH=10.0,12.0时,DCF的去除率急剧下降,反应进行72 h,反应体系对DCF的去除率分别为33.0%,6.4%。溶液呈弱酸性、中性和弱碱性时有利于锌的腐蚀(有利于清理锌粉的表面并且减少钝化膜生成),同时水中充足的氢离子有利于活性氢原子的生成,从而可以提高反应体系对DCF的还原能力。在pH值较高时,溶液中存在的氢离子较少,并且锌腐蚀产生的Zn2+与OH-反应生成氢氧化锌,之后氢氧化物沉淀在锌粉表面,生成了一层钝化膜,这层膜阻碍了锌的腐蚀,影响了对DCF的去除。表2是对不同溶液初始pH值下镍离子催化零价锌还原DCF的反应进行拟合得到的拟一级反应动力学方程。从表2可以看出:在pH为4.0,7.0,8.0时,反应符合拟一级动力学模型,且pH值越低,反应速率常数(k值)也越大,说明反应体系中的氢离子确实有利于DCF的去除;在pH为10.0,12.0时,反应明显不符合拟一级动力学模型,反应速率缓慢,去除率明显降低,说明碱性条件不利于反应进行,这与上述推断一致。

图3 初始pH值对Zn/Ni2+体系去除DCF的影响Fig.3 Effect of initial pH value on the removal of DCF with Zn/Ni2+ system
Table2KineticsofDCFreductionunderdifferentpHvalues
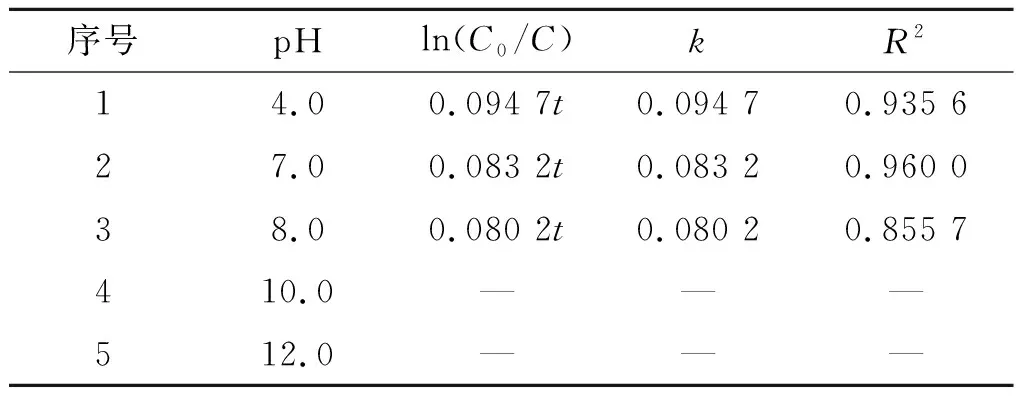
序号pHln(C0/C)kR214.00.094 7t0.094 70.935 627.00.083 2t0.083 20.960 038.00.080 2t0.080 20.855 7410.0———512.0———
2.4 溶液溶解氧质量浓度的影响
考察了溶解氧质量浓度对镍离子催化零价锌还原DCF反应的影响,实验条件:溶解氧初始质量浓度为0,3,6,8,20 mg/L,初始pH为7.0,镍离子投加量为1.0 mmol/L,转速为45 r/min。结果如图4所示,在反应的初始阶段0~12 h内,反应体系的初始溶解氧质量浓度越高,对DCF的去除速率越快;但是当反应到24 h以后时,结果与此相反,低质量浓度的溶解氧更有利于DCF的去除。这可能是因为当水中的溶解氧质量浓度较高时,锌粉会首先与氧气反应,反应生成的物质与DCF发生了吸附;但随着反应的进行,在溶解氧较高时,氧气抑制活性氢生成的同时会消耗已经生成的活性氢,从而和DCF产生竞争作用,因而会导致DCF的去除率和反应速率下降。水中的初始溶解氧质量浓度在0~6 mg/L时,反应体系对DCF的降解效果最好。但从总体来看,溶解氧质量浓度对DCF的最终去除率影响不大,体系经过60 h的反应后,DCF的去除率最终都能达到98%。表3是对不同溶液溶解氧质量浓度下镍离子催化零价锌还原DCF的反应进行拟合得到的拟一级反应动力学方程。从表3中可以看出:溶解氧质量浓度为8,20 mg/L时,反应速率常数(k值)较小,原因和上述一致,即氧气会抑制活性氢原子的产生并且和已经生成的活性氢原子发生反应,因而会降低DCF反应速率。
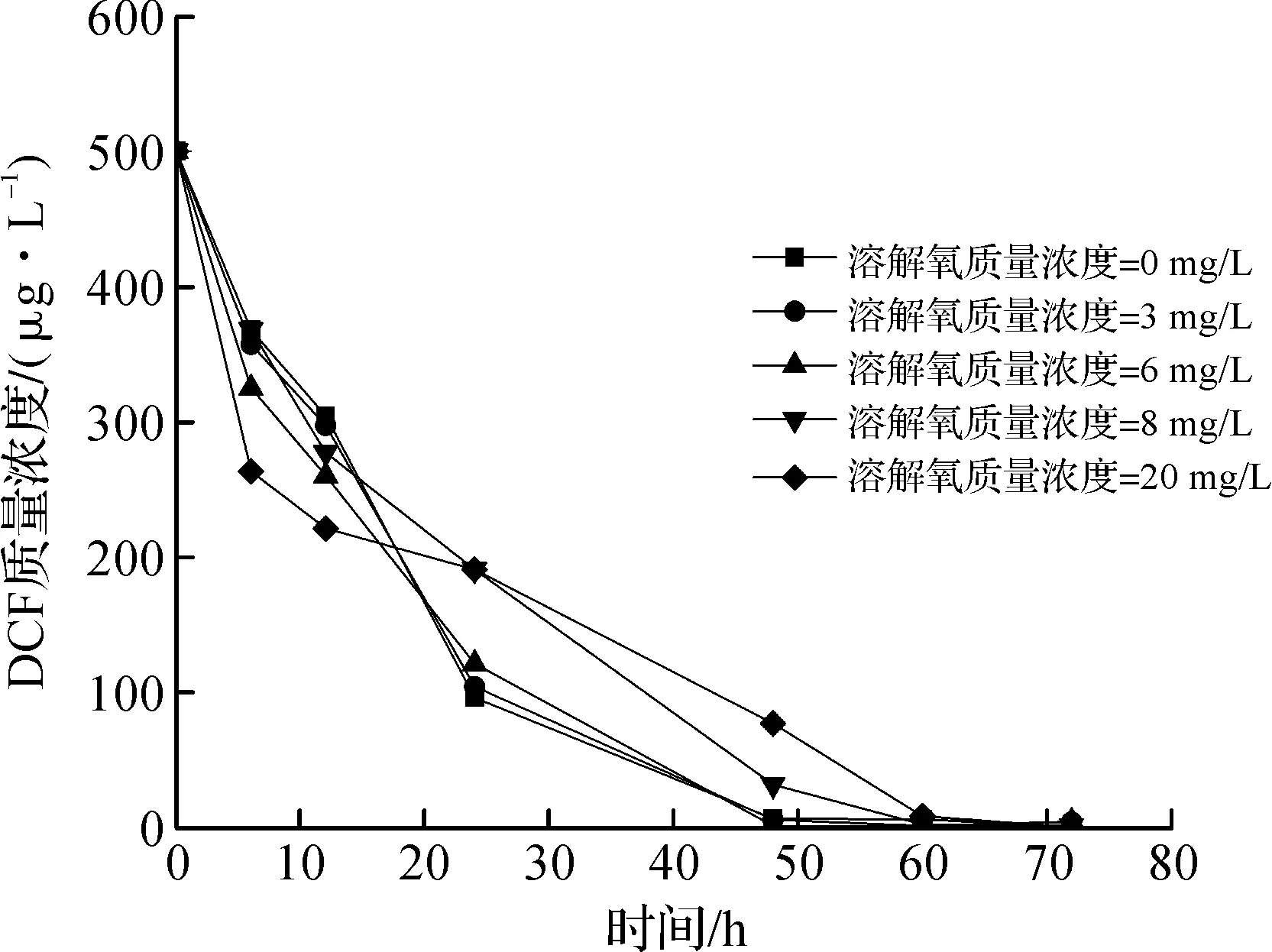
图4 溶解氧质量浓度对Zn/Ni2+体系去除DCF的影响Fig.4 Effect of DO mass concentration on the removal of DCF with Zn/Ni2+
Table3KineticsofDCFreductionunderdifferentmassconcentrationsofdissolvedoxygen
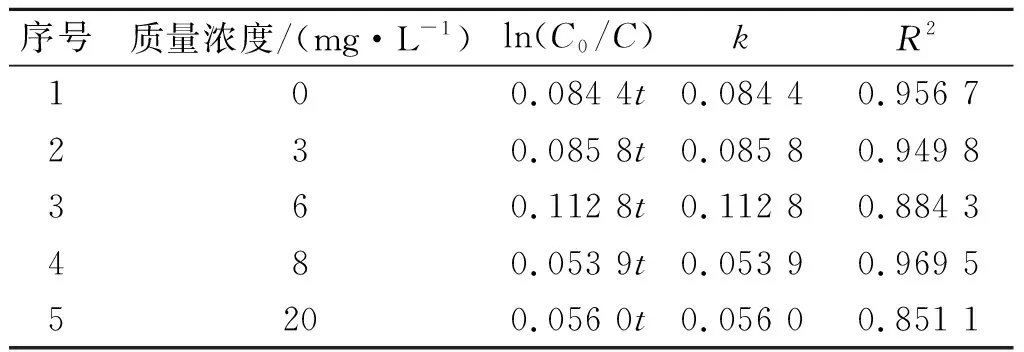
序号质量浓度/(mg·L-1)ln(C0/C)kR2100.084 4t0.084 40.956 7230.085 8t0.085 80.949 8360.112 8t0.112 80.884 3480.053 9t0.053 90.969 55200.056 0t0.056 00.851 1
2.5 旋转培养器转速的影响

图5 转速对Zn/Ni2+体系去除DCF的影响Fig.5 Effect of rotating speeds on the removal of DCF with Zn/Ni2+
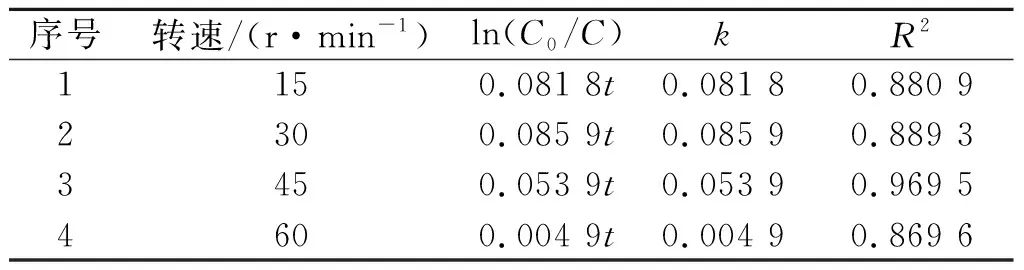
考察了旋转培养器转速对反应的影响,实验条件:旋转培养器转速为15,30,45,60 r/min,初始pH为7.0,溶解氧质量浓度为8 mg/L,镍离子投加量为1.0 mmol/L,结果如图5所示。从图5可以看出:在转盘转速为15~45 r/min时,转速对DCF的去除率影响不大,且在不同的转速条件下反应体系对DCF的去除率都大于98%;但是在转速等于60 r/min时,DCF的去除率只有27.8%,且反应速率明显降低。在试验中发现,在转盘转速过大时,反应器对锌粉的离心力明显增大,锌粉会吸附在反应器的瓶底或瓶口,导致DCF与锌粉的接触机会减少,降低了DCF的去除率。表4是对不同转速下镍离子催化零价锌还原DCF的反应进行拟合得到的拟一级反应动力学模型。从表4中可以看出:反应都符合拟一级反应动力学模型,在转速为15,30 r/min时的反应速率常数(k值)比转速为45,60 r/min时的大,特别是转速为60 r/min时,反应速率常数(k值)远远小于另外3个转速时的反应速率常数,这是由于当转速增大时,反应器受到的离心力过大,锌粉保持在反应器的底部,未能与溶液充分接触,导致反应速率降低。
表4不同转速条件下还原DCF的动力学
Table4KineticsofDCFreductionunderdifferentrotatingspeeds
序号转速/(r·min-1)ln(C0/C)kR21150.081 8t0.081 80.880 92300.085 9t0.085 90.889 33450.053 9t0.053 90.969 54600.004 9t0.004 90.869 6
2.6 SEM的表征
为了更直观地了解镍离子催化零价锌对DCF的去除过程,分别对未经反应的锌粉颗粒、零价锌体系反应48 h后的锌粉颗粒以及锌/镍体系反应48 h后的锌粉颗粒进行扫描电镜测试,结果如图6所示。从图6中可以直观地看出3种反应条件下得到的锌粉颗粒表面有明显的区别。原始锌粉颗粒的表面光滑并带有些许突出的棱角,零价锌体系反应48 h后的锌粉颗粒表面趋于光滑并在表面有蜂窝状的微小孔洞,锌/镍体系反应48 h后的锌粉颗粒表面粗糙且有不规则的棱角凸起。从图6中可以看出:零价锌体系反应48 h后,锌粉有一定程度的腐蚀,而锌/镍体系反应48 h后,锌粉的腐蚀程度更加剧烈。这表明:镍离子能促进零价锌的腐蚀,并且进一步地起到催化作用,促进活性氢的生成,从而加快DCF的降解。

图6 不同反应条件下锌粉颗粒的扫描电镜图Fig.6 The scanning electron micrograph of zinc powder particles under different reaction conditions
3 结 论
镍离子可以有效催化锌粉去除水中DCF,反应72 h,DCF的去除率可以达到99.8%;镍离子的加入会加速锌的腐蚀并有利于生成活性氢原子,从而加快DCF的降解速率,镍离子投加量越多,体系的反应速率越快;溶液pH值为4.0~8.0时,反应60 h镍离子催化零价锌还原DCF的去除率均超过98%;溶液溶解氧质量浓度和较低的旋转培养器转速对DCF的最终降解率基本没有影响,较高的旋转培养器转速会抑制反应的进行。
本文得到浙江工业大学校级大学生创新创业训练计划项目(2017041)的资助。
