蛋白质动态运动在生物化学实验中的教学实践研究
2019-01-11魏旭旭
魏旭旭

[摘 要] 在本科生物化学实验中进行蛋白质动态运动实验,主要利用了G蛋白偶联受体内吞的原理,与绿色荧光蛋白与荧光蛋白显微成像的技术结合起来,对受体蛋白内吞的过程以及动态运动进行观察,这种实验具有操作性强、结果清晰和直观等特点,让生物化学本科教学的内容得到不断的扩展,使学生对蛋白质的运动特征理解更加深入,从而将学生设计实验以及进行实验的综合能力有效提高。主要对蛋白质动态运动在生物化学实验中的教学实践进行探讨,希望能够提供一定的参考价值。
[关 键 词] 蛋白质动态运动;生物化学;实验教学
[中图分类号] G712 [文献标志码] A [文章编号] 2096-0603(2019)31-0292-02
目前在高校进行生物化学实验教学的主要内容是对体外非细胞体系的测试性进行实验,比如检测酶的活性、测定蛋白质的浓度等,而对细胞内蛋白质动态运动进行实验的教学非常少,通过有效利用相关的原理和荧光蛋白显微成像的技术,让学生能够对受体蛋白在细胞内进行内吞运动以及回膜运动进行观察和实验,并且还能对下游招募蛋白的定位和运动同时进行观察,这种实验模型不仅能研究膜受体的内吞机制基础,还能筛选出受体的药物,具有非常大的推广价值。
一、蛋白质动态运动的实验原理
G蛋白偶联受体在真菌和哺乳动物的生命体中广泛存在,是一种具有高保守性的细胞膜蛋白超家族。在细胞外其信号主要是通过GPCRs传递信息至细胞内部,并能充分发挥调控的作用,该类信号传输系统能够紧密联系人体内部的疾病,比如肥胖、糖尿病、骨质疏松等,所以GPCRs一直是研发新药的重要因素。当GPCRs中的激动剂一直存在时,将会在几分钟或几个小时内降低引起细胞膜表面的受体数量,则会发生内吞运动,之后GPCRs就会呈现出反应性的降低情况,这种现象被称为受体失敏现象,GPCRs进行内吞以及失敏是对GPCRs介导的信号转导进行调节的重要内容。进行内吞运动后,受体可以通过内含体循环运动回到细胞膜表面,从而完成复敏,还可以被送到溶酶体中进行不可逆的降解工序。
二、蛋白质动态运动在生物化学实验中的具体实验步骤
(一)提取并检测质粒
在本实验中所使用的质粒包括FPR1-pEGFP、PCMV-FPR1等,在大肠杆菌中转化所用的质粒,并扩大培养摇菌,使用专用的去除内毒素质粒提取试剂盒将相关的质粒提取出来,并用紫外分光光度法定量分析所有提取的质粒。
(二)培养相关的细胞
本实验中使用的细胞株为人胚胎肾细胞HEK293,用FBS(10%)的DMEM/Low Glucose的培养基在37℃的温度以及CO2浓度为5%的培养箱中对其进行培养,当细胞的汇合度达到一定标准时(80%~90%),再对其进行稀释,比例为1∶3~1∶5。
(三)转染工序
HEK293细胞的生长状态比较良好,将其继续接种在有6个孔的培养板中,其密度值为3×105~5×105,继续在37℃的温度下以及CO2浓度为5%的培养箱中对其培养,时间长度一般为18~24h,当细胞汇合度达到80%~90%的标准时,再使用Lipofectamine对其进行转染工序,转染后继续培养4~6h之后,将其换入新鲜的培养基中继续培养8~12h,目前比较常使用的转染方案是将6孔培养板中其中2孔的细胞进行转染,直接对FPR1-GFP的受体蛋白进行观察,主要观察发生的内吞运动,其他4孔细胞主要用于对FPR1被配体激活后辅助蛋白的动态变化进行观察,在该实验中学生可以根据实际的情况对设计的方案进行调整。
(四)研究受体的定位以及内吞運动
首先需要在有灭菌盖玻片的6孔板中平均分配6孔板中转染后的HEK293细胞,让细胞在灭菌盖玻片上进行生长,在温度为37℃,CO2浓度为5%的培养箱中培养18~24h,并且在进行实验的当天观察细胞的汇合度是否达到70%~80%,在6孔板中将其中2孔的细胞提前加入蛋白质合成的抑制剂放线菌酮进行过夜培养,然后使用激动剂对已经转染的细胞进行孵育,孵育时常分别为0min、5min、30min、45min,主要是对激动剂处理时间不同受体蛋白发生的定位以及内吞运动进行观察,再配置出不同浓度的激动剂fMLP对其进行稀释,在37℃,CO2浓度为5%的培养箱中孵育45min,对不同浓度激动剂对FPR1受体内吞运动的影响进行观察,待孵育完毕后吸出待检细胞中的细胞培养基,并使用PBS对细胞进行漂洗,漂洗后,首先使用多聚甲醛(浓度为4%)在室温中固定10min,再在6孔板中取出玻片,将其放置在滴有甘油的盖玻片上进行封片,最后使用荧光显微镜对绿色荧光蛋白的分布进行观测。
三、实验结果
(一)对不同时间的激动剂作用下FPR1从细胞膜到包浆的内吞运动进行观察
使用FPR1激动剂fMLP对有FPR1-pEGFP的细胞进行刺激转染,并在温度为37℃,CO2浓度为5%的培养箱中分别孵育0、5、30以及45min,用使用荧光显微镜对融合蛋白的定位进行观察,其膜受体蛋白内存运动的具体过程如图1所示。
由图1可以看出,在0min时加不加激动剂,受体蛋白主要在细胞膜上表达,而在5min时,部分的受体蛋白已经形成颗粒状,并出现了内吞运动,但是细胞膜上还存在一部分的受体蛋白。
(二)对激动剂浓度不同作用于FPR1后的受体内吞运动进行观察
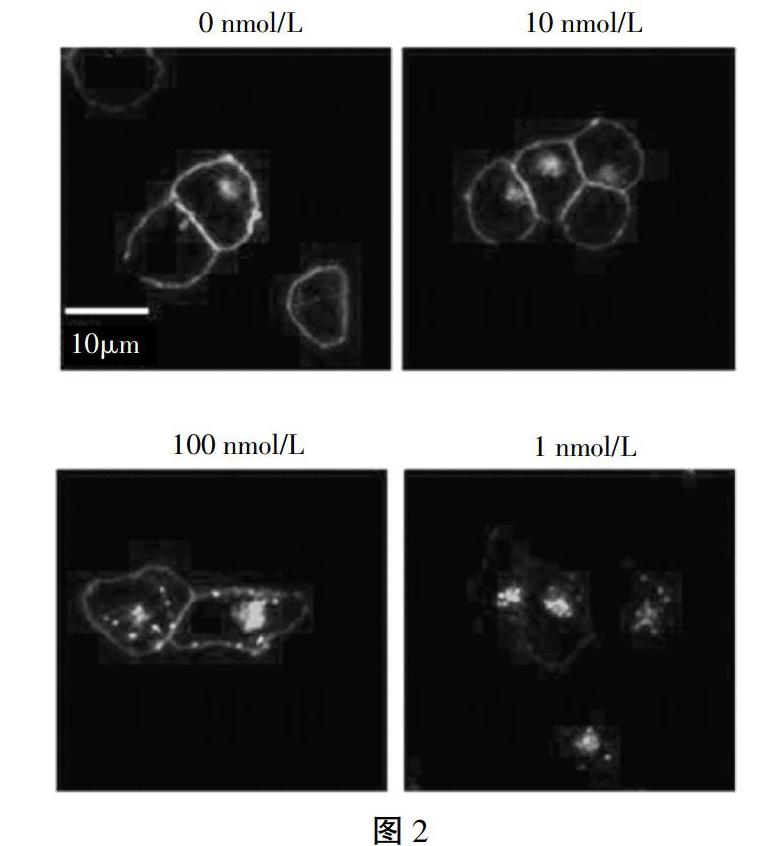
使用不同浓度的FPR1激动剂对有FPR1-pEGFP的细胞进行刺激转染,浓度分别为1μmol/L、100nmol/L以及10nmol/L,在温度为37℃,CO2浓度为5%的培养箱中孵育45min,并使用荧光显微镜对受体蛋白的定位进行观察,其实主要的内吞运动如图2所示。
由图2可以看出,当激动剂为低浓度10nmol/L时,受体蛋白没有发生内吞运动,而在100nmol/L的刺激下,则开始发生部分的内吞运动,最后使用高浓度1μmol/L激动剂时,几乎全部发生了内存运动,这说明在受体蛋白内吞的数量与激动剂的浓度存在一定的关联。
四、结语
通过在生物化学实验中进行蛋白质动态运动的教学实践,可以了解到这种教学实践能够将实验的思考有效扩展开来,并且让学生学习到荧光蛋白显微成像技术,具有较强的综合性,也能积极调动学生学习的积极性,最后实验的结果也非常直观,能够让学生对蛋白质在信号刺激以及一系列分子事件当中的运动和相关机制得到更加深入的认识和了解,促进学生得到全面发展。
参考文献:
史影,王伟伟,叶伶燕,等.蛋白质动态运动在生物化学实验中的教学实践[J].实验技术与管理,2019,36(1):24-27.
编辑 陈鲜艳
