人参皂苷Rg3对糖尿病皮肤损伤的AGEs表达及氧化应激反应的影响
2019-01-10起荣林柯瑾李静平
起荣林 柯瑾 李静平

摘要:目的 探讨人参皂苷Rg3(Ginsenoside Rg3)促进糖尿病(DM)皮肤创面愈合的作用机理。方法 雄性SD大鼠制备DM模型,随机分为模型对照组、阳性药组、Ginsenoside Rg3低、高剂量组,另设正常对照组。灌胃给药4周后,取上述DM大鼠和正常大鼠,制备难愈创面。伤后21d,取创缘皮肤组织,检测皮肤组织糖含量、免疫荧光染色检测AGEs表达;收集血浆,测定相关氧化应激反应指标(H2O2、MDA、GSH)。结果 与模型组比较,Ginsenoside Rg3干预后,晚期糖基化终末产物(AGEs)在皮肤组织中的蓄积较少(P<0.01);血浆H2O2、MDA含量显著下降(P<0.05或P<0.01),血浆GSH含量上升(P<0.05)。结论 GinsenRg3可能通过抑制DM创面皮肤组织中的AGEs沉积,调节过强氧化应激状态,促进DM大鼠创面愈合。
关键词:糖尿病皮损;AGEs;氧化应激;人参皂苷Rg3
中图分类号:R285.5 文献标志码:A 文章编号:1007-2349(2019)12-0051-04
【Abstract】Objective: To study the mechanism of Ginsenoside Rg3 in promoting wound healing of diabetic mellitus (DM) skin. Methods: Male SD rats were randomly divided into model control group, positive drug group, Ginsenoside Rg3 low and high dose groups and normal control group. Four weeks after the intragastric administration, the above DM rats and normal rats were taken to prepare a refractory wound. On the 21st day after injury, the skin tissue of the wound edge was taken, the sugar content of the skin tissue was detected, and the expression of AGEs was detected by immunofluorescence staining. Plasma was collected and the related oxidative stress response indexes (H2O2, MDA, GSH) were determined. Results: Compared with those of the model group, the accumulation of advanced glycation end products (AGEs) in skin tissue was less after Ginsenoside Rg3 intervention (P<0.01), plasma H2O2 and MDA levels were significantly decreased (P<0.05 or P<0.01) and plasma GSH content increased (P<0.05). Conclusion: GinsenRg3 may regulate excessive oxidative stress and accelerate wound healing in DM rats by inhibiting AGEs deposition in DM wound skin tissue.
【Key words】diabetic lesion, AGEs, oxidative stress, Ginsenoside Rg3
糖尿病(Diabetes mellitus,DM)自发性皮肤损伤(如DM溃疡、DM性水疱等)或外源性创伤所致皮肤创面难愈成为DM患者最常见、且严重的并发症之一。其创面愈合不良是一个多因素、多环节参加的病理过程,发病机制复杂。目前医学虽能有效控制患者血糖,但尚缺乏安全、有效地加速DM性创面修复的积极措施和相关治疗药物[1]。
研究表明,DM人代谢障碍引起的皮肤中糖含量增高和晚期糖基化终末产物(Advanced glycation end product,AGEs)沉积为特征的“微环境污染”可能是DM人皮肤创面难于愈合的关键始动因素。AGEs作为DM代谢重构的直接产物,一旦形成,则蓄积在血液循环和皮肤、肝脏等组织及脏器中,与其受体(RAGE)相互作用后引起氧化应激(oxidative stress,OS)反应。抗氧化酶糖基化,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等抗氧化酶活性降低,过氧化氢(H2O2)、丙二醛(MDA)谷胱甘肽(GSH)等氧化及抗氧化因子表达异常[2],细胞氧化和抗氧化状态失衡,产生过多活性氧族(又称氧自由基,reactive oxygen species,ROS),進而增加了白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、细胞间黏附分子-I(ICAM-I)、血管细胞黏附分子-I(VCAM-I)等的表达,使细胞长期处于炎症状态,加重皮肤炎性反应,最终造成皮损难于修复[3]。
前期研究证实,天然药物 Ginsenoside Rg3,能促进DM大鼠难愈创面模型的皮损修复且愈合良好,有效缩短愈合时间、提高创面愈合率[4],作用机理有待深入探索。本研究拟在前期药效基础上研究Ginsenoside Rg3对DM皮肤损伤大鼠“微环境污染”(皮肤组织糖含量及AGEs表达)及相关氧化应激反应的影响,为该物质修复DM难愈创面的药物深入研发奠定理论基础。
1 材料
1.1 动物 SPF级雄性SD大鼠,体重200±20 g,动物生产许可证号:SCXK(辽)2015-001,动物合格证号:50218400001739,购自辽宁长生生物技术股份有限公司。
1.2 药物及试剂 Ginsenoside Rg3(中国科学院昆明植物研究所植物化学研究室提供),氨基胍(aminoguanidirig,AG,昆明市泉港生物科技有限公司),链脲佐菌素(streptozocin,STZ,美国Sigma公司),0.1 mol/L柠檬酸钠缓冲液(Solarbio,产品批号:20180712),戊巴比妥钠(产品批号:20180329),磷酸盐缓冲液(Phosphate Buffer Solution,PBS),DAPI(4,6-diamino-2-2phenylindole),抗荧光淬灭封片液,柠檬酸盐缓冲液,石蜡,胎牛血清(Fetal bovine serum,FBS),抗体稀释液(0.1%TWeen-20,5%的BSA加入10 mL TBS中),封闭液(0.1%TWeen-20,5%的脱脂奶粉溶于10 mL TBS中),抗原修复液(索莱宝公司的柠檬酸盐粉末加蒸馏水至2 L),异硫氰酸荧光素(flourescein isothiocyanate,FITC),AGEs,抗兔源alexa fluo 488二抗。
2 方法
2.1 建立动物模型[5]及实验分组 DM模型:高脂饲料喂养4周,大鼠禁食不禁水14 h后腹腔注射STZ 35 mg/kg。正常对照组腹腔注射等体积的0.1mol/L柠檬酸钠缓冲液。于STZ注射后3天、7天测定空腹血糖(FBG),三次FBG≧16.7 mmol/L并伴随出现三高一少症状为造模成功。将DM大鼠随机分为4组:模型组、阳性药组、Rg3高、低剂量组,另设正常组。Rg3组分别灌胃Rg3 15、5 mg/kg,阳性药组灌胃AG10 mg/kg,模型组、正常组给予等剂量生理盐水,每天1次。(AG为目前已经最多的AGEs抑制剂,故选为实验用阳性对照药。)
皮肤损伤模型:给药4周后,各组动物以戊巴比妥钠(50 mg/kg)腹腔注射麻醉后,背部剃毛,常规消毒,用自制的无菌的2×2 cm2圆形硬纸片在脱去毛的皮肤上作好标记,碘伏消毒,无菌剪刀在背部标记处全层皮肤切除,勿伤及皮下的筋膜,如有出血,用无菌棉签轻轻压迫止血,单层生理盐水纱布湿敷,外加盖两层消毒干纱布,胶布“丰”字型固定。手术前1天起,每只大鼠连续4d肌肉注射青霉素(4000 U/只),预防感染。待大鼠麻醉清醒后单笼喂养,自由进水饮食。后续各实验组继续给药直至取材。
2.2 检测指标及方法
2.2.1 标本采集 伤后21 d,每组大鼠断颈处死,取新鲜创缘皮肤组织,部分自动生化分析仪检测皮肤组织糖含量;部分4%多聚甲醛固定后制成石蜡块保存,切片和贴片后免疫荧光染色法檢测AGEs表达;肝素抗凝全血收集血浆,用于测定相关氧化应激反应指标(H2O2、MDA、GSH)。
2.2.2 皮肤组织糖含量 取冻存皮肤组织块,称质量(约0.2 g),冰浴下剪碎,加入预冷的0.24 mol/L Ba(OH)2的溶液1.5 mL,匀浆,离心半径14 cm,3000 r/min,离心10 min,上清液计量后,Beckman's生化自动分析仪检测糖浓度。按照下列公式计算皮肤糖含量:每克皮肤糖含量(mg/g皮肤)=[上清液体积(mL)×糖浓度(mmol/L)×180]÷皮肤组织块湿量(g)×10-3。
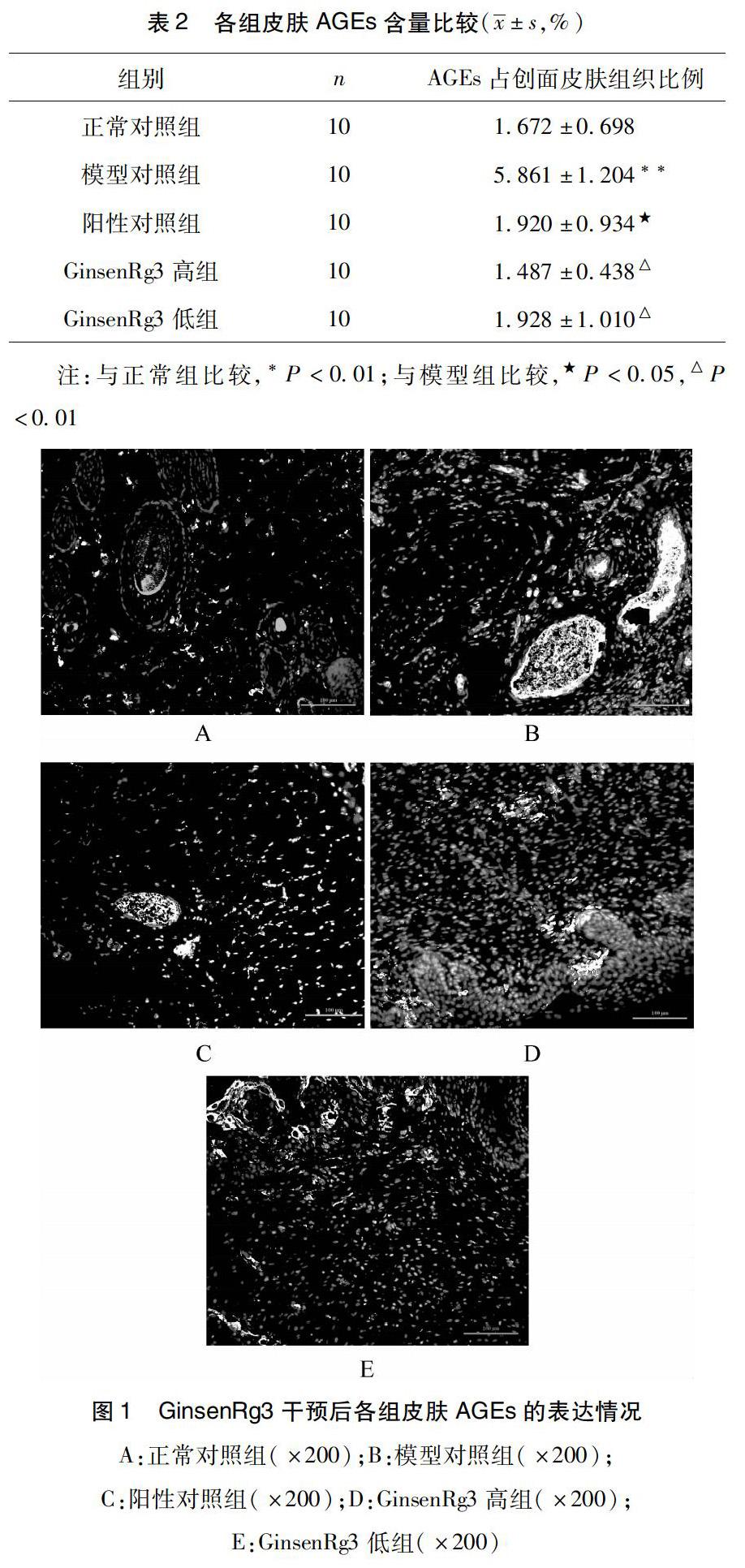
2.2.3 AGEs表达检测 包埋好的石蜡块进行切片和贴片处理后再免疫荧光染色。先用已知未标记的特异抗体(第一抗体)与抗原标本进行反应,用水洗去未反应的抗体,再用标记的抗抗体(第二抗体)与抗原标本反应,使之形成抗原—抗体—抗体复合物,再用水洗去未反应的标记抗体,干燥、封片后镜检。对应AGEs的二抗用异硫氰酸荧光素FITC标记。用荧光显微镜激发后显示绿色。从而确定抗原或抗体的性质、定位,以及利用定量技术测定含量,最终用于观察AGEs在皮肤中的表达情况。
2.2.4 氧化应激反应指标检测 H2O2、MDA、GSH分别用南京建成公司提供的H2O2分光光度法试剂盒、MDA TBA法试剂盒、还原型GSH微量酶标法试剂盒进行检测,具体操作参照说明书进行。
2.2.5 统计分析 采用SPSS 19.0统计软件,对数据进行统计分析。结果以表示,单因素方差分析、t检验比较各组间差异。
3 结果
3.1 大鼠皮肤组织糖含量 与正常组比较,模型组中皮肤糖含量显著升高,且与血糖水平呈正相关(r=0.57,P<0.01)。阳性组与模型组比较,含糖量无显著变化(P>0.05)。GinsenRg3高、低剂组与模型组比较,糖含量均无显著变化(P>0.05)。见表1。
3.2 对大鼠皮肤组织AGEs表达的影响 通过免疫荧光染色及定量技术测定含量可知,与正常组比较,模型组AGEs表达量明显升高(P<0.01);与模型对照组比较,阳性组可抑制AGEs的形成(P<0.05),GinsenRg3高、低剂组AGEs在皮肤中的表达量则显著减少,(P<0.01)。见表2和图1。
3.3 氧化应激反应指标的检测 模型组血浆H2O2、MDA含量较正常组显著上升(P<0.05 or P<0.05);与模型组比较,经阳性药及GinsenRg3干预后,H2O2、MDA均下降(P<0.05 or P<0.05)。
模型组血浆GSH含量较正常组显著下降(P<0.01);与模型组比较,阳性组及GinsenRg3高、低剂量组则明显上升(P<0.05)。见表3。
4 讨论
DM皮肤创面难愈发病率高、病程长、病情复杂且易反复、治疗方法局限和相关预后较差。创面愈合是一个复杂、精密而有序的过程,DM伤口以创伤愈合过程的紊乱为特征[6]。皮肤局部糖含量增高及AGEs蓄积,作为DM代谢重构的直接产物,是皮肤细胞、细胞外基质、生长因子改变而发生相应“隐形损害”的重要环境介质,通过改变皮肤微环境,始动性地介导了DM皮肤发生一系列以组织学、细胞功能学改变为特征的“隐形损害”。有关学者把DM代谢紊乱所致皮肤组织中含糖量增高和AGEs蓄积引发的皮肤微环境改变,称之为“微环境污染”。AGEs蓄积有关的许多生物途径能导致氧化应激的发生,故存在H2O2、GSH、MDA等氧化及抗氧化因子异常表达[7],而后者以及由此产生的细胞毒性作用直接参与了DM创面难愈的发生。
本研究中,经GinsenRg3干预后,皮肤组织糖含量与模型组比较,差异无显著性意义,表明药物干预后未能降低DM皮肤组织糖含量,提示GinsenRg3组可能不是通过影响糖代谢促进DM创面愈合的。AGEs在皮肤中的表达明显的减少,有利于创面的修复,表明GinsenRg3对以糖尿病性皮肤组织中AGEs沉积为特征的“微环境污染”所介导的创面难愈有改善作用,为其重要作用机理之一。
另外,模型组血浆H2O2、MDA含量较正常组显著上升,而GSH水平明显下降,表明DM性皮损中存在氧化应激反应增强现象,是导致最终创面难愈重要因素。GinsenRg3高、低剂量组,较模型组H2O2、MDA降低,GSH则升高。表明GinsenRg3可改善由AGEs沉积所致的氧化应激状态,调节皮肤组织氧化与抗氧化平衡,为其修复DM难愈创面作用机理之一。
综上所述,实验结果证实GinsenRg3可能通过抑制DM创面皮肤组织中的AGEs沉积,调节过度的氧化应激反应,促进DM大鼠创面愈合,与前期药效研究结果一致,部分证实了该药物在修复DM皮肤损伤方面的作用机理。
参考文献:
[1]Takahashi PY,Kiemele LJ,Chandra A,et al.A retrospective cohort study of factors that affect healing in long-term care residents with chronic wounds.Ostomy Wound Manage,2011,55(1):32-37.
[2]S.Y.Goh,M.E.Cooper,Clinical review:The role of advanced glycation end products in progression and complication of diabetes[J].Clin Endocrinol Metab,2008,(93):1143-1152.
[3]Ferdinando G,Michael B.Oxidative stress and diabetic complications[J].Circ Res,2010,(107):1058-1062.
[4]李靜平,郑永仁,张燕.人参皂苷Rg3对糖尿病大鼠创面修复作用的实验研究.云南中医中药杂志[J].2016,37(1):25-28.
[5]Zhang Y,Xing W,Huang H.Establisment of a non-contractile refractory wound model in type 2 diabetic rats[J].Chin J Tissue Eng Res,2012,16(24):4432-4436.
[6]Breitbart AS,Laster J,Parrett B,et al.Acceler-ated diabetic wound healing using cultured dermal fibroblasts retro-vivally transduced with the platelet-derived growth factor B gene[J].Plastic Surgery,2013,54(4):409-414.
[7]Drge W.Free radicals in the physiological control of cell function[J].PhysiolRev,2012,82(1):47-95.
(收稿日期:2019-09-16)
