雷帕霉素诱导自噬对结肠癌HT29细胞迁移的影响及其分子机制
2019-01-10贾艳梅陈利荣李元宏郭松佳
贾艳梅,陈利荣#,李元宏,郭松佳
(1山西医科大学汾阳学院医学检验系,汾阳 032200;2山西省人民医院肾脏病分子诊断与治疗实验室;#共同第一作者;*通讯作者,E-mail:jym928@163.com)
结肠癌(colorectal cancer,CRC)是世界范围内最常见的肿瘤疾病[1,2]。目前,肿瘤细胞的扩散转移仍然是癌症患者的发病率和死亡率居高不下的主要原因[3,4]。因此,了解肿瘤细胞转移的机制有助于结肠癌的有效治疗。
肿瘤转移是恶性肿瘤的基本生物学特征,是绝大多数肿瘤患者的致死因素。肿瘤细胞的转移由一系列复杂而连续的步骤所组成,其中迁移是肿瘤转移的重要环节,肿瘤细胞在体内或体外的迁移能力与其转移潜能呈正相关性,因此通过抑制肿瘤细胞的迁移能够有效地控制肿瘤的转移。肿瘤细胞通过去分化由多边形上皮样形态转变为梭形间叶性细胞形态,称为上皮间充质转化(epithelial mesenchymal transition,EMT),使得肿瘤细胞更具运动能力,促进了肿瘤细胞的迁移。E-cadherin的表达下降,同时N-cadherin表达上升,是肿瘤细胞EMT发生的标志[5,6],一些转录因子,如Snail-1,Snail-2和LEF-1等能够抑制E-cadherin并促进N-cadherin的表达[7-9]。
自噬(autophagy)是指细胞自身从粗面内质网的无核糖体附着区脱落的双层膜包裹部分胞质和细胞内需降解的细胞器、蛋白质等成分形成自噬体(autophagosome),并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,以实现细胞本身的代谢需要和某些细胞器的更新。微管相关蛋白3(LC3)是自噬标志物,自噬形成时,胞浆型LC3(LC3-Ⅰ)会被酶降解掉一小段多肽,转变为膜型(即LC3-Ⅱ),LC3-Ⅱ被认为是自噬过程的特征蛋白[10,26],LC3-Ⅱ/LC3-Ⅰ的比值与自噬体的数量成正相关[11]。泛素结合蛋白P62(也称为SQSTM1蛋白)偶联于LC3,作为一种调节因子参与自噬体的构成,细胞内整体p62水平的表达与自噬活性呈负相关性[12]。有研究表明,自噬在肿瘤细胞迁移过程中具有双向作用[13,14],哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是自噬发生重要的信号传导分子,其介导的信号转导通路异常与多种肿瘤的发生有关,已成为肿瘤治疗的新靶点[15,16,24]。mTOR对细胞自噬起负向调控作用[17],有研究显示,mTOR的特异性抑制剂雷帕霉素(rapamycin,RAPA)可能通过激活自噬来达到抗肿瘤作用[18]。本研究利用RAPA作用于人结肠癌HT29细胞,观察其诱导的自噬对肿瘤细胞迁移的影响并探讨可能的机制。
1 材料与方法
1.1 主要试剂
RPMI-1640培养液购买自杭州吉诺生物医药技术有限公司,胎牛血清(foetal bovine serum,FBS)购买自Invitrogen(Carlsbad,CA);胰蛋白酶购买自中生华美北京科技有限公司;青链霉素购买自武汉博士德公司;Rapamycin,P62,氯喹(chloroquine,CQ)购买自上海碧云天生物技术研究所;RNAiso Plus,PrimeScript RT MasterMix and SYBR Green PCR Master Mix购买自Takara(Shiga,Japan);E-cadherin抗体购买自Sino Biological, Inc.(Beijing,China);N-cadherin抗体购买自Bioworld Technology(Minneapolis,MN);Snail-1抗体购自武汉三鹰;LC3抗体购买自美国Sigma公司;GAPDH抗体购买自Abmart(Shanghai,China);HRP标记的二抗购买自Invitrogen(Carlsbad,CA),fluorescence-conjugated secondary antibody(Sigma-Aldrich,St. Louis,MO,USA)。
1.2 细胞培养
人结肠癌细胞株HT29为山西医科大学汾阳学院学院科技中心保存,常规培养于含有100 U/ml青霉素、100 μg/ml链霉素和10%胎牛血清的RPMI-1640培养液中,置于37 ℃、5% CO2及95%湿度的细胞培养箱中培养。根据实验需要将HT29细胞分为实验组(50nmol/LRAPA处理24 h)和对照组。
1.3 免疫荧光染色检测细胞自噬
对照组和实验组细胞分别用甲醇于4 ℃固定60 min。PBS清洗2次,载玻片用0.2% Triton X-100浸泡5 min,LC3抗体于4 ℃过夜孵育。PBS清洗2次,细胞用绿色荧光标记的二抗室温下孵育90 min。PBS清洗两次,4 ℃,DAPI避光染色1 h。PBS清洗去除DAPI,免疫荧光显微镜观察细胞核及LC3-labeled自噬小体。计数每组含有自噬小体的平均数,每个样本计数100个细胞,实验重复3次。
1.4 划痕实验检测细胞迁移
将HT-29细胞接种于24孔板,直至长成单层细胞。用无菌枪头在单层细胞中央划一直线,PBS清洗2次,倒置显微镜照相。用无血清的RPMI-1640孵育对照组细胞,实验组细胞添加RAPA,使其终浓度为50 nmol/L,RAPA处理24 h后照相。同时设立RAPA和自噬抑制剂氯奎(CQ)联合处理组(50 nmol/L RAPA,5 nmol/L CQ共同处理24 h)。实验重复三次,计算划痕愈合率,公式为划痕愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度。
1.5 Quantitative real-time PCR检测迁移相关分子mRNA的表达
Trizol法提取实验组与对照组细胞总RNA。将500 ng RNA用PrimeScript RT Master Mix反转录成cDNA。用2×SYBR Green PCR Master Mix进行quantitative real-time PCR(qPCR),qPCR的条件为:95 ℃,30 s;95 ℃,5 s;64 ℃,34 s,40 cycles。反应结束后,确认扩增曲线和溶解曲线。GAPDH作为内参基因,GAPDH和目标基因Ct值的不同作为每个样品相对表达分析的基础,相对基因表达数据用ΔΔCt方法分析处理。RT-PCR引物为见表1。
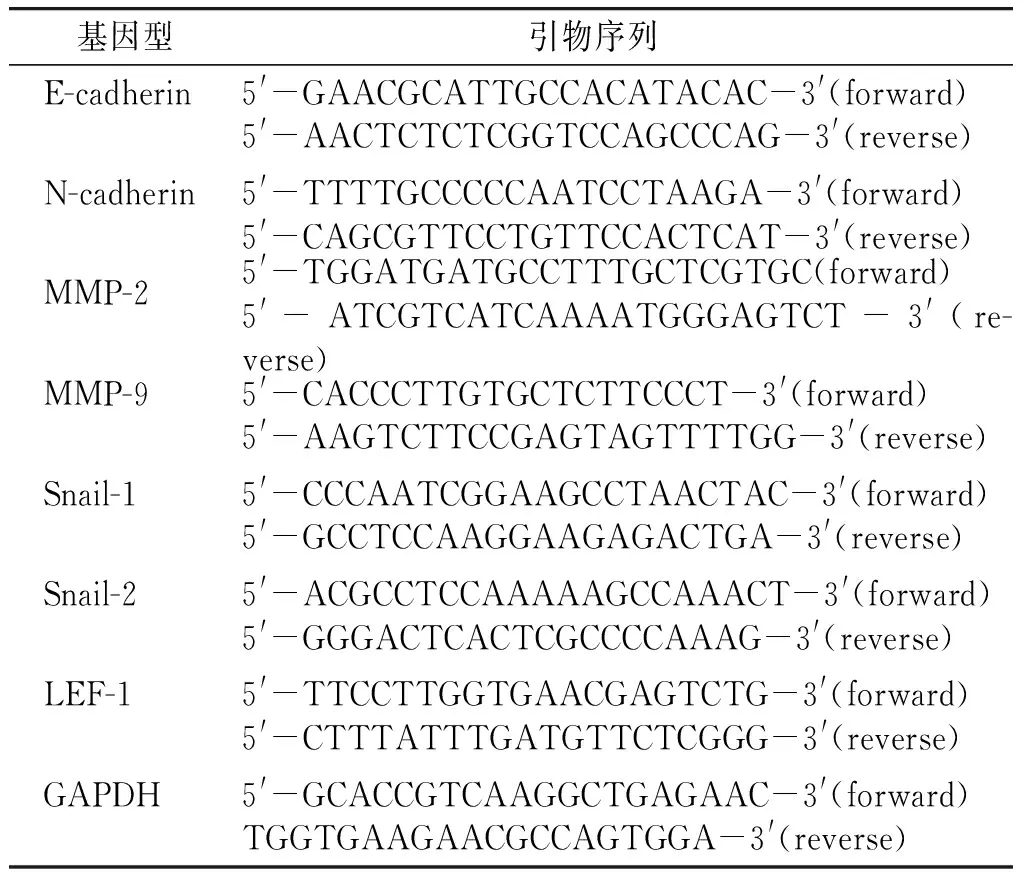
表1 RT-PCR引物Table 1 RT-PCR primer sequences
1.6 Western blot检测分析自噬蛋白表达情况
用0.25%胰蛋白酶消化收集对照组和实验组的HT29细胞,加裂解液提取蛋白,经BCA法蛋白定量后,将样品和5×loading buffer沸水浴5 min使蛋白变性,进行10% SDS-PAGE中凝胶电泳,每孔蛋白上样量保持一致。取适量样本进行SDS-PAGE电泳分离,然后将蛋白转移至PVDF膜。5%脱脂奶粉封闭1 h,分别加入p62抗体(1 ∶1 000)、LC3抗体(1 ∶1 000)、E-cadherin(1 ∶1 000)抗体、N-cadherin抗体(1 ∶1 000)、Snail-1(1 ∶1 000)和GAPDH抗体(1 ∶1 000),4 ℃孵育过夜。加入辣根过氧化物酶标记的二抗(1 ∶1 000),室温孵育2 h,进行化学发光液显像。Image J软件进行蛋白质灰度分析。
1.7 统计学分析
2 结果
2.1 免疫荧光分析HT29细胞自噬发生结果
经RAPA处理后,用带有绿色荧光的LC3标记自噬小体来检测HT29细胞自噬发生的情况见图1,与对照组相比,RAPA组细胞内LC3荧光斑点(绿色)的数量显著增加。镜下计数每个细胞所含的自噬小体数,每组随机选择100个细胞,计算平均值,实验重复三次。每个细胞平均含有的自噬小体数分别为:对照组(9.0±0.5)个和RAPA组(21.2±0.2)个,差异具有统计学意义。

A.免疫荧光显微镜下观察自噬小体的形成B.镜下计数每个细胞所含的自噬小体数
2.2 RAPA诱导自噬与HT29细胞迁移能力的关系
本组结果显示,RAPA处理24 h时细胞发生显著自噬,因此我们选取RAPA处理24 h组为研究对象。RAPA实验组、RAPA和CQ联合处理组处理24 h,划痕实验结果显示,经RAPA处理的HT29细胞培养24 h后,与空白对照组及联合处理组相比,RAPA组向划痕处迁移程度最小,划痕距离最宽,且迁移速度显著慢于空白对照组(P<0.01,见图2)。本组实验结果显示,RAPA诱导自噬可抑制HT29细胞的迁移能力。
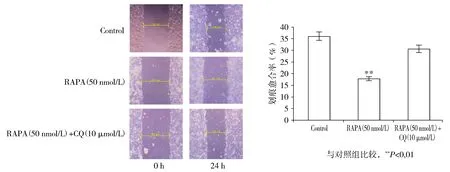
A.划痕实验观察细胞迁移情况 B.各组细胞的划痕愈合率比较
2.3 qPCR检测细胞自噬抑制迁移的相关mRNA表达结果
qPCR结果显示,Snail-1 mRNA表达水平下降(P<0.01),而Snail-2和LEF-1无显著变化,同时E-cadherin mRNA表达水平升高,N-cadherin mRNA表达水平降低(见图3A,P<0.01),Western blotting结果与之相符(见图3B)。结果表明,RAPA诱导的自噬可能是通过下调转录因子Snail-1,进而促进E-cadherin和抑制了N-cadherin的表达,最终通过抑制EMT效应而抑制了HT29细胞的迁移。
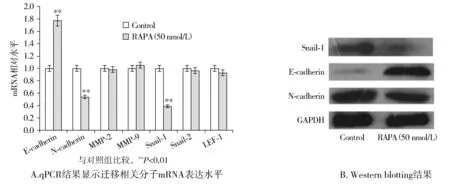
图3 RAPA诱导的自噬对HT29细胞迁移相关分子表达的影响Figure 3 Effect of RAPA-induced autophagy on related mRNA and protein levels of HT29 cell migration
2.4 自噬蛋白表达Western blot结果
灰度扫描分析结果显示,RAPA处理24 h后的实验组LC3-Ⅱ/LC3-Ⅰ比值显著上调,显著高于对照组(见图4),实验重复三次,处理组与对照组差异极显著。P62/sequestosome 1(SQSTM1)通常与自噬的发生相反,检测结果显示,经RAPA处理24 h后,P62降低(见图4)。这些结果证实自噬在HT29细胞被RAPA激活。

图4 RAPA处理后LC3和P62蛋白的表达Figure 4 Expression of LC3 and P62 in HT29 cells after RAPA treatment
3 讨论
自噬是细胞通过自身的膜结构降解胞质细胞器和大分子,这是在营养缺乏时观察到的一个动态过程。近来,肿瘤学家们对自噬有了新的兴趣,因为不同类型的癌细胞进行各种抗癌疗法后都发生了自噬。自噬在肿瘤细胞中导致死亡或保护细胞的研究是有争议的,在多个研究中[18,19,25],从药理学或基因角度抑制自噬,产生了相反的结果—肿瘤细胞生存或者死亡,其结果取决于具体情况。与此同时,有研究报道,肿瘤细胞自噬的发生影响其迁移能力,正性或者是负性的影响也同样存在争议[20]。
自噬受到多种信号通路调控,其中雷帕霉素哺乳动物靶蛋白(mTOR)是较为重要的一条的信号通路[21]。mTOR分子与细胞增殖[16,22]、凋亡等密切相关。因此我们利用mTOR的特异性抑制剂RAPA诱导结肠癌细胞HT29发生自噬,通过免疫荧光观察到了自噬体的形成,并运用Western blotting检测到自噬蛋白LC3Ⅱ和P62发生了相应的变化,表明RAPA诱导HT29细胞发生了自噬。
自噬能够影响细胞的迁移能力。本研究观察了经RAPA诱导自噬后结肠癌HT29细胞迁移能力的改变,结果显示RAPA诱导的自噬导致HT29细胞迁移能力与对照组及RAPA和CQ联合处理组显著降低,提示HT29细胞可能通过自噬抑制了细胞迁移的能力。由此推测,能够诱导该细胞发生自噬的药物能够抑制该细胞的转移。
在恶性肿瘤的进展过程中,E-cadherin的表达经常发生下调,同时N-cadherin上调,使得肿瘤细胞发生EMT,获得成纤维细胞的表型,运动能力增强,有利于其发生转移[23]。本研究利用qPCR和Western blotting技术检测了经RAPA处理后HT29细胞E-cadherin和N-cadherin的表达变化,结果显示E-cadherin的表达上升,而N-cadherin的表达下降,表明RAPA诱导的自噬抑制了HT29细胞的EMT过程,从而抑制了其迁移的能力。本研究利用qPCR技术检测了能够调节E-cadherin变化的转录因子在mRNA水平的变化,结果显示Snail-1的表达量下降,随后用Western blotting检测了其蛋白水平的表达,结果与之一致,表明RAPA诱导的自噬通过下调Snail-1的表达而减少了Snail-1对E-cadherin的抑制以及对N-cadherin的诱导效果,从而减弱了HT29细胞的迁移能力。
综上所述,本研究利用RAPA诱导HT29细胞发生自噬后,细胞迁移能力减弱,表明在结直癌HT29细胞中,诱导产生自噬能够有效地抑制其发生转移,为结肠癌新的有效治疗方案提供了理论依据。
