低温共熔溶剂[ChCl][Urea]n的合成及其性能研究实验
2019-01-09于凤丽高洪萍朱国强解从霞
于凤丽, 高洪萍, 朱国强, 解从霞
(青岛科技大学 化学与分子工程学院, 山东 青岛 266042)
中国已进入中国特色社会主义新时代,正处于“由中国制造向中国创造的加快转变、全面实施新旧动能转换重大工程”的关键时期,亟须高等教育为国家提供高层次人才支撑和智力支持,即国家亟需高校培养高素质技能型、创新型人才。开设研究型综合性实验是培养高素质技能型、创新型人才的有效途径。本文继研发研究型综合实验“离子液体催化环己酮Baeyer-Villiger氧化合成ε-己内酯研究型综合化学实验”之后[1],结合近年科研成果,又提炼出一个新的研究型综合实验——“低温共熔溶剂[ChCl][Urea]n的合成及其性能研究实验”。该实验有利于学生创新意识的培养和综合能力的提高。
1 实验原理
2003年,Abbot等[2]首次发现了由季铵盐酰胺化合物形成的一种在室温下呈液态的低温共熔溶剂(Deep Eutectic Solvent,简称DES)。DES一经发现就因其是一种环境友好的绿色溶剂备受关注[3]。
DES一般由氢键供体(HBD)和氢键受体(HBA)2部分组成。氢键供体通常包括多元醇、羧酸、酰胺等,氢键受体通常包括季铵盐、胺等。氢键供体和氢键受体通常没有明显的界限,在特殊情况下,氢键供体可以是氢键受体,氢键受体也可以是氢键供体。DES又称为离子液体类似物[4-5],具有蒸汽压低、电导率高、热稳定性好、结构可设计等特点,同时兼具合成步骤简单、制备反应为原子经济性反应、无需纯化等优点[6],即DES符合绿色化学的发展理念。因此,DES在有机合成、电化学、生物化学、监测检测分析、功能材料等领域得到广泛应用[4]。随着对DES研究的不断深入,HBA和HBD的种类得到不断的扩展,必将开发出更多新型的DES,具有十分广阔的应用和发展前景。
DES分子中通常存在HBD和HBA之间的氢键和分子间的范德华力作用[7]。DES的凝固点、黏度等物性通常由氢键和范德华力决定,不仅与其组成(HBA与HBD的种类及摩尔比)、温度密切相关,而且还因是否含有水分有所不同。由于DES分子中存在HBD和HBA的氢键,因而DES分子通常以缔合的形式存在,进而使得形成DES熔点(凝固点)低于每个单独组分。DES的凝固点大多在-38~150 ℃之间[3],通常在100 ℃以下呈液态。DES的黏度大多在10~5 000厘泊(pa•s)之间,并且DES的黏度随着温度变化满足式(1)规律[8],即随着温度的升高,DES的黏度逐渐降低。
(1)
揭示DES组成与理化性能的相关性及其变化规律,进而指导设计合成特定功能的DES,对拓展DES的应用具有重要意义。
氯化胆碱(ChCl)又称氯化2-羟乙基三甲铵,化学式为:HOCH2CH2N(CH3)3Cl。用于治疗脂肪肝和肝硬化,也作为禽畜饲料添加剂。《2017年版全球及中国氯化胆碱行业深度调研及发展趋势分析报告》认为,国产氯化胆碱占据超过50%的全球市场份额,近年来随着多套新的氯化胆碱装置的建成投产,国内氯化胆碱市场更是呈现显著供大于求的市场格局。尿素(Urea)又称碳酰胺,化学式为CH4N2O,是目前含氮量最高的氮肥。全球尿素产能在 2015—2017年达到阶段性峰值,2016年全球尿素总产能基本与上年持平,在2.2亿t左右。《2018—2024年中国尿素行业市场分析预测及投资战略研究报告》分析,2016年我国全年出口尿素量为886万t。氯化胆碱和尿素来源丰富、价格便宜。研究表明,氯化胆碱和尿素形成的DES([ChCl][Urea]2)在摩擦领域和捕集CO2等应用中已展示出良好的性能,[ChCl][Urea]2的应用将为氯化胆碱和尿素开辟一条新的应用途径。
氯化胆碱与尿素反应生成DES([ChCl][Urea]n)的反应式可以用式(2)表示[9]。
[HOC2H4N(CH3)3]+[Cl]-+n[NH2CONH2]→
[HOC2H4N(CH3)3]++ [NH2CONH2]n[Cl]-
(2)
氯化胆碱与尿素形成DES([ChCl][Urea]n)是由于分子中存在氢键[2]。[ChCl][Urea]n分子的结构和物理性质因n(ChCl)/n(Urea)的不同而不同。当n(ChCl)/n(Urea)为1∶2.0时,氯化胆碱分子中的Cl-与尿素分子通过氢键作用形成整体阴离子,减弱了Cl-与氯化胆碱中阳离子Ch+的作用,破坏了氯化胆碱分子中阴、阳离子交替存在的有序结构,致使形成DES凝固点较低,黏度高于一般的有机溶剂。氯化胆碱与尿素反应生成的[ChCl][Urea]2的结构式和结构如图1和图2所示[10-12]。

图1 [ChCl][Urea]2的结构式

图2 [ChCl][Urea]2的结构示意图
氯化胆碱与尿素形成的DES([ChCl][Urea]n)的结构、物性与n(ChCl)/n(Urea)的关系很大,因此,揭示[ChCl][Urea]n组成与理化性能的相关性及其变化规律,进而指导设计合成特定功能的[ChCl][Urea]n,对拓展氯化胆碱与尿素以及由它们合成的DES的应用具有重要意义。
2 实验试剂与仪器
试剂:氯化胆碱(阿拉丁,98%),尿素(麦克林,99%)。
仪器:100 mL三口烧瓶,EL104电子天平,DF-101S集热式恒温加热锅,JJ-1A数显精密增力电动搅拌器,Brucker AV500核磁共振波谱仪(500 MHz,DMSO),Nicolet 510P红外光谱仪(KBr,400~4 000 cm-1),DVS数显黏度计。
3 实验内容
3.1 [ChCl][Urea]n的合成
将氯化胆碱和尿素按一定摩尔比加入装有机械搅拌和温度计的100 mL三口圆底烧瓶中,90 ℃油浴加热(反应温度不低于80 ℃),并以800 r/min的转速机械搅拌60 min,白色的固体逐渐溶解,得到相应的低温共熔溶剂[ChCl][Urea]n[8]。
3.2 [ChCl][Urea]n黏度的测定
用量筒量取15~20 mL待测DES,倾入样品池中。选择合适的转子(1号),并将其旋入连接螺杆。安装样品池,将转子逐渐浸入被测液体中,直至所测液体的液面没过转子为止。开机测定并保持扭矩百分比读数为50%左右,待示数稳定后记录。平行测定3次取其平均值[13]。
4 结果与讨论
4.1 [ChCl][Urea]n的合成
按不同n(ChCl)/n(Urea)合成DES,其结果如表1所示。
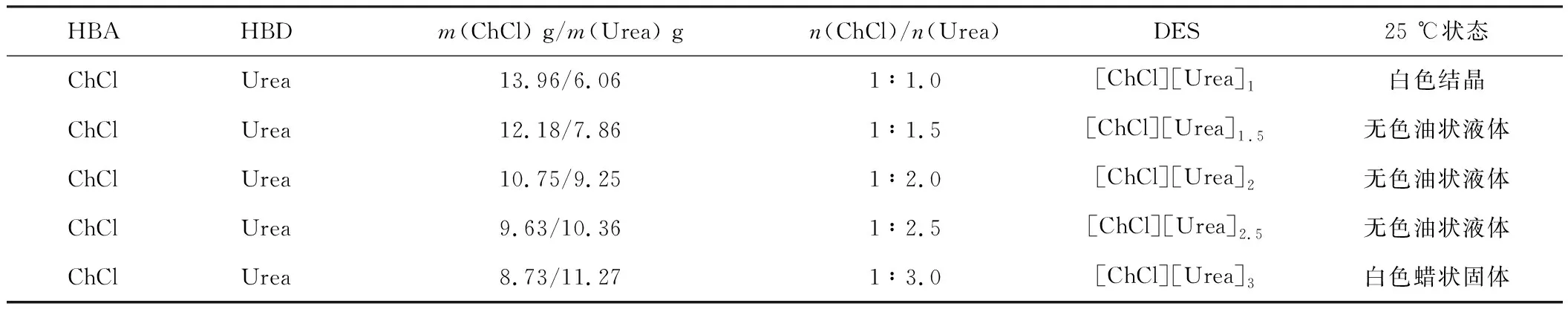
表1 不同的n(ChCl)/n(Urea)合成DES结果
从表1可以看出,当n(ChCl)/n(Urea)为1∶1.5~1∶2.5时,得到无色油状液体(25 ℃);当n(ChCl)/n(Urea)为1∶3.0时,得到蜡状白色固体(25 ℃),该白色固体在40 ℃以上呈无色油状液体。说明当n(ChCl)/n(Urea)为1∶1.5~1∶3.0时,均能形成稳定的DES([ChCl][Urea]1.5~3.0)。随着尿素摩尔量的增加,[ChCl][Urea]1.5~3.0的凝固点先降低后升高,当n(ChCl)/n(Urea)为1∶2.0时最低(12 ℃)[3]。所形成的[ChCl][Urea]1.5~3.0凝固点均低于其组分的凝固点(Tm,ChCl=302 ℃,Urea=133 ℃),其凝固点降低是由于氯化胆碱中的Cl-与尿素分子形成了分子间氢键进而削弱了Cl-与Ch+之间的作用的结果。当n(ChCl)/n(Urea)在1∶1.5~1∶2.0时,随着尿素含量的增加,氯化胆碱中的Cl-与尿素分子形成的分子间氢键逐渐增强,而Cl-与Ch+之间的作用逐渐减弱,当n(ChCl)/n(Urea)为1∶2.0时,Cl-与Ch+之间的作用最弱,尿素自身包括氢键的分子间作用最弱,而氯化胆碱与尿素分子间氢键作用最强,所以,[ChCl][Urea]2的凝固点最低(如图2所示)。当n(ChCl)/n(Urea)为1∶2.0~1∶3.0时,随着尿素摩尔量的增加,尿素自身包括氢键的分子间作用增强,Cl-与尿素的氢键作用逐渐减弱,Cl-与Ch+之间的作用逐渐增强,凝固点逐渐升高,致使[ChCl][Urea]3室温呈固态。而当n(ChCl)/n(Urea)为1.0时,氯化胆碱中的Cl-与尿素分子所形成的氢键较少,尚未达到氯化胆碱的氢键饱和度(氯化胆碱的氢键受体数为2),对氯化胆碱中Cl-与Ch+作用的减弱较小,不足以破坏氯化胆碱中阴、阳离子交替存在的有序结构,即不能形成均匀、稳定的DES。
4.2 [ChCl][Urea]1.5~3.0的FT-IR表征
尿素、氯化胆碱及[ChCl][Urea]1.5~3.0的FT-IR谱图如图3所示。
由图3(a)可知,在尿素FT-IR谱图中,3 440 cm-1和3 344 cm-1是尿素-NH2的伸缩振动峰,由于尿素分子中存在较强的分子间氢键,因此3 701~3 031 cm-1出现了一个很宽的吸收峰。在[ChCl][Urea]2的FT-IR谱图中,3 693~2 579 cm-1存在较宽的吸收峰,与尿素相比向低波数移动,其峰形变钝,说明尿素和氯化胆碱分子间形成了氢键。由图3(b)可知,[ChCl][Urea]1.5、[ChCl][Urea]2.5、[ChCl][Urea]3的谱图如同[ChCl][Urea]2谱图一样,在3 693~2 579 cm-1同样出现了-NH2的峰形变钝的吸收峰,说明均形成了较强的分子键氢键,即均形成了DES[11-15]。
4.3 [ChCl][Urea]1.50~1.30的1H-NMR表征
尿素、氯化胆碱及[ChCl][Urea]1.5~3.0的1H-NMR谱图如图4所示。由图4可知,当形成[ChCl][Urea]1.5~3.0后,尿素分子中-NH的化学位移由5.48向低场移动(依次为5.53、5.60、5.61、5.59)。这是由于ChCl中的Cl-与尿素分子形成分子间氢键所致。

图3 Urea、ChCl及[ChCl][Urea]2的FT-IR谱图和Urea及[ChCl][Urea]1.5~3.0的FT-IR谱图

图4 ChCl、Urea及[ChCl][Urea]1.5~3.0的1H-NMR谱图
分子间氢键使尿素氢上的电子云密度降低,从而使其共振信号峰向低场移动,化学位移值增加。增加的趋势先增大后减小,说明分子间氢键的作用先增强后减弱。氯化胆碱中与N相连的-CH3化学位移当形成[ChCl][Urea]1.5~3.0后,由3.15向高场移动(依次为3.13、3.13、3.13、3.13、3.12),这也是由于ChCl中的Cl-与尿素分子形成分子间氢键所致。分子间氢键的形成减弱了氯化胆碱中Cl-与Ch+之间的作用,从而使与N相连的-CH3上的电子云密度增加,氢原子的共振信号峰向高场移动,化学位移值减小。当形成[ChCl][Urea]3时,分子间氢键的作用减弱,因此-CH3上氢原子的化学位移值减小的趋势减弱[16-17]。通过1H-NMR分析可知,分子间氢键是[ChCl][Urea]1.5~3.0形成的主要驱动力之一。
4.4 黏度的测定结果
由于在[ChCl][Urea]1.5~3.0中存在大量的氢键网络结构[10],使其黏度均比一般的有机溶剂大。[ChCl][Urea]1.5~3.0组成对其黏度的影响及其黏度随温度变化如图5所示。
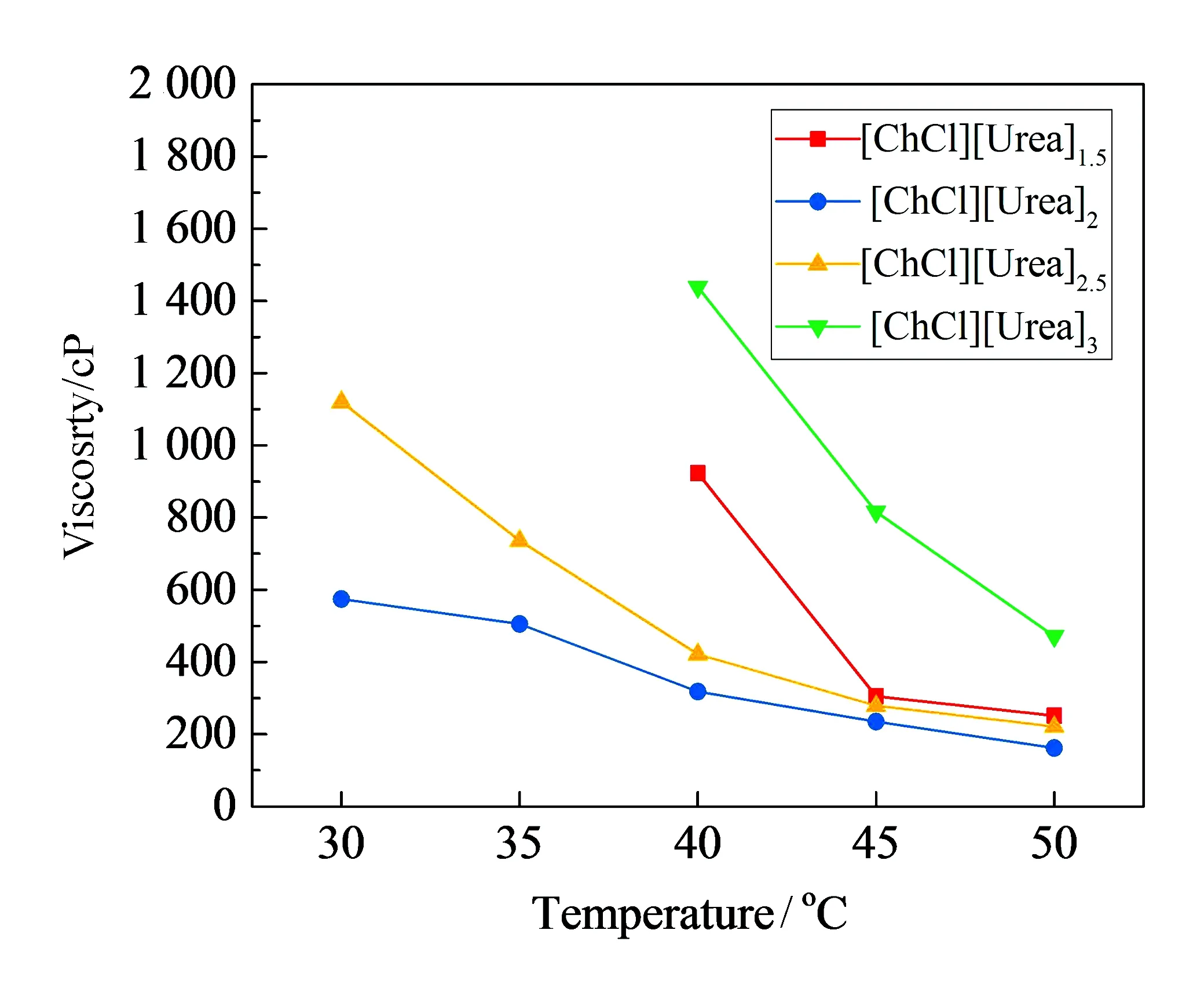
图5 [ChCl][Urea]1.5~3.0的黏度随温度的变化
由图5可知,[ChCl][Urea]1.5~3.0的黏度与其组成密切相关。随着尿素摩尔量的增加,[ChCl][Urea]1.5~3.0的黏度先逐渐降低后逐渐升高,当n(ChCl)/n(Urea)为1∶2.0时,形成的DES([ChCl][Urea]2)的黏度最低。如前所述,DES中HBD和HBA之间存在氢键和分子间的范德华力。因此,[ChCl][Urea]1.5~3.0的黏度由氯化胆碱和尿素之间存在的氢键和分子间的范德华力决定。亦即[ChCl][Urea]1.5~3.0的黏度与n(ChCl)/n(Urea)及是否有水的存在有关。当n(ChCl)/n(Urea)为1∶1.5~1∶2.0时,随着尿素摩尔量的增加,氯化胆碱与尿素之间的分子间氢键作用逐渐增强,尿素分子之间包括氢键的分子间作用和氯化胆碱中Cl-与Ch+作用逐渐减弱,因而综合效应使[ChCl][Urea]1.5~2.0中组分的流动性逐渐增大,即黏度逐渐降低。当n(ChCl)/n(Urea)为2.0时,虽然氯化胆碱与尿素之间的氢键最强,但由于包括氢键的尿素分子间作用和氯化胆碱中Cl-与Ch+作用最弱,因而综合效应使[ChCl][Urea]2中组分的流动性最大,即黏度最小。当n(ChCl)/n(Urea)为1∶2.0~1∶3.0时,随着尿素的摩尔量逐渐增加,受氢键饱和度(ChCl氢键受体数量为2)影响,氯化胆碱与尿素分子间氢键作用不再随着尿素的摩尔量增加而增强,甚至随着尿素的摩尔量增加而减弱。这是由于随着尿素的摩尔量的逐渐增加,尿素分子间包括氢键的作用力逐渐增强,氯化胆碱中Cl-与Ch+作用逐渐增强,因此,综合效应使[ChCl][Urea]2.0~3.0中组分的流动性逐渐减弱,因而[ChCl][Urea]1∶2~1∶3黏度也逐渐增大。
另外,从图5还可以看出,对于同一种DES,随着温度的升高,[ChCl][Urea]1.5~3.0的黏度逐渐降低(如40 ℃),符合式(1)的变化规律。这是由于随着温度的升高,[ChCl][Urea]1.5~3.0分子的热运动加快,分子间氢键逐渐减弱,组分的流动性逐渐增强,因而[ChCl][Urea]1.5~3.0的黏度依次降低。
5 教学要求
预习要求:查阅相关文献,了解DES的定义、合成方法及用途,熟悉FT-IR、1H-NMR谱图分析和黏度的测定方法。
实验要求:
(1) 掌握[ChCl][Urea]1.5~3.0合成方法;学习通过FT-IR和1H-NMR对其结构进行确证;
(2) 掌握[ChCl][Urea]1.5~3.0黏度的测定方法;
(3) 探讨[ChCl][Urea]1.5~3.0组成与其性能的关系;
(4) 实验报告以论文的形式完成,初步训练学生撰写科技论文的能力。
实验说明:
(1) 本实验可以作为大学低年级化学开放实验或准研究性实验[18],也可作为高年级的研究性实验或综合性实验开设;
(2) 作为高年级的综合性实验时,只需合成[ChCl][Urea]2,根据实验室条件和实验目的,适当选择FT-IR或1H-NMR对其结构进行确证和黏度的测定即可,可根据实验内容适当减少[ChCl][Urea]2的质量;
(3) 使用氯化胆碱的注意事项:氯化胆碱易吸潮、易结块,氯化胆碱暴露在空气中,几分钟后表层即严重吸潮,在高温高湿季节吸潮速度更快。而水分的存在对所合成的[ChCl][Urea]1.5~3.0结构和物性均产生影响,因此,相应的参数也会有所改变。
6 结语
本实验集合成、波谱分析、性能测试于一体。在国家急需高等教育培养高素质技能型、创新型人才教育“新阶段”的当下,开设“低温共熔溶剂[ChCl][Urea]n的合成及其性能研究实验”这类研究型综合实验尤为重要。开设本实验有利于学生创新意识、创新能力和团队精神的培养,有利于学生查阅文献及科技论文书写等综合能力的提高。同时,由于DES的合成属于原子经济性反应,因而有利于学生“发展绿色化学理念”的树立。
