微滴式数字PCR和实时荧光PCR在豆奶饮料转基因成分检测中的应用
2019-01-09王鸣秋张涛林津杨硕刘艳李诗瑶马弋张莉
王鸣秋,张涛,林津,杨硕,刘艳,李诗瑶,马弋,张莉
(湖北省食品质量安全监督检验研究院,湖北武汉 430075)
转基因作物自商业化种植以来迅速发展,全球种植面积已由1996年的170万hm3增长到2016年的1.851亿hm3,种植国家增加到26个[1]。但其在解决全球粮食问题的同时也带了诸多安全性争议,很多国家和地区开始实施转基因产品标识管理制度,并设置了阈值[2,3]。如欧盟设定阈值为0.9%,日本为5%,韩国 3%[4~6]等。我国 2001年发布的《农业转基因生物安全管理条例》明确规定了在中国境内销售的农业转基因生物应当有明显的标识,但尚未设定阈值[7,8]。我国现行标准中对转基因成分的检测方法主要为实时荧光PCR(real-time PCR,RT-PCR)定性“有或无”。然而,实时荧光PCR扩增效率容易受到模板纯度、引物探针浓度、反应抑制剂等诸多因素影响,进而影响反应Ct值和结果准确性[9,10],特别是对于复杂食品基质容易出现可疑结果无法判定,存在低含量样品重复性较差等缺点。
数字PCR(digital PCR,dPCR)技术是近年来迅速发展起来的一种突破性的核酸定量分析技术。dPCR是基于单分子目标基因扩增定量的技术,核酸模板被分配到大量独立的反应单元中,扩增结束后通过统计学分析单个反应室的阳性信号,从而实现绝对定量[11,12]。微滴数字 PCR(droplet digital PCR,ddPCR)是dPCR技术的一种,它主要是以形成大量油包水微滴的形式对核酸进行成千上万倍稀释,然后以每个小微滴为独立的反应单元进行PCR反应,最后利用泊松分布原理对核酸分子进行绝对定量分析[13]。dPCR技术不依赖于标准品和标准曲线的绘制,消除了样品基质对Ct值的影响,具有检出限低、重复性好等优点,非常适用于低拷贝数靶标的转基因检测[14~16]。
大豆作为人类重要的油料作物,可生产加工成大豆油、豆粕、大豆营养品等各种食品,在我国粮食与饲料市场占有不可替代的重要地位。自1988年第一株转基因大豆现世至今,国际市场上转基因大豆种类可达 30余种[17],用于各类食品的加工生产。豆奶饮料以大豆为主要原料,因其含有丰富的蛋白质、微量元素和维生素,是一种广受大众欢迎的健康饮品。但国内尚未有针对豆奶饮料的转基因成分检测报道,加之其品种繁杂,生产厂家参差不齐,原料混杂,可提取的大豆DNA质量不高,必须选择一种灵敏度高,重复性好的方法进行检测。对于豆奶中转基因成分的检测第一步为筛选PCR,即以外源基因中的启动子或终止子为目的检测片段,筛选为阳性后再进行特异性PCR 检测[18]。
本研究以转基因常见启动子CaMV35s和终止子NOS基因为靶标,对比实时荧光PCR和微滴式数字PCR的检测低限,并应用于市售豆奶饮料的转基因成分筛查,从而对豆奶饮料转基因成分进行有效检测和监管,便于转基因标识制度的实施。
1 材料与方法
1.1 材料和试剂
转基因大豆GTS40-3-2标准品(10%、1%)购于European Reference Materials (ERM);转基因标准品(100%)、非转基因标准品来源于中检院质控样品;Takara MiniBEST Universal Genomic DNA Extraction Kit、Premix Ex Taq (Probe qPCR)购于大连宝生物公司;ddPCR Supermix for Probes购于美国Bio-rad公司;PCR引物和探针由上海生工合成;豆奶饮料购于湖北市场流通领域。
1.2 仪器和设备
台式高速冷冻离心机SG3-18K购于Sigma公司;5424R高速冷冻离心机购于德国 Eppendorf公司;CFX96 Deep Well Real-time System、QX200 Droplet dPCR系统购于美国Bio-rad公司;Tissue Lyser II组织研磨仪、QIAxpert核酸浓度检测仪购于德国 Qiagen公司。
1.3 试验方法
1.3.1 DNA提取
称取60 mg标准品于2 mL离心管中,按照试剂盒说明书操作提取基因组DNA。利用QIAxpert测定所提DNA溶液浓度,并以A260/A280比值判断DNA的质量。DNA稀释至50 ng/μL备用。
1.3.2 引物探针的选择
目的基因序列参考SN/T 1202-2010《食品中转基因植物成分定性 PCR检测方法》[19],大豆内源基因Lectin作为内标。具体引物探针序列见表1。

表1 转基因大豆筛选PCR引物、探针序列Table 1 Primers and probes sequences of GM soybean screening PCR
1.3.3 ddPCR反应体系及条件
ddPCR反应体系总体积为20 μL:ddPCR supermix(2×)10 μL,正反向引物(10 mM)各1 μL,探针(10 mM)0.5 μL,DNA 模板 2.5 μL,补水至 20 μL。将配置好的反应体系转移至微滴发生卡中,利用微滴发生器进行微滴生成。转移生成的微滴(约40 μL)至96孔PCR反应板,封膜,进行PCR反应。反应条件为:95 ℃ 5 min;94 ℃ 30 s,60 ℃ 1 min,40 个循环;98 ℃ 10 min;4 ℃保存反应产物。扩增结束后将96孔板置于微滴分析仪进行荧光测定和数据读取,采用Quanta Soft V软件分析实验数据。
1.3.4 RT-PCR反应体系及条件
RT-PCR反应体系总体积为20 μL:Premix Ex Taq(2×)10 μL,正反向引物(10 mM)各1 μL,探针(10 mM)0.5 μL,DNA 模板 2.5 μL,补水至 20 μL。反应条件为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,50 个循环。
1.3.5 浓度检测低限测定
将提取的100%转基因标品DNA溶液(50 ng/μL)用去离子水进行五倍梯度稀释,得到 50 ng/μL、10 ng/μL、2 ng/μL、0.4 ng/μL、0.08 ng/μL、0.016 ng/μL、0.0032 ng/μL共7个浓度梯度的转基因DNA溶液。各取2.5 μL为模板,分别进行RT-PCR反应和ddPCR反应,检测CaMV35S、NOS、Lectin基因。
1.3.6 含量检测低限测定
将转基因标准品(100%、10%、1%)和非转基因标准品以不同质量比充分混合,制备成100%,10%,1%,0.1%,0.05%,0.01%共 6个梯度百分比含量的转基因样品,按照1.3.1提取DNA。各取2.5 μL为DNA模板,分别进行RT-PCR和ddPCR反应,检测CaMV35s、NOS、Lectin基因。
1.3.7 豆奶饮料转基因成分的检测
抽取市售豆奶饮料30批次,配料表明示均以大豆为主要原料。取豆奶饮料40 mL置于50 mL离心管中,10000 r/min离心5 min,弃上清,取沉淀80 mg于2mL离心管中,按照试剂盒说明书操作提取基因组DNA。若单次离心沉淀较少,再次取样,重复离心1~2次。以提取的DNA为模板,分别进行RT-PCR和ddPCR反应,检测CaMV35s、NOS、Lectin基因。
1.3.8 数据统计分析
RT-PCR每反应设置2个平行,以Ct平均值≤36作为有效数据判定依据;ddPCR每反应设置3个平行,计算平均值及相对标准偏差(RSD),以RSD≤25%作为有效数据判定依据。
2 结果与讨论
2.1 DNA提取
转基因大豆标准品和豆奶饮料 DNA提取液经QIAxpert测定,DNA 浓度在 10~100 ng/μL 之间,A260/280值在1.8~2.0之间,可初步判断DNA质量满足后续实验要求。而后将标准品浓度均稀释为 50 ng/μL 备用。
2.2 浓度检测低限测定
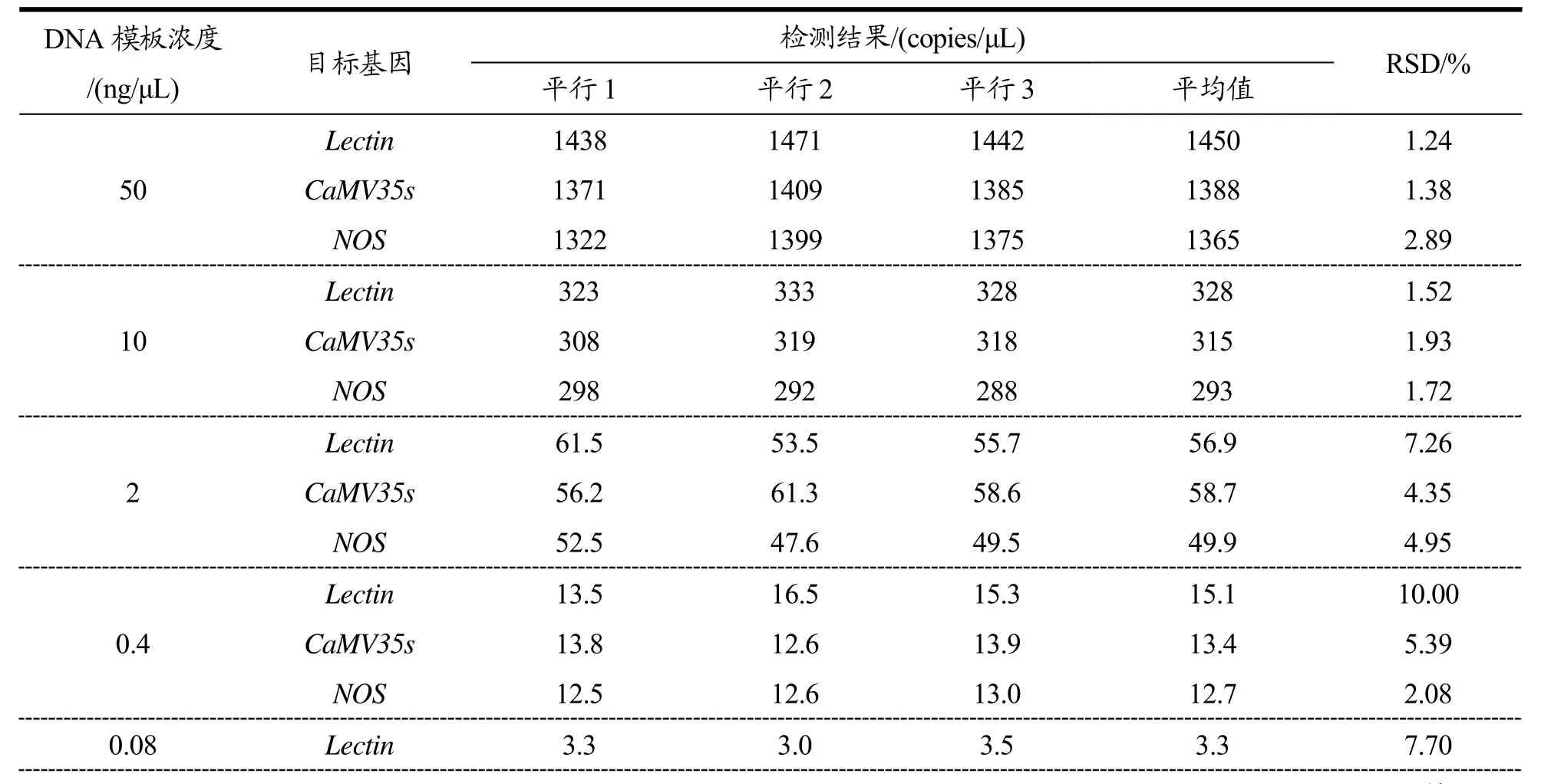
表2 转基因大豆筛选ddPCR浓度检测低限测定结果Table 2 Concentration detection limit results of GM soybean screening ddPCR

CaMV35s 2.2 1.9 2.3 2.1 9.76 NOS 2.6 3.4 3.1 3.0 13.32 0.016 Lectin 0.32 0.27 0.16 0.25 32.74 CaMV35s 0.25 0.08 0.21 0.18 49.38 NOS 0.32 0.23 0.11 0.22 47.89
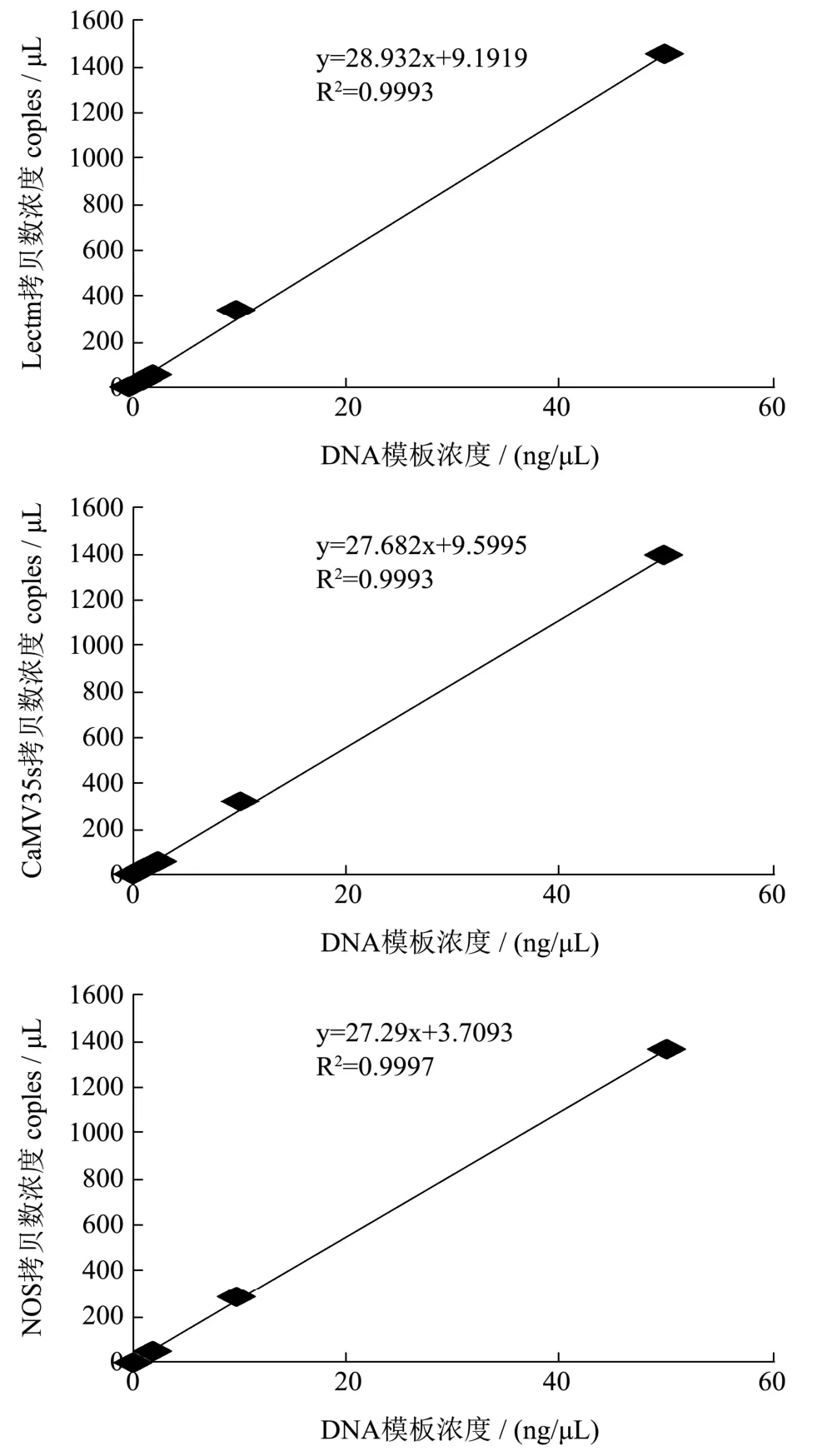
图1 转基因大豆筛选ddPCR定量线性范围拟合曲线Fig.1 Quantitative linear range fitting curves of GM soybean screening ddPCR
之间时,ddPCR检测目的基因拷贝数呈线性递减,但模板浓度降低至0.016 ng/μL时,虽然能检测到少量阳性微滴,但定量偏差较大(RSD>25%)。因此,ddPCR检测Lectin、CaMV35s、NOS基因的绝对灵敏度为0.04 ng/反应。以DNA模板添加浓度为横坐标(50、10、2、0.4、0.08),以ddPCR检测结果拷贝数为纵坐标绘制定量线性范围拟合曲线,所得的三条曲线中基因拷贝数浓度与DNA模板添加浓度呈现高度的线性相关,相关系数R2大于0.999,如图1所示,说明该方法也适用于拷贝数浓度定量检测。考虑到豆奶饮料的原料大豆转基因成分很难达到本实验中标准品 100%的含量,因而在实测中模板 DNA浓度最好选择在 50 ng/μL~2 ng/μL 之间。
2.3 含量检测低限测定

图2 转基因大豆筛选含量检测低限实时荧光PCR检测图Fig.2 Content detection limit of GM soybean screening RT-PCR
对不同浓度的 DNA模板分别进行 RT-PCR和ddPCR检测。当DNA浓度为50 ng/μL、10 ng/μL、2 ng/μL、0.4 ng/μL、0.08 ng/μL 时,CaMV35s、NOS和Lectin基因均得到良好的扩增曲线,对应的 Ct值在24.0~35.8之间,均小于36。当DNA模板浓度小于0.08 ng/μL时,三个基因的Ct值均大于36(0.016 ng/μL)或无扩增(0.0032 ng/μL),说明RT-PCR 对CaMV35s、NOS和Lectin基因的浓度检测低限为0.2 ng/反应。
由表2可知,当DNA模板浓度在50~0.08 ng/μL
对不同转基因成分含量(100%、10%、1%、0.1%、0.05%、0.01%)样品分别进行RT-PCR和ddPCR检测。如图2所示,使用实时荧光PCR方法检测50 ng/μL DNA模板中转基因含量为100%、10%、1%、0.1%的样品时,CaMV35s和NOS基因皆存在明显的扩增曲线,所得 Ct值分别为 23.65±0.06、27.68±0.09、31.42±0.01、37.13±0.12;23.54±0.19、28.43±0.38、31.43±0.01、37.03±0.22。当样品含量低于0.1%时,无扩增曲线。当Ct值>36.0时,结果不予置信,因此当模板浓度为 125 ng/反应时该方法对转基因成分筛选的含量检测低限为1%。
根据表3和图3可知,ddPCR在转基因含量为100%、10%、1%、0.1%、0.05%的样品检测中,CaMV35s和NOS基因均得到确切的阳性结果,RSD<25%;当含量降低到 0.05%以下,阳性微滴信号时有时无,RSD>25%,数据不予置信,即ddPCR对转基因大豆筛选的含量检测低限为0.05%。

表3 转基因大豆筛选含量检测低限ddPCR检测结果Table 3 Content detection limit of GM soybean screening ddPCR

图3 转基因大豆筛选含量检测低限ddPCR检测图Fig.3 Content detection limit of GM soybean screening ddPCR
2.4 豆奶饮料转基因成分检测
30批次豆奶饮料DNA模板经Lectin基因检测均为阳性,可用于转基因成分分析。RT-PCR和ddPCR分别筛查其转基因成分CaMV35s和NOS,其中26批次样品在两个平台均得到阴性结果;剩余4批次样品结果见表4。15号样品RT-PCR和ddPCR结果一致,均为阳性;7号、16号样品 RT-PCR的 Ct值在34.59~38.28之间,为可疑结果,但经ddPCR检测均有阳性微滴,除了 7号样品 NOS基因 ddPCR结果RSD>25%不予置信以外,其余均可确定为阳性;12号样品NOS基因RT-PCR的Ct值为36.35为可疑结果,但ddPCR未检测到阳性微滴,结果确认为阴性。可见,RT-PCR的Ct值可能受豆奶样品基质中PCR抑制因子或DNA模板纯度影响较大,以Ct值>36作为判定阴性结果的标准未必适用于所有情况,而ddPCR受这些因素影响相对较小,而且检出限更低,故必要时加以 ddPCR结果辅助判断非常必要。
3 结论
3.1 本研究选取CaMV35s启动子和NOS终止子作为筛选元件是考虑到其在转基因作物中的广泛使用,Wu Y等[20]曾报道这两种通用元件分别覆盖了 65.7%和53.49%的转基因产品,81.4%的转基因产品中至少含有两者之一,因此我们可以通过筛查这两个基因完成大部分转基因成分的检测。但以导入的外源基因通用元件为靶标进行转基因成分筛选是特异性相对较低的转基因检测技术,现行标准中一般将其应用为定性筛查;而本研究发现,运用ddPCR平台进行CaMV35s和NOS基因浓度检测低限测定时,其拷贝数与转基因大豆模板浓度具有较好的线性关系,说明该方法适用于拷贝数浓度定量检测,这与刘津等[21]在转基因大豆MON89788双重数字PCR检测中报道一致。
3.2 本文将实时荧光PCR和数字PCR的绝对灵敏度和检测低限对比发现,ddPCR均优于实时荧光 PCR(1%),且检测低限达到0.05%,比Wei F等[22]报道的转基因玉米筛选数字PCR检出限0.1%更低,可满足现今所有国家对于转基因标识阈值的检测需求。现行实时荧光PCR定性检测标准中,大部分以Ct值>36作为阴性结果判定依据[19],往往出现Ct值在36附近的疑似结果无法判定。由于ddPCR不受样品基质的影响,对反应体系杂质要求的容忍度较高,在豆奶饮料实际样品的检测中,对于实时荧光PCR模棱两可的可疑结果,ddPCR能够通过阳性微滴的有无给出确切的结果,避免出现假阳性假阴性结果。特别是转基因含量较低的样品,ddPCR重复性和准确性方面表现更加稳定。然而,数字PCR操作相对复杂费时,成本较高,微滴发生器通量小,很难满足转基因食品的大批量检测。所以,建议在现行主流检测技术RT-PCR实施的基础上,辅以dPCR确证可疑结果,是一种既快速又经济的方法。
3.3 我国转基因作物标识暂行“有或无”的规定,但随着转基因法规的完善,与国际接轨,转基因阈值的设置将逐渐纳入到体系中来,这对转基因精确定量检测提出了更高的要求。而数字PCR以其低检出限、高重复性等优势在绝对定量领域将发挥更重要的作用,除了转基因定性筛查,利用特异性更高的外源基因和边界序列为靶标,对转基因成分相对含量进行准确定量是未来应用的主要发展方向。胡佳莹等[23]应用 cd PCR建立了转基因玉米MON863的品系特异性定量检测方法;Dobnik D等[24]应用dd PCR技术建立了欧盟批准的12种玉米品系的多重定量检测方法。不过,现有转基因定量检测研究对象主要以原料为主,对转基因产品如豆制品、大米制品、食用油等领域研究较少,笔者认为这也是未来食品转基因检测的研究方向之一。
