北方春小麦赤霉病镰刀菌种群及其毒素化学型与毒素污染分析
2019-01-09刘笑笑仇建飞孟繁磊魏春雁
刘笑笑, 王 莹, 仇建飞, 孟繁磊, 魏春雁
[吉林省农业科学院农业质量标准与检测技术研究所/农业部农产品质量安全风险评估实验室(长春),吉林长春 130033]
小麦的种植面积仅次于水稻,是我国一半人口的主粮,小麦及其制品的质量安全直接关系到我国的食品安全[1]。北方地区由于气候条件限制,小麦种植基本以春小麦为主。北方春麦区主要包括黑龙江、吉林、辽宁、内蒙古等地区,在全国小麦生产中占有重要地位。小麦赤霉病别称红麦头、麦穗枯、烂麦头,是长江流域冬麦区以及北方春麦区常发性病害,该病是由多种镰刀菌引起的,亚洲镰刀菌(Fusarumasiaticum)和禾谷镰刀菌(F.graminearum)是引起小麦赤霉病的优势致病种群[2-5]。近年来,该病害流行范围明显由南向北转移[6]。镰刀菌不仅影响小麦的产量和品质而造成经济损失,更重要的是其产生的代谢物——镰刀菌毒素,不管是食用还是饲用,对人和畜禽都存在安全风险。镰刀菌毒素对人和畜禽的肝脏、肾脏、细胞免疫机能等都有不同程度的毒性作用,甚至对肿瘤的发生有一定的影响[7-16],因而镰刀菌毒素被列入自然发生的最危险的食品污染物之一[17-18]。为明确北方春麦区镰刀菌种群结构、毒素化学型分布特点以及毒素污染情况,本研究对2016年采集自北方春麦区(吉林、黑龙江、内蒙古等地区)的55份小麦样品致病种群镰刀菌单孢菌株进行分离、毒素化学型鉴定及单体毒素的定性定量检测,旨在明确镰刀菌在北方春麦区的分布与毒素污染情况,对人们食用安全小麦以及小麦产业健康发展具有重要的指导意义。
1 材料与方法
1.1 材料与试剂
1.1.1 供试样品 在小麦收割期,从吉林省的松原市、白城市、四平市,黑龙江省的齐齐哈尔市、黑河市(含九三农场),内蒙古自治区的呼伦贝尔盟、巴彦淖尔盟等7个地区分别收集小麦麦粒,共采集55份样品,每份样品质量为2.5 kg。
1.1.2 化学试剂 马铃薯葡萄糖琼脂(potato dextrose agar,简称PDA)培养基,购自青岛高科技工业园海博生物技术有限公司;引物DNA、琼脂糖N和DNA提取试剂盒,均购自生工生物工程(上海)股份有限公司;预混DNA聚合酶,购自长春海灵科贸有限公司;甲醇(色谱纯),购自赛默飞世尔科技公司;甲酸(分析纯),购自西陇化工股份有限公司;乙腈(色谱纯),购自山东禹王实业有限公司化工分公司;乙酸(分析纯),购自天津市化学试剂一厂;玉米赤霉烯酮(zearalenone,简称ZEN)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,简称DON)、3-乙酰基脱氧雪腐镰刀菌烯醇(3-acetyl-deoxynivalenol,简称3-AcDON)、15-乙酰基脱氧雪腐镰刀菌烯醇(15-acetyl-deoxynivalenol,简称15-AcDON)、脱氧雪腐镰刀菌烯醇-3-葡萄糖苷(deoxynivalenol-3-glucoside,简称D3G)、雪腐镰刀菌烯醇(nivalenol,简称NIV)(纯度≥99%),均购自北京坛墨质检科技有限公司;琼脂粉,购自北京依托生物。
1.1.3 仪器设备 Presoclave Ⅱ型高压灭菌锅,购自西班牙Selecta公司;SW-CJ超净工作台,购自苏州安泰空气技术有限公司;DNP-9162BS-Ⅲ恒温培养箱,购自上海新苗医疗器械制造有限公司;CX21FS1显微镜,购自日本Olympus公司;C1000 PCR仪(伯乐),购自长春美信科贸有限公司;DYY-8C 双稳定时电泳仪,购自北京六一生物科技有限公司;CT15RE台式高速冷冻离心机,购自日立工机株式会社;QTRAP 5500液相色谱-质谱/质谱联用仪,购自美国 AB SCIEX 公司。
1.2 试验方法
1.2.1 病原菌的分离与纯化 每份样品称取100 g,从中挑选小麦赤霉病病粒。用75%乙醇表面消毒30 s,1% NaClO表面消毒1 min,无菌水漂洗3次,灭菌滤纸吸干水分后分5点摆放在PDA培养基平板中,于25 ℃倒置培养72 h。将小麦籽粒周围长出的所有真菌挑出,转移至另一个新的PDA培养基平板中,25 ℃培养72 h后,在显微镜下观察,带有镰刀状大型分生孢子或椭圆形小型分生孢子的真菌,则为镰刀菌。
用20 mL无菌水将真菌洗掉,使其菌丝、孢子充分混匀,将混合液通过3层擦镜纸过滤,孢子在滤液中,加水稀释,涂至水琼脂培养基平板上,在光学显微镜下镜检,将仅有1个分生孢子的水琼脂转移至PDA培养基平板上,于25 ℃培养 72 h 后挑取新鲜菌丝转入PDA培养基斜面培养,置于4 ℃保存,即获得镰刀菌单孢菌株。
1.2.2 菌丝培养和DNA提取 挑取每个菌株至PDA培养基平皿中,于25 ℃静置培养72 h,收集菌丝用于DNA提取试验。DNA提取采用十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,简称CTAB)法。将干净的研砵、研杵、药匙灭菌备用,将CTAB提取液置于65 ℃水浴锅中预热,先加入少量灭菌的石碤砂,然后加入适量菌丝体再加入 1 000 μL 事先预热的CTAB,迅速研磨后分装于离心管中,反复颠倒,使其迅速混溶,65 ℃水浴1 h,其间每隔15 min拿出颠倒混匀1次。取出冷却后,加入等体积的苯酚氯仿,轻轻翻转混匀后,于常温14 000 r/min条件下离心10 min,转移上清液至新离心管中,加入2倍体积的无水乙醇,轻轻转动离心管,待白色絮状沉淀出现,或可放置-20 ℃冰箱30 min以上,于常温8 000 r/min条件下离心5 min,倒干上清液,加入 1 000 μL 75%乙醇,轻轻摇匀,8 000 r/min离心5 min,漂洗2次,晾干后,加适量TE缓冲液,4 ℃溶解。用1%琼脂糖凝胶电泳检测DNA。
1.2.3 镰刀菌种的鉴定 采用Yang等的研究方法[3,6],对84株镰刀菌用FgCTPSf024、FgCTPSr536、FgCTPSf177、FgCTPSr306等4条引物进行竞争PCR扩增,此为第1组竞争PCR扩增。采用25 μL扩增体系:1.0 μL DNA模板,2.0 μL dNTPs,2.5 μL PCR缓冲液,0.5 μLTaq酶,1.0 μL FgCTPSf 177,1.0 μL FgCTPSr306,0.5 μL FgCTPSf024,0.5 μL FgCTPSr536,用无菌水补至25 μL。PCR扩增反应程序:95 ℃ 2 min;95 ℃ 1 min,55 ℃ 30 s,72 ℃ 50 s,35个循环;72 ℃ 10 min。用FgTEFf124、FgTEFf364、FgTEFr411、FgTEFr590等4条引物进行第2组竞争PCR扩增。4条引物分别添加 0.50、0.50、0.25、0.25 μL,其他组分和扩增反应程序与第1组竞争PCR相同。
对于非禾谷镰刀菌群(F.graminearumclade,简称Fgclade)菌株,用燕麦镰刀菌(F.avenaeum)种的特异性引物(FaF/FaR)进行PCR扩增,反应体系中引物分别添加1 μL,其他组分与上述反应体系相同。PCR扩增反应程序:95 ℃ 2 min;95 ℃ 1 min,60 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。以上PCR产物均用1%琼脂糖凝胶电泳检测。PCR引物序列见表1。

表1 PCR引物序列
1.2.4 毒素化学型的测定 测定DON和NIV毒素化学型时,使用TOXP1和TOXP2引物,各0.5 μL,其他反应组分同“1.2.3”节。PCR扩增程序:95 ℃ 2 min;95 ℃ 1 min,55 ℃ 1 min,72 ℃ 50 s,35个循环;72 ℃ 10 min。采用Jennings等的方法[19]对DON毒素化学型的菌株进行3-AcDON和 15-AcDON 鉴定。2个PCR反应所须引物分别为0.5 μL Tri303F/Tri303R、0.5 μL Tri315F/Tri315R,其他反应组分同“1.2.3”节。扩增程序:95 ℃ 2 min;95 ℃ 1 min,60 ℃ 1 min,72 ℃ 2 min,30个循环;72 ℃ 10 min。PCR产物均用1%琼脂糖凝胶电泳进行测定。引物序列见表1。
1.2.5 镰刀菌毒素检测 准确称取5.000 g小麦样品(麦粒磨成的麦粉)于离心管中,加入25 mL提取液(乙腈、水、乙酸的体积比为80 ∶19 ∶1),振荡1.5 h,超声提取30 min,14 000 r/min 离心15 min,取1 mL上清液,过0.22 μm有机微孔滤膜,上液相色谱-质谱/质谱仪进行测定。色谱条件:色谱柱为Kinetex SB-C18,2.1 mm×100 mm×1.7 μm;柱温为 40 ℃;进样量为3 μL;流动相组成:A相为10%甲醇(含0.1%甲酸),B相为甲醇;流速为0.3 mL/min。质谱条件:电离源模式为电喷雾离子化;电离源极性为正负模式同时扫描;雾化器为氮气;检测方式:多离子反应监测。
2 结果与分析
2.1 病原菌菌株的分离与致病菌种群结构分析
共分离获得84株单孢菌株,各地分离的单孢菌株情况见表2。84株单孢菌株中,共检测到亚洲镰刀菌、F.acaciae-meansii、燕麦镰刀菌、F.meridionale、禾谷镰刀菌等5个镰刀菌种。除内蒙古巴彦淖尔盟地区外,其余采样地区均检测到禾谷镰刀菌菌株,占所有菌株的42.86%;其次有2个采样地区检测到亚洲镰刀菌,占所有分离菌株的27.38%。各采样地区的镰刀菌致病种存在差异,吉林省镰刀菌种群相对复杂,检测到5个镰刀菌菌种;黑龙江省检测到F.acaciae-meansii、F.meridionale、禾谷镰刀菌等3个种;内蒙古检测到亚洲镰刀菌、燕麦镰刀菌、禾谷镰刀菌等3个种,且主要集中在亚洲镰刀菌和禾谷镰刀菌2个种。这与Gale等的研究结果[4-5]一致。亚洲镰刀菌在吉林省的小麦赤霉单孢分离物中检测到12株,在内蒙古检测到2株,该结果与Parry报道的亚洲镰刀菌主要分布于凉爽或海洋性气候地区[4]较为吻合。

表2 不同采样地点镰刀菌种群分布情况
2.2 PCR鉴定结果
由图1可知,亚洲镰刀菌菌株扩增出4条条带,分别为536、388、311、162 bp,引物FgCTPSf177和FgCTPSr306在亚洲镰刀菌菌株上扩增出162 bp的特征条带;FgCTPSr306和FgCTPSf024在Fgclade中扩增出311、536 bp的特征条带; FgCTPSf024和FgCTPSr536在F.meridionale菌株上扩增出536 bp的特征条带。

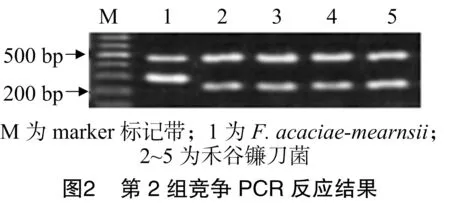
由图2可知,Fgclade菌株扩增出482 bp条带,禾谷镰刀菌菌株扩增出261 bp条带,F.acaciae-meansii扩增出306 bp条带。而燕麦镰刀菌菌株扩增出920 bp特征带。
由图3、图4可知,用引物ToxP1/ToxP2区分DON和NIV毒素,DON毒素的特征条带为300 bp,NIV毒素的特征条带为360 bp。DON毒素菌株中,引物Tri303F/Tri303R扩增出583 bp条带的菌株为3-AcDON,引物Tri315F/Tri315R扩增出863 bp条带的菌株为15-AcDON。
2.3 镰刀菌毒素化学型分析
由表3可知,DON和NIV毒素化学型之间存在明显的地域分布。DON毒素化学型是北方春麦区赤霉病病菌的优势毒素类型,而NIV毒素化学型仅在吉林省麦区出现。在产生DON毒素化学型的菌株中,北方春麦区DON毒素类型均以15-AcDON为主。zhang等研究表明,DON是我国小麦赤霉病病菌产生主要的毒素化学类型,且北方冷凉地区以产生 15-AcDON为主,南方温暖地区以产生3-乙酰基脱氧雪腐镰刀菌烯醇(3-AcDON)为主[5,20-21],本研究结果与上述观点一致。菌株产生乙酰DON毒素的类型与该菌株所属种存在一定关系。亚洲镰刀菌、燕麦镰刀菌、禾谷镰刀菌等3种菌株主要产生15-AcDON;F.acaciae-meansii和F.meridionale这2种菌株只产生15-AcDON。


2.5 镰刀菌毒素检测结果与分析
对北方春小麦中雪腐镰刀菌烯醇、脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、脱氧雪腐镰刀菌烯醇-3-葡萄糖苷、3-乙酰基脱氧雪腐镰刀菌烯醇、15-乙酰基脱氧雪腐镰刀菌烯醇等6种B型镰刀菌毒素进行测定。结果显示,3个省(自治区)7个市(盟)所有被检样品中,6种毒素均未检出。可能是病害程度较轻,毒素水平很低,再者可能是小麦皮对籽粒起到了保护作用。6种毒素的检出限见表4。
3 结论
北方春麦区小麦镰刀菌病害预防应以亚洲镰刀菌和禾谷镰刀菌为主,生物毒素污染预防应以15-AcDON为主;6种B型镰刀菌生物毒素在被检样品中均未检出,表明北方春麦区小麦整体质量安全水平较高。

表3 各省镰刀菌毒素化学型分布情况

表4 镰刀菌毒素检出限
