两型骨骼肌纤维在体外培养过程中的相互转换
2019-01-08陈颖
陈颖
(商洛学院 健康管理学院,陕西商洛 726000)
骨骼肌纤维类型最常用的划分方法,是根据肌纤维具有不同的收缩特性将其划分为快肌纤维和慢肌纤维[1]。有研究认为,肌球蛋白重链异构体决定着骨骼肌纤维类型,并将肌纤维划分为:MHCI型和MHCⅡ型(包括Ⅱa型、Ⅱb型、Ⅱx型)[2]。肌球蛋白重链(MHC)同功型成为区分肌纤维类型的分子标志[3]。慢肌纤维主要表达MHCI型,快肌纤维主要表达MHCⅡ型。快肌纤维与慢肌纤维的主要区别在于它们的代谢方式,慢肌纤维以有氧氧化为主要代谢形式,而快肌纤维以糖酵解为主要代谢形式[4]。Azad等研究证明外界环境发生改变,慢肌纤维与快肌纤维之间可以相互转换[5]。肌纤维中的MHC的表达会受外界刺激等因素的影响。当外界环境发生改变时肌纤维中的一些特定基因的表达会发生变化,以适应其能量代谢方式的变化[6]。有研究证明耐力训练可以使肌纤维能量代谢方式由糖酵解型向氧化型转换[7]。在人类通过耐力训练之后Ⅰ型纤维和Ⅱ型纤维同时存在于人类骨骼肌纤维中,专业运动员能经过训练提高Ⅰ型肌纤维的含量[8]。对于肌纤维类型的转化有人认为是肌纤维上的特异性基因的表达发生变化,从而导致信号通路的改变,引起肌纤维类型发生改变[9]。通过对所获取的骨骼肌组织以及在不同糖浓度下培养的两型肌纤维,进行MHC同功型的检测。观察两型肌纤维相互转化的现象及其特征。为研究肌纤维类型转变提供基础支持。
1 材料与方法
1.1 材料
家兔、胰酶、PBS、Gibico胎牛血清、DMEM 高糖/低糖培养基、Fast Quant cDNA第一链合成试剂盒、细胞总RNA提取试剂盒。
1.2 方法
实验分组:取家兔固有半膜肌和副半膜肌背侧亚部,将实验分为组织组、胰酶消化组、肌纤维高糖培养组以及肌纤维低糖培养组。所培养的两型肌纤维在1、3、7 d取材,将所分的四组进行RT-PCR实验,检测MHC的表达。
1.2.1 总 RNA 的提取
组织RNA提取:取50 g组织,加入200 μL的Trizol溶液进行碾磨,碾磨成粉末状后加入800 μL的Trizol溶液。将样品在室温中静置5 min。随后在4℃下12 000 r·min-1离心10 min,取上清。按每毫升Trizol液中加入0.2mL氯仿,混匀后静置3 min。静置后4℃下12 000 r·min-1离心15 min,离心后取上层水相至新的EP管,加入等体积的异丙醇,混匀后静置25 min,静置后4℃下12 000 r·min-1离心10 min弃上清。加入与Trizol溶液等体积的75%乙醇DEPC,4℃,5 000 r·min-1离心3 min,倒出液体,重复上述步骤2次。在室温下干燥3 min,将RNA溶于25 μL的RNase-Free ddH2O,-80℃下保存。
细胞RNA提取:弃掉细胞培养基,用1mLTrizol溶液反复吹打细胞,将吹打下来的细胞转入EP管中,室温静置5 min。随后的操作步骤同组织RNA提取。
1.2.2 cDNA 制备
取提取好的 RNA 3.1 mL,加入 5×gDNA Buffer溶液 2 μL,RNase-Free ddH2O 溶液 4.9 μL,将其混匀后短暂离心,在42℃下加热3 min。随后加入 10×Fast RT Buffer溶液 2 μL,RT 酶混合物1 μL,FQ-RT-Primer Mix 溶液 2 μL,无酶 DEPC水5 μL。将其混匀在42℃下加热15 min,95℃下加热3 min,将制得的模板DNA放于-20℃保存。
1.2.3 PCR 的扩增
PCR扩增的反应体系为:DreamTaq Green PCR Master Mix溶液为 12.5 μL,上游引物 0.5 μL,下游引物 0.5 μL,模板 DNA 1 uL,无酶 DEPC 水10.5 μL。将该溶液短暂离心混匀后,在PCR仪上90℃,15 min预变性,90℃,15 s;55℃ 30 s;72℃,30 s,共36个循环。
2 结果与分析
2.1 组织组MHC同功型mRNA检测
由图1中(a)和(b)可知,固有半膜肌亚部表达MHCⅠ,不表达Ⅱa、Ⅱb、Ⅱx。由图2中(a)和(b)可知副半膜肌背侧亚部只表达Ⅱa、Ⅱb、Ⅱx。进一步证实副半膜肌为Ⅱ型肌纤维,固有半膜肌为Ⅰ型肌纤维。在组织离体过程中固有半膜肌和副半膜肌的能量代谢方式未发生改变。

图1 兔固有半膜肌组MHC同功型mRNA检测
2.2 兔固有半膜肌和副半膜肌背侧亚部消化组MHC同功型检测
由图3中(a)和(b)可知,固有半膜肌亚部消化后只表达MHCⅠ,不表达Ⅱa、Ⅱb、Ⅱx。由图4中(a)和(b)可知,副半膜肌背侧亚部消化后只表达Ⅱa、Ⅱb、Ⅱx不表达MHCⅠ。组织在离体后其组织的代谢方式并未发生变化,所以其纤维特性并未发生改变。
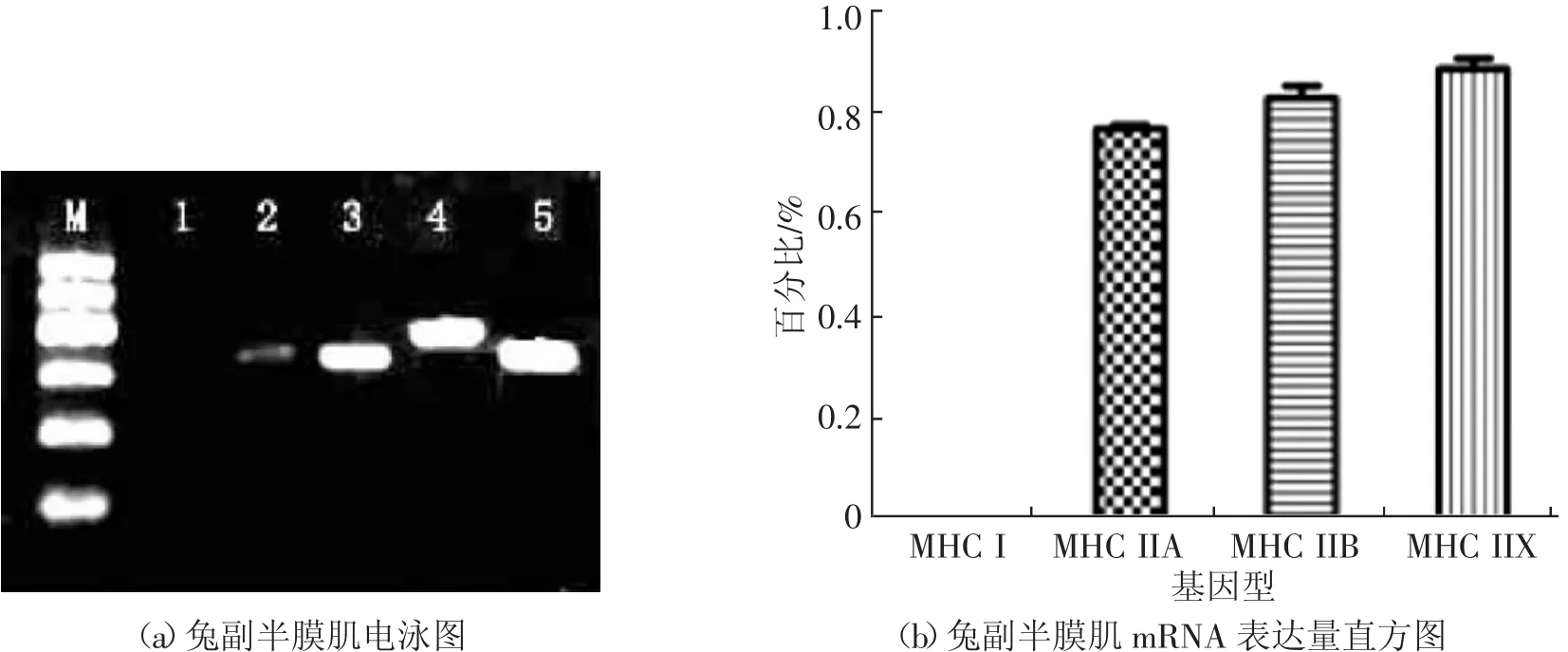
图2 兔副半膜肌组MHC同功型mRNA检测
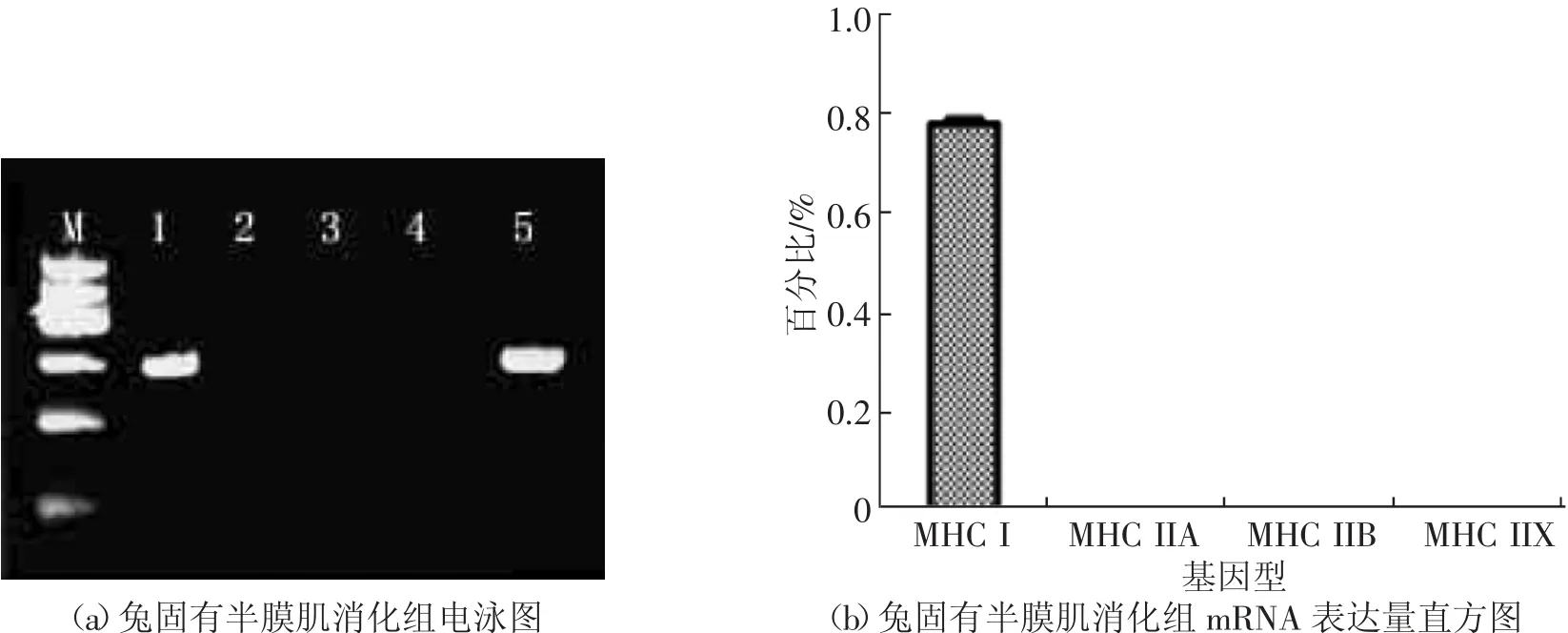
图3 兔固有半膜肌消化组MHC同功型mRNA检测组

图4 兔副半膜肌消化组MHC同功型mRNA检测
2.3 Ⅰ型纤维和II型纤维高糖培养组MHC同功型的检测
由图5 中(a)(b)(c)和(d)可知,Ⅰ型纤维高糖培养第1天时Ⅰ型纤维主要表达MHCⅠ型,少量表达Ⅱa,Ⅱb,Ⅱx;第3天时MHCⅠ表达量降低,Ⅱa、Ⅱb及Ⅱx表达量增加;第7天MHCⅠ表达量进一步降低,Ⅱa、Ⅱb及Ⅱx表达量进一步增加。分析其原因主要为固有半膜肌亚部为Ⅰ型纤维,其能量代谢方式以有氧氧化为主,在高糖环境下,其代谢方式开始逐渐向糖酵解转化,因此其肌纤维类型也开始向Ⅱ型纤维转化,其中Ⅱa、Ⅱb以及Ⅱx表达量增加,MHCⅠ表达量逐渐减少。

图5 Ⅰ型纤维高糖培养组MHC同功型mRNA检测
由图6中(a)(b)(c)和(d)可知,Ⅱ型纤维在高糖培养时,第 1、3、7 天均只表达Ⅱa,Ⅱb,Ⅱx,不表达MHCⅠ。分析其原因可能为副半膜肌的能量代谢方式以糖酵解为主,在高糖环境中其能量代谢方式并未发生改变,所以Ⅱ型纤维的MHC的表达并未发生改变。
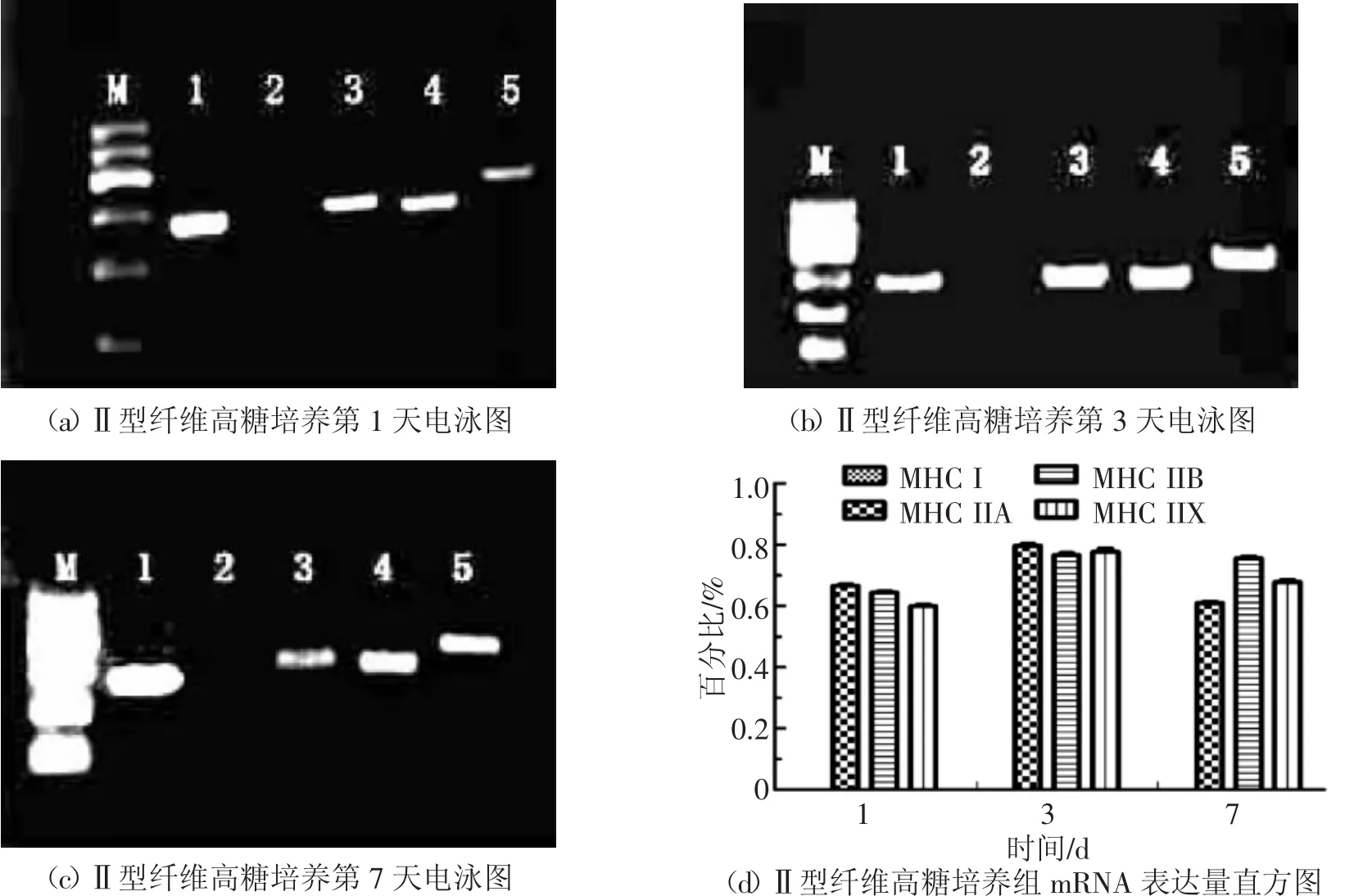
图6 Ⅱ型纤维高糖培养组MHC同功型mRNA检测
2.4 Ⅰ型纤维和II型纤维低糖培养组MHC同功型的检测
由图7中(a)(b)(c)和(d)可知,Ⅰ型纤维在低糖培养第1天时不仅表达MHCⅠ,同时还少量表达Ⅱa,Ⅱb,Ⅱx。第3天仍表达MHCⅠ但其表达量较第1天有所减少,Ⅱa,Ⅱb,Ⅱx表达量有所增加。第7天时MHCⅠ表达量无明显变化,Ⅱa,Ⅱb,Ⅱx表达量较第3天无明显变化,但仍比第1天有明显增加。其原因主要为固有半膜肌亚部在体外培养过程中能量代谢方式发生变化由以前的有氧氧化变为糖酵解,导致其纤维类型开始表现出Ⅱ型肌纤维的特性。
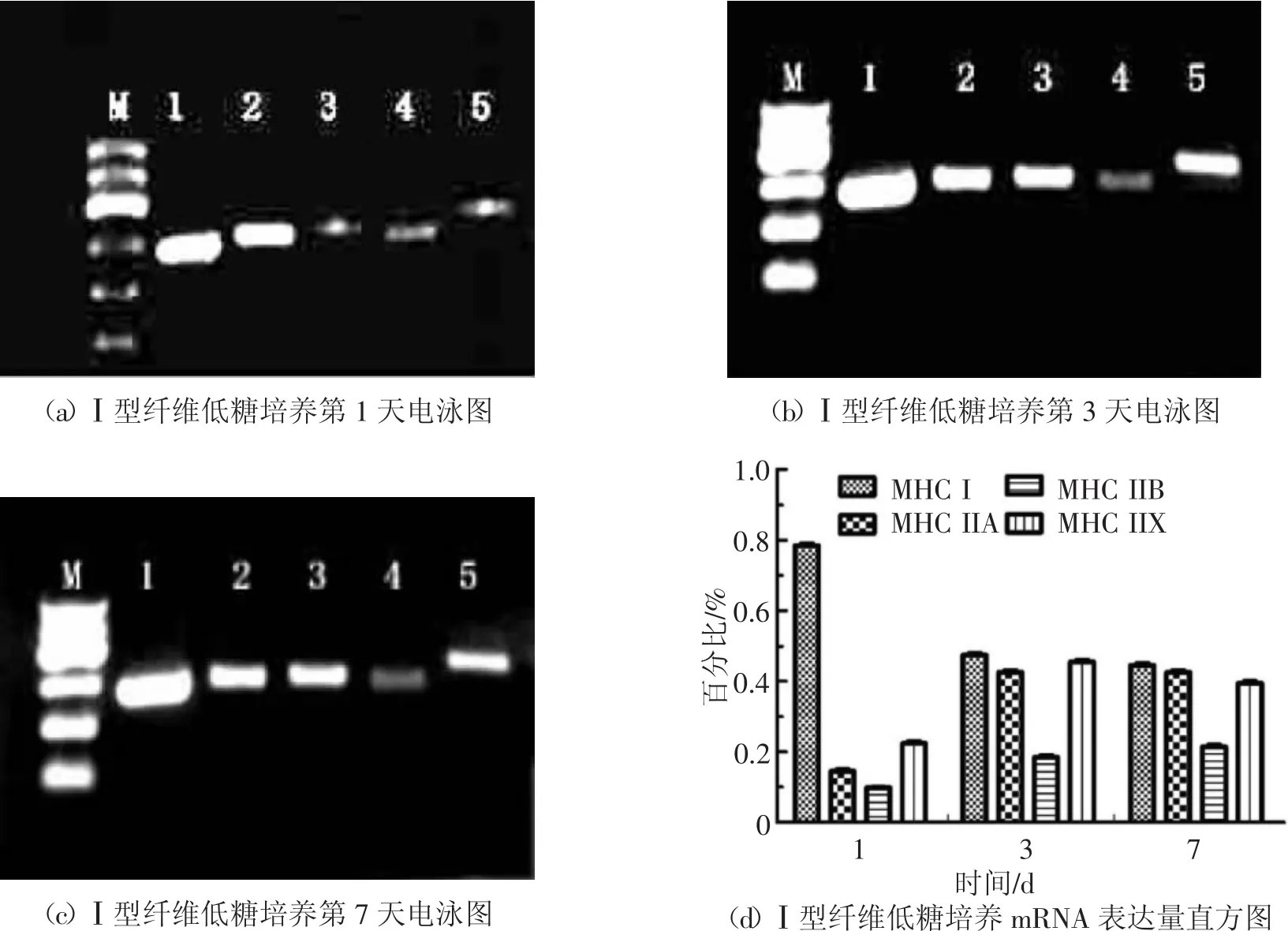
图7 Ⅰ型纤维低糖培养组MHC同功型mRNA检测
由图8中(a)(b)(c)和(d)可知,Ⅱ型肌纤维在低糖培养第1天时只表达Ⅱa、Ⅱb、Ⅱx。第3天仍表达Ⅱa、Ⅱb、Ⅱx,但同时开始表达MHCⅠ。第7天同样表达Ⅱa、Ⅱb、Ⅱx,进一步表达MHCⅠ,其表达量进一步增加。其原因为Ⅱ型肌纤维在离体后其能量代谢方式未发生改变,所以仍维持其Ⅱ型肌纤维的特性,但由于糖含量的减少,为了能适应低糖环境,同时也会表达出MHCⅠ型标志蛋白,来提供充足的ATP。
3 结论与讨论
本研究结果显示,当糖浓度出现改变时Ⅰ型纤维都会向Ⅱ型纤维转换,骨骼肌纤维类型的转变是为了适应糖含量的不同而导致的能量代谢方式的转变。葡萄糖转运体在Ⅰ型纤维中的含量最高,Ⅱ型纤维中含量相对较少。但近几年的研究发现,葡萄糖转运体的表达主要是与肌肉的代谢性质有关,似乎与肌纤维类型没有直接关联。不同部位的肌肉即使是同一类型肌纤维,其葡萄糖转运体的量可能也有很大的差别。
肌纤维类型的转化不仅与糖浓度有关而且可能与培养基中的氧浓度有关,同时还认为与信号通路有关,杨瑾等[10]研究发现PGC-1α就可以通过降低Mstn基因表达量来调节猪体内肌纤维类型转换。但其转换过程中究竟涉及哪些通路、各通路的基因及蛋白表达水平的差异的机制尚需进一步研究。中等强度运动可以激活CaN活性,引起NFATc1蛋白表达增加;诱导骨骼肌纤维由慢向快转化。伴随着运动引起的骨骼肌快型MHC向慢型MHC转化过程中,CaN同样发生了相应的变化,CaN信号途径与运动诱导的骨骼肌纤维类型转化确实存在一定的关联。慢肌纤维以有氧氧化为主要的能量代谢方式,肌质中含有丰富的肌红蛋白、线粒体、脂质和毛细血管,具有相对低的肌球蛋白ATP酶活性和较少的糖原,而含有丰富的高活性有氧氧化关键酶。因此慢肌纤维收缩速度慢但较持久,并且有很好的耐疲劳性。快肌纤维其肌质含有相对高的肌球蛋白ATP酶活性和较多的糖原,但脂质和线粒体较少,有氧氧化关键酶活性低而磷酸化酶活性较高,其收缩特性为快速易疲劳不能持久,所以快肌纤维以糖酵解为其主要的供能方式。因此,慢肌纤维和快肌纤维在能量代谢方面存在明显差异。通过研究骨骼肌纤维的相互转换,能够为运动员的选拔以及运动员的训练项目的安排提供科学依据。同时还可以为与肌纤维有关的疾病例如肌萎缩等相关疾病的治疗,提供理论基础。

图8 Ⅱ型纤维低糖培养组MHC同功型mRNA检测
