3100例南昌地区女性宫颈高危人乳头瘤病毒的感染情况分析
2019-01-08邓潇谢彤
邓潇,谢彤
(江西省妇幼保健院体检中心,南昌 330006)
宫颈癌在中国女性生殖道恶性肿瘤中居第一位,是严重威胁妇女健康的疾病[1]。目前已经达成共识,持续的高危型人乳头瘤病毒感染最终导致了宫颈癌的发生[2]。为了解一般人群中高危型人乳头瘤病毒(HPV)感染状况,我们采用了14种高危型人乳头瘤病毒核酸检测技术(荧光PCR)进行了筛查。
1 资料和方法
1.1 临床资料 资料来源于2015年5月-2018年6月参与江西省妇幼保健院开展的“关爱母亲公益活动”的3100例女性,所有女性均自愿接受宫颈HPV筛查。所有女性年龄范围25-65岁,平均年龄(39.08±10.21)岁,纳入标准包括:有性行为史;筛查时未怀孕;无宫颈上皮内瘤变、子宫颈癌和子宫切除史。以25-29岁开始,之后每5岁为一个年龄段,到≥50岁组,分为6个年龄组。
1.2 仪器和试剂 利用SLAN-965全自动医用PCR分析系统进行检测,主要试剂由潮州凯普生物化学有限公司提供的高危型人乳头瘤病毒核酸检测试剂盒(荧光PCR法)。
1.3 标本采集与处理 充分暴露宫颈阴道部,用棉球轻轻蘸去过多的黏液;用HPV取样器尖端置入子宫颈口,顺时针方向旋转至少6-8周,以保证收集足够量的宫颈管内脱落细胞;取样后将取样器立即放入HPV保存瓶中,室温保存待检。
1.4 HPV检测步骤 用凯普宫颈细胞收集器采集宫颈细胞,采用HPV核酸扩增分型检测试剂盒,快速准确诊断妇女宫颈细胞样本中14种高危型HPV(HPV16,HPV18及 12种高危型 HPV包括HPV31,33,35,39,45,51,52,56,58,59,66,68, 后12中高危型HPV具体不分型)。
1.5 随访方法 针对HPV16阳性及HPV8阳性的女性,我们直接转诊电子阴道镜;其它12种高危HPV阳性的女性,我们进一步补充宫颈液基细胞学检查,宫颈细胞≥ASCUS的女性则补充电子阴道镜检查。针对病理报告宫颈低级别鳞状上皮内病变及慢性宫颈炎患者,我们给予一年一次的随访,直至患者的宫颈细胞检查及HPV检测结果均为阴性,回归正常筛查流程;对于宫颈高级别鳞状上皮内病变患者或宫颈腺上皮病变患者,根据临床指南进行治疗。
1.6 统计方法 统计不同年龄段女性的高危HPV感染率(各个年龄组中高危HPV阳性病例数/这一年龄组总人数×100%)。高危HPV各亚型感染率指该亚型单独或和其他亚型共同出现的感染率,多重感染重复计算。例如某患者检测结果为HPVl6、
HPV18二重感染,计算时分别在HPVl6、HPV18各计数1次。用SPSS 20.0软件进行统计学分析,计数资料采用χ2检验,以P<0.05为有统计学意义。
2 结果
2.1 HPV感染的型别分布 3100例妇女总的高危HPV感染率 11.22%(348/3100),HPV16型感染率为1.16%,HPV18感染率为0.52%,其它12种高危型HPV的感染率为9.55%。
2.2 HPV感染的年龄分布 25-29岁组的HPV感染率为9.67%(32/331),30-34岁组的HPV感染率为16.43%(70/426),35-39岁组高危HPV感染率为11.25%(62/551),40-44岁组高危HPV感染率为8.30%(43/518),45-49岁组高危 HPV感染率为 8.24%(52/631),≥50岁组高危 HPV感染率为 13.84%(89/643)。高危HPV感染的第一个高峰年龄组为30-34岁组,随之很快出现HPV感染率的下降,然后50岁之后,又出现了HPV感染的另一个高峰。经统计学分析,各年龄组间的高危HPV感染率存在统计学差异(χ2=26.89,P<0.05)。各年龄组的高危型HPV感染率见表1。进一步两两比较,30-34岁组的高危型HPV感染率高于40-44岁组(χ2=14.665),30-34岁的高危型 HPV 感染率高于45-49岁组 (χ2=16.712),50岁以上组的高危型HPV 感染率高于 40-44岁组(χ2=8.738),50-65岁组的高危型HPV感染率高于45-49岁组 (χ2=10.149),以上差异均有统计学意义(P<0.05)。
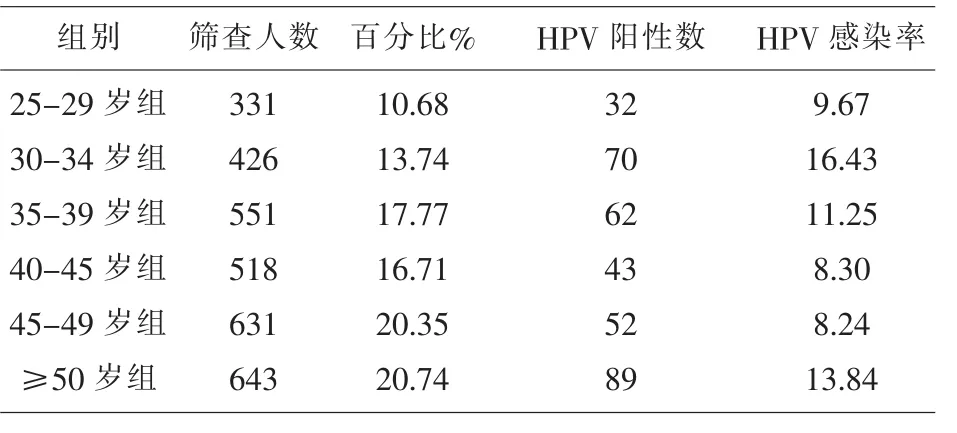
表1 各年龄组高危HPV感染的情况
3 讨论
HPV是一组双股DNA病毒,目前确定的HPV型别约有200余种,其中约40余种可感染人类[3]。依据HPV型别与癌发生危险性的高低分为低危型HPV与高危型HPV[4]。然而,90%发生HPV感染的女性可自然清除,只有少部分发生持续感染,进而进展为可检出的宫颈癌前病变,此过程通常需要数十年。因宫颈癌的病因明确,一级和二级预防技术也很成熟,宫颈癌正成为可防可控的疾病。宫颈癌的一级预防措施主要是注射HPV疫苗,运用安全有效的HPV疫苗可从根本上阻断HPV传播,是最有效的宫颈癌预防措施,而HPV预防性疫苗不含病毒DNA,无传染性,因此不会引发因接种疫苗而导致的HPV感染[5]。
宫颈癌的二级预防措施是宫颈癌和宫颈癌前病变的筛查。宫颈细胞学检查作为宫颈癌的重要筛查手段,在降低宫颈癌的发病率和病死率方面起到了重要作用。同时也应看到细胞病理学具有一定局限性,它主要依靠观察细胞形态变化诊断疾病,看不到组织结构,不能观察肿瘤和周围组织的关系,具有一定误诊率。Ronco G等[6]的研究证实,HPV DNA检测作为宫颈癌初筛方法,其灵敏度可达90%以上。2011年,欧洲生殖器官感染和肿瘤研究组织(EUROGIN)提出初筛应用HPV分型检测与应用细胞学检查比较,能发现更多的高级别子宫颈上皮内瘤变[7]。2014年,在子宫颈癌筛查方面有了重大的改革,WHO提出用HPV分型检测作为子宫颈癌筛查的初筛方法。
中国女性有着较高的HPV感染率,Franceschi S等[8]的研究表明,中国HPV世界人口标化感染率为15.9%,与韩国、印度等亚洲国家相近。李霓等[9]的一项多中心横断面研究显示,2374例中国女性的高危型HPV感染率为12.1%。本研究显示,3100名受试女性高危HPV感染率为11.23%,与李霓等的研究结果接近。虽然从感染HPV病毒到发生宫颈癌前病变、宫颈癌需要较为漫长的过程,然而,较高的HPV感染率,预示着中国女性患宫颈癌前病变甚至宫颈癌的风险较大。同时,HPV的流行和型别分布有地域差异、城乡差异。岑尧等[10]的一项meta分析显示,高危型HPV在中国南方地区的平均感染率为14.81%,中国北方地区为41.57%,两者的差异有统计学意义。本研究中,受试人群的高危型HPV感染率偏低,可能与我市属南方地区的省会城市,经济条件较好,受试人群文化程度较高,日常卫生习惯良好有关。同时,本研究显示,各年龄组间的高危HPV感染率存在统计学差异。分析原因,我们认为年龄、免疫功能、性生活开始的年龄都对高危HPV病毒感染率产生了影响,也需要我们今后加强流行病学调查来阐明高危HPV病毒感染率的影响因素。
Sanjose等[11]研究发现,女性生殖道HPV感染的高峰年龄为18-30岁,表现为25岁以前感染率高达25%,30-40岁感染率下降,绝经后HPV感染率再次直线上升,高达22%。本研究显示受试女性高危型HPV感染的第一个高峰年龄是30-34岁(感染率为16.43%),随后高危型HPV感染率逐渐下降,到了50岁以后又出现另一个感染高峰(感染率为13.84%)。我们研究组的第一个高危型HPV感染高峰出现较Sanjose研究中的第一个感染高峰晚,分析原因,可能与国内外女性开始性生活的起始年龄不同有关。同时,针对50岁以后出现的第二个HPV感染高峰,我们认为可能是随着年龄增加,围绝经期女性的免疫力下降,生殖道粘膜上皮变得菲薄,女性更容易感染病毒有关。
此外,本研究显示HPV-16型感染率为1.16%,HPV-18感染率为0.52%,HPV-16的感染率高于HPV-18的感染率,其它12种高危型HPV的感染率为9.55%。由于其它12种高危型HPV具体不分型别,因此,本研究无法明确其它型别HPV的具体感染率,这是本研究的一个局限。
总之,本研究揭示了江西南昌地区女性的大样本宫颈HPV感染现况及年龄特点,为南昌地区宫颈癌的二级预防提供了必要的流行病学数据,对宫颈癌疫苗的接种工作具有一定的参考意义。
