HPLC法测定盐酸度洛西汀肠溶胶囊有关物质
2019-01-07徐豪丁云晖张英邱明丰
徐豪丁云晖张英邱明丰
1上海交通大学药学院 (上海 200240) 2上海上药中西制药有限公司 (上海 201806)
度洛西汀由美国Eli Lilly公司[1]首先开发上市,通常以盐酸盐的形式被使用,度洛西汀现已广泛用于治疗重度抑郁症、广泛性焦虑障碍、糖尿病周围神经痛、纤维肌痛、慢性肌肉骨骼疼痛,以及妇女中至重度应激性尿失禁症[2]。度洛西汀抑制中枢神经系统中5-羟色胺和去甲肾上腺素(NE)的再摄取。度洛西汀通过抑制去甲肾上腺素再摄取泵(NET),使多巴胺(DA)在前额叶皮质增加,而多巴胺再摄取泵很少,因而它被认为能够介导多巴胺和去甲肾上腺素的再摄取[3]。度洛西汀对多巴胺能、胆碱能、组胺能、阿片类、谷氨酸和GABA再摄取转运蛋白没有明显的亲和力,因此被认为是5-羟色胺和去甲肾上腺素转运体的选择性再摄取抑制剂。度洛西汀代谢广泛,但主要循环代谢产物不具有显著的药理活性[4,5]。
文献资料表明,关于盐酸度洛西汀肠溶胶囊临床研究的文章较多,但关于其制剂产品检验方法的研究较少。本研究拟建立一个检测时间短且使用的溶剂相对环保的度洛西汀有关物质的检测方法。
1 材料与方法
1.1 仪器与试药
1100及1200型高效液相色谱仪、紫外检测器、1200型DAD检测器(图像二极管陈列检测器)和色谱工作站,安捷伦科技有限公司;AL 104电子天平,梅特勒-托利多国际有限公司。
盐酸度洛西汀工作用对照品(批号:20170509,含量 99.86%);α-萘酚(杂质Ⅲ),批号为 20160628;(3s)-N-甲基-3-(1-萘氧基)-3-(3-噻吩基)丙胺[杂质Ⅴ(3-异构体)],批号为 RO32WO,USP 标准品;(s)-4-{甲基[3-(1-萘氧基)-3-(2-噻吩基)丙基]氨基}-4-氧代丁酸 [杂质Ⅷ(N-琥珀酰度洛西汀)],批号为RO32XO,USP标准品;盐酸度洛西汀肠溶胶囊,自制,批号为 T170901,T170902,T171001 及 T171002。
甲醇,色谱纯,赛默飞世尔科技(中国)有限公司;盐酸(分析纯)、氢氧化钠(分析纯),永华化学科技(江苏)有限公司;磷酸二氢钾(分析纯)、磷酸(分析纯)、三乙胺(分析纯)、氢氧化钾(分析纯)、四氢呋喃(色谱纯),国药集团化学试剂有限公司;纯化水。
1.2 方法
1.2.1 色谱条件
色谱柱:ZorbaxSB-C8(4.6mm×75mm,3.5 μm)或效能相当的色谱柱,辛烷基硅烷键合硅胶为填充剂;流动相:磷酸盐缓冲液(取磷酸二氢钾3.4 g与三乙胺15 mL,加1 000 mL水使其溶解,用磷酸调节pH至 5.5)-甲醇-四氢呋喃(体积比为 587∶323∶90);流速:1.5 mL/min;紫外检测波长:230 nm;进样量:10 μL;柱温:45℃;出峰顺序:度洛西汀峰、杂质Ⅴ峰、杂质Ⅲ峰与杂质Ⅷ峰;理论板数:不低于2500。
1.2.2 溶液配制
(1)溶剂
取流动相1000 mL,加入60%氢氧化钾溶液10 mL,摇匀,调节pH至10.0。
(2)供试品溶液
临用新制。取本品内容物适量(约相当于度洛西汀100 mg),置于100 mL量瓶中,加溶剂适量,机械振摇至分散均匀,再超声10 min使溶解,放冷;用溶剂稀释至刻度,摇匀,离心,取上层清液滤过;精密量取续滤液5 mL,置于50 mL量瓶中,用溶剂稀释到刻度,摇匀,作为供试品溶液。
(3)灵敏度溶液
精密量取供试品溶液1 mL,置于100 mL量瓶中,用溶剂稀释至刻度,摇匀,精密量取5 mL稀释液置于100 mL量瓶中,用溶剂稀释至刻度,摇匀,作为灵敏度溶液。
(4)系统适用性溶液
取盐酸度洛西汀对照品约11 mg、杂质Ⅴ对照品约1.0 mg、杂质Ⅲ对照品约5.0 mg、杂质Ⅷ对照品约2.5 mg,同置于100 mL量瓶中,加甲醇1 mL使溶解,用溶剂稀释至刻度,摇匀,作为系统适用性溶液。1.2.3 专属性实验
(1)样品
称取对照品适量 (约相当于盐酸度洛西汀22.4 mg),置于200 mL量瓶中,加入处方量的辅料。
酸破坏试验:加入1 mL 2 mol/L的盐酸溶液,放置2 h,加2 mol/L的氢氧化钠溶液调pH至中性,作为酸破坏试验样品。
碱破坏试验:加入1 mL 2 mol/L的氢氧化钠溶液,放置5 h,加2 mol/L的盐酸溶液调pH至中性,作为碱破坏试验样品。
氧化破坏试验:加入1 mL 30%双氧水,放置5 h,作为氧化破坏试验样品。
光照破坏试验:在4 500 lx下照射22 h,作为光照破坏试验样品。
高温破坏试验:在100℃下加热5 h,作为高温破坏试验样品。
上述样品均加溶剂适量,机械振摇至分散均匀,再超声处理10 min使溶解,放冷,用溶剂稀释至刻度,摇匀,离心,滤过,取续滤液进样,记录色谱图。
(2)空白辅料
取空白辅料适量,置于100 mL量瓶中,采用上述样品专属性试验方法,对空白辅料用强光照射、高温、酸水解、碱水解和氧化的方法进行加速破坏,处理后的样品取续滤液进行高效液相色谱(HPLC)分析,以研究辅料是否干扰样品有关物质的检查。
2 结果与讨论
2.1 方法学考察
2.1.1 检测波长的选择
取系统适用性溶液,进行DAD扫描,结果表明各杂质和盐酸度洛西汀均在230 nm处有最大紫外吸收,故选择230 nm为紫外检测波长。
2.1.2 系统适用性试验
取系统适用性溶液进样测定,在上述色谱条件下,理论板数按度洛西汀计为6 255,度洛西汀峰与杂质Ⅴ峰、杂质Ⅲ峰及杂质Ⅷ峰之间的分离度分别为 2.32,3.36 和 11.48。
2.1.3 辅料干扰
空白辅料在主峰之前出峰,不干扰主药的测定。
2.1.4 检测限与定量限
精密称取盐酸度洛西汀、杂质Ⅲ及杂质Ⅷ对照品,分别稀释后进样测定,按信噪比S/N=3±1计算检测限,按信噪比S/N=10±1计算定量限(见表1)。由表1可知,杂质Ⅲ,杂质Ⅷ及盐酸度洛西汀的检测限分别为 0.940,2.392,0.050 ng/mL,定量限分别为2.400,8.320,2.171 ng/mL。

表1 定量限与检测限
2.1.5 线性关系
精密称取盐酸度洛西汀对照品适量,加溶剂适量使其溶解;分别精密称取杂质Ⅲ与杂质Ⅷ对照品适量,用1 mL甲醇溶解。用溶剂稀释成数个不同质量浓度的供试品溶液。精密吸取10 μL注入液相色谱仪中测定,结果见表2。
度洛西汀的质量浓度与峰面积在38.8~155.2 μg/mL(r=1.0000,n=8)内线性关系良好,而杂质Ⅲ和Ⅷ的质量浓度与峰面积分别在0.08~0.33 μg/mL(r=0.9999,n=8) 和 0.08~0.32 μg/mL(r=0.9997,n=8)内呈良好的线性关系。
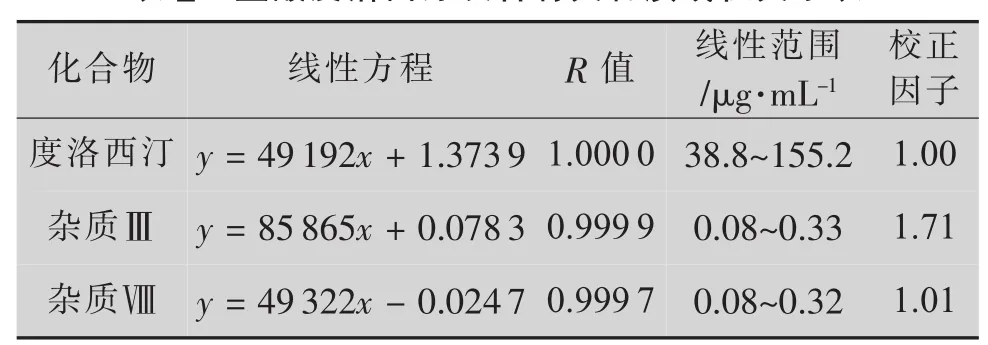
表2 盐酸度洛西汀及各有关物质线性关系表
2.1.6 校正因子
以表2中的线性方程计算杂质Ⅲ和Ⅷ相对于盐酸度洛西汀的校正因子,结果显示:杂质Ⅲ与杂质Ⅷ的校正因子均在0.2~5.0之间,但杂质Ⅲ的校正因子在0.9~1.1之外[6](表2)。故可以采用加校正因子主成分自身对照法计算不在范围内的杂质Ⅲ的含量,相对校正因子可确定为1.7。
2.1.7 重复性试验
取同一批样品的供试品溶液、对照溶液各6份进行HPLC测定,经计算杂质总量平均为0.08%,相对标准偏差(RSD)为2.9%,具有良好的重复性。
2.1.8 稳定性试验
取同一批号供试品溶液,在 0,4,8,12,16,20,24 h时进样测定,考察供试品中主峰峰面积的稳定性。结果表明供试品溶液在24 h内主峰没有降解,溶液基本稳定(见表3)。

表3 稳定性试验结果
2.1.9 回收率试验
精密称取盐酸度洛西汀对照品适量,按处方量加入辅料,加溶剂溶解并稀释至相关对照物质溶液质量浓度(20%为基准)的80%,100%,120%。精密称取杂质Ⅲ、杂质Ⅷ对照品适量,按处方量加入辅料,加1 mL甲醇溶解,并用溶剂分别稀释至相关对照物质溶液质量浓度(20%为基准)的40%,60%,80%,100%,120%,140%及 160%。精密量取 10 μL注入液相色谱仪中,按外标法以峰面积计算杂质Ⅲ,杂质Ⅷ及盐酸度洛西汀的测得量和回收率,结果见表4。由表4可知,杂质Ⅲ,杂质Ⅷ与盐酸度洛西汀的RSD分别为0.64%,1.62%和0.70%,表明3种物质的回收率良好。
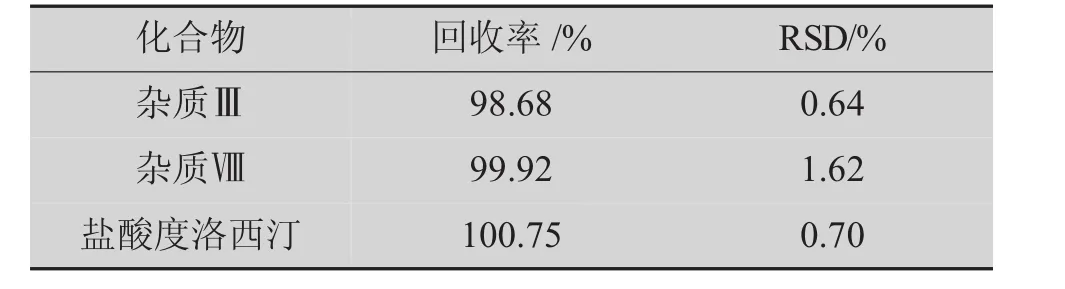
表4 回收率及RSD结果汇总
2.1.10 专属性试验
对破坏后的样品进行HPLC分析,结果(见表5)表明:盐酸度洛西汀肠溶胶囊在酸、氧化破坏中有明显降解,在碱、光照和高温条件下表现较稳定;各破坏条件下物料守恒,产生的杂质峰能与主峰有效分离,经破坏后的空白辅料溶液均不干扰样品中杂质的检测。说明该色谱条件专属性较强,可有效检出各破坏的杂质。
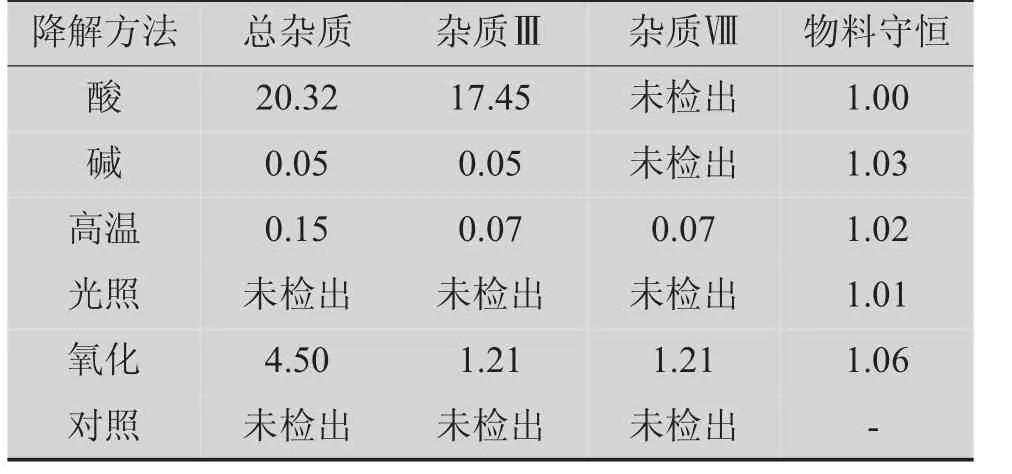
表5 各强制降解试验杂质含量 %
2.1.11 耐用性试验
取同一批供试品溶液各 10 μL,分别于1.4,1.5,1.6 mL/min流速下进样,测定的有关物质结果分别为0.05%,0.06%,0.06%;在流动相V(磷酸盐缓冲液):V(甲醇):V(四氢呋喃)分别为 575∶335∶90,587∶323∶90 与 600∶310∶90 的条件下进样,所测定的有关物质结果分别为0.07%,0.06%及0.06%;将色谱柱更换为DikmaInertsilC8(4.6 mm×75 mm,3 μm),测定的有关物质结果为0.05%。上述试验结果表明该方法的系统耐用性良好。
2.2 有关物质的检测
按自身对照法检测并计算4批样品中有关物质的含量,结果如表6所示。由表6可以看出,4批样品中杂质Ⅲ和Ⅷ的含量均小于0.20%,总杂质含量均小于0.4%。

表6 4批样品有关物质测定结果
3 结论
(1)盐酸度洛西汀在氧化、强酸条件下容易降解;在强碱、高温、光照条件下相对比较稳定,降解样品的主峰峰纯度符合要求,且质量守恒在90%~110%之间。
(2)杂质Ⅲ和杂质Ⅷ是盐酸度洛西汀的主要降解产物,该降解易受酸和氧化等条件的影响。
(3)对度洛西汀有关物质的检查方法进行方法学验证,结果表明该方法能较好地分离杂质峰与主峰,并能够定量杂质。该色谱条件系统适用性、精密度、专属性、线性、溶液稳定性均良好。该方法样品前处理简单、分析仪器普及率高,检测简便、快速、准确、灵敏度高,验证内容符合药品质量标准分析方法验证指导原则附录[7],且验证数据准确可靠,能够客观地反映制剂中的杂质情况,适用于盐酸度洛西汀肠溶胶囊的质量控制。
