体重波动对小鼠血糖水平的影响
2019-01-07宗艾伦周迎生
宗艾伦,周迎生
(首都医科大学附属北京安贞医院内分泌代谢科,北京市心肺血管疾病研究所 北京 100029)
肥胖导致血糖升高和糖尿病,限食(diet restriction)减重能延缓和降低2型糖尿病发生、发展[1-4]。既往研究表明,肥胖者限食减重5%以上可显著改善血糖水平和胰岛素敏感性[5],减重超过10%且维持1年以上才能使身体真正获益,而30%~60%减重者不能坚持1年[3]。体重波动(weight cycling)现象在肥胖减重过程中容易发生,即限食减重止于高热量饮食增重,不断重现,称为溜溜球瘦身(Yo-yo dieting)[6]。关于体重波动对糖代谢和肥胖影响的报道有差异,多数认为对糖尿病发病和体内脂肪分布没有影响[6-8]。我们既往研究发现高热量饮食导致肥胖和葡萄糖代谢异常[9],限食减重能够逆转代谢异常[10]。 体重波动的基本形式为肥胖减重后高热量饮食增重,体重、糖代谢及胰岛素敏感性如何变化对肥胖和糖尿病防控机制研究有实践意义。 本研究拟通过饮食干预小鼠体重探索体重波动响血糖水平变化的规律特点。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF/VAF级C57BL/6小鼠为8周龄,雄性,54只,体重22~25 g,由北京维通利华实验动物技术有限公司提供【SCXK(京)2016-0011】,首都医科大学附属北京安贞医院心肺血管疾病研究所实验动物科学部【SYXK(京) 2016-0027】完成小鼠饲养及部分相关实验内容。动物正常饮食、进水,饲养环境安静、舒适,12/12 h昼夜规律,饲养温度恒定在22~26℃,空气湿度维持在60%~70%。所有操作均符合实验动物伦理学要求(伦理审批号:AEEI-2017-107)。
1.1.2 试剂与仪器
戊巴比妥钠(Sigma-Aldrich公司,美国),10%中性福尔马林固定液(北京化工厂),苏木素、伊红(北京中杉金桥公司),环保型透明脱蜡液(无锡市江原公司),无水乙醇、浓盐酸、冰醋酸(北京化工厂),中性树胶(北京索莱宝公司),25%葡萄糖注射液(中国大冢制药有限公司),生物合成人胰岛素(Eli Lilly公司,美国),0.9%氯化钠溶液(北京华润双鹤公司);电子天平(AL204,Mettler Toledo公司,瑞士),全自动组织脱水机(TP1020,Leica公司,德国),石蜡包埋机(EG1150 H,Leica公司,德国),石蜡切片机(RM2235,Leica公司,德国),烤箱(GZX-9023 MBE,上海博讯公司),显微镜(ECLIPSE 80i/90i,Nikon公司,日本),血糖仪(ContourTMTS,Bayer公司,德国),4℃/-20℃/-80℃冰箱(中国海尔集团公司)。
1.2 方法
1.2.1 实验分组
本实验分三组,每组18只;(1)对照组,普通饲料喂养;(2)肥胖组,高热量饲料喂养;(3)干预组,高热量饲料—60%普通饲料—高热量饲料交替喂养。
1.2.2 体重波动模型建立
参考前期研究建立饮食诱导肥胖小鼠模型[10-11]。高热量饲料(D12492, Research Diets公司,美国)为蛋白质、碳水化合物、脂肪热占比20%、20%、60%,喂养8周(体重达到稳定,即三次体重结果间无统计学差异)后呈肥胖模型(体重>35%对照组[10,12]),随机分入体重干预组(intervention group, IT,n=18)和肥胖组(obesity group, OB,n=18)。对照组(control group,CON)则为普通饲料(蛋白质、碳水化合物、脂肪热占比20%、70%、10%)喂养。体重干预方式为给予60%对照组食量【干预组食量=正常对照组每日摄食量(前3 d平均值)×60%】的普通饲料喂养4周,使其体重下降至同CON组的差异无显著性(P>0.05),此后即恢复高热量饲料喂养3周,直至体重恢复增长到与OB组体重的差异无显著性(P>0.05)时为止。在实验进程中,每周定时禁食12 h称重一次,并用血糖仪(ContourTMTS,Bayer公司,德国)采鼠尾静脉血测定空腹血糖一次。以相邻两周间体重变化量计算体重增长率,以相邻两周间空腹血糖变化量计算空腹血糖增长率。体重增速计算按体重变化量/变化对应时间(周),血糖增速计算按血糖变化量/变化对应时间(周)。
1.2.3 葡萄糖耐量试验(IPGTT)
参考前期研究建立方法[13]行腹腔注射葡萄糖耐量试验(IPGTT)。在干预终点时,小鼠禁食不禁饮水16 h,鼠尾静脉取血测定空腹血糖。小鼠腹腔注射25%葡萄糖溶液给予糖负荷(2 g/kg)。血糖仪(ContourTMTS,Bayer公司, 德国)测定糖负荷后 15、30、60、120 min各点血糖,绘制血糖变化曲线,计算血糖曲线下面积(AUC)并进行统计分析。
1.2.4 胰岛素耐受试验(ITT)
按既往研究方法胰岛素敏感性由胰岛素耐受试验(insulin tolerance test,ITT)反映,即小鼠禁食不禁饮6 h后,按体重腹腔注射人短效胰岛素(0.75 mU/g,Eli Lilly,美国),分别测定注射前、注射后 15、30、60 及 120 min 血糖水平,绘制血糖变化曲线,计算血糖曲线下面积(AUC)并进行统计分析。
1.2.5 体内脂肪及代谢参数测定
目前,ISO/IEC17025:2005[11]以及 GB/T 27025-2008[12]中均要求检测实验室具有评价测量不确定度的程序,能够对检测项目的不确定度作出正确评估,满足客户及检测工作的要求。测量不确定度在实验室数据比对、方法确认、标准设备校准、量值溯源以及实验室质量控制与管理等方面具有重要的意义。本研究根据 JJF1059.1-2012[13]、CNAL /AG06:2003[14]技术规范的要求,对HPLC-ICP-MS技术测定牛黄解毒片中砷元素形态的不确定度进行了分析,以期为这方面研究提供参考。
小鼠禁食过夜,腹腔注射1% 戊巴比妥钠麻醉(80 mg/kg)。麻醉后充分伸展,测量体长、体重和腹围等基础信息。内脏脂肪测定,参考文献[14],完整剪取双侧附睾脂肪、双侧肾周脂肪及重要器官组织,迅速称量湿重。内脏脂肪比例按(双侧肾周脂肪质量+双侧附睾脂肪质量)/体重计算。
1.2.6 胰腺HE染色
腹腔注射1% 戊巴比妥钠麻醉后处死小鼠,获取胰腺组织,甲醛固定24 h,脱水后石蜡包埋(EG1150 H,Leica公司,德国)。包埋时使得组织切面向下并沉至石蜡底部,以便切取完整截面。石蜡切片制备:将包埋盒冻存在-20℃冰箱内,切片前取出放置在冰上,切片厚度参考文献[15],6 μm,调整切片刀口位置,尽量切取完整组织。切片室温下30%乙醇中展片时间 2~3 min后,42℃温水展片5~10 s。贴片时在80℃烤箱内烤100 min,以防止组织后续染色中脱落。此后,石蜡切片脱蜡、苏木素染色30 s、分化、伊红染色10 s,透明1 h后中性树胶封片观察。显微镜400倍视野下拍照。每组6只小鼠,每只小鼠随机选取10张切片(每张切片至少间隔200 μm,避免重复测量相同胰岛)。选择随机切片中所有胰岛,应用 Image J 图像分析软件测算胰岛照片面积。手工圈定胰岛在照片中轮廓,软件measure功能自动统计圈定面积中像素单位数量,使用像素单位代替胰岛面积,至少重复3次,取平均数。计算胰岛面积均数和标准差,分析比较三组间胰岛面积。
1.3 统计学方法
正态分布数据用均值±标准差表示,两组均数比较采用t检验,多组间比较为单因素方差分析。计数资料用率表示,采用卡方检验分析。应用SPSS 16.0软件进行数据统计学分析P< 0.05为差异有统计学意义。
2 结果
2.1 高热量饲料喂养的小鼠体重增长率较对照组显著增加
8周龄C57BL/6小鼠经高热量饲料喂养2周起,体重超过CON组(24.8±2.7 g vs 21.5±1.7 g,P<0.05),至第8周时肥胖(体重>正常对照35%),超出CON组44%(36.3±2.3 g vs 25.3±1.9 g,P<0.001),体重增长率为对照组的1.62倍(6.3%±3.2% vs 3.9%±1.2%,P<0.05),如图1 A、B所示。能量摄入较对照组增加了23.9%(68.3±2.1 vs 52.0±1.7 KJ/d,P<0.001)。
2.2 肥胖小鼠限食干预减重显著,恢复高热量饲料喂养则体重增长更快
2.3 体重波动对糖代谢和胰岛素敏感性的影响
体重和空腹血糖水平均在高热量饲料喂养2周后超过CON组(P<0.05),升高到第8周达到稳态,空腹血糖平均增长率显著高于CON组(15.2%±4.0% vs 1.7%±1.0%,P<0.05)(如图1C、D所示),是同期体重增速的2.41倍。限食干预后第1周,IT组体重和空腹血糖下降,与OB组差异有显著性(P<0.05),但体重平均降幅显著低于血糖变化(33.4% vs 113.1%,P<0.05)。第2次高热量饲料喂养时,空腹血糖增速是第1次喂养的5.13倍,高于体重2.27倍。实验终点时,IT组IPGTT血糖曲线下面积较OB组显著增加12.8%(P<0.05),表现为葡萄糖耐量受损,如图2 A、B所示。ITT血糖曲线下面积较OB组显著升高(P<0.01),为胰岛素敏感性降低,差异有显著性(P<0.05),如图2C、D所示。
2.4 体脂和胰岛面积改变
实验终点时IT组内脏脂肪比例、肾周脂肪、附睾脂肪和肝质量均较OB组升高,差异有显著性(P<0.05),但空腹血糖、体重、胰腺重量与OB组相比,差异无显著性(P>0.05),如表1所示。 IT组胰岛面积较OB组显著缩小(P<0.05),但同CON组的差异无显著性(P>0.05),如图3所示。

注:A. 小鼠体重变化;B. 体重变化百分比; C. 小鼠空腹血糖变化; D. 空腹血糖变化百分比。图1 饮食影响小鼠体重及空腹血糖变化Note. A. Change of body weight in mice. B. Percent change in body weight. C. Change of fasting blood glucose in mice. D. Percentage change in fasting blood glucose.Figure 1 Diet affects body weight and fasting blood glucose changes in mice
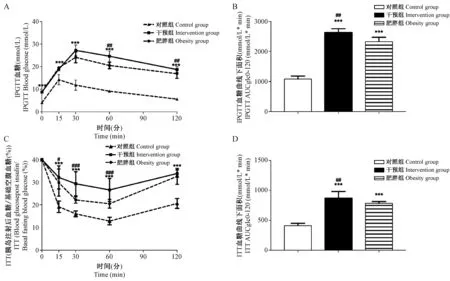
注:A、B. IPGTT实验中对照组、肥胖组及干预组血糖水平及血糖曲线下面积。C、D. ITT实验中对照组、肥胖组及干预组血糖水平及血糖曲线下面积。图2 体重波动对葡萄糖耐量和胰岛素敏感性的影响Note. A, B. IPGTT blood glucose levels and the area under the blood glucose curve in the control group, obesity group, and intervention group. C, D. ITT blood glucose levels and the area under the blood glucose curve in the control group, obesity group, and intervention group.Figure 2 Effect of body weight fluctuation on glucose tolerance and insulin sensitivity

分组Groups体重(g)Body weight(g)空腹血糖 (mmol/L)Fasting blood glucose (mmol/L)肾周脂肪(mg)Perirenal fat weight(mg)附睾脂肪(mg)Epididymal fat weight(mg)对照组Control group29.9±1.45.0±0.7154.8±53.2355.7±44.3干预组Intervention group49.5±1.7***8.6±0.6***730.8±105.6***#2800.0±149.1***##肥胖组Obesity group49.3±1.9***9.1±0.4***514.9±197.9***2399.8±343.8***分组Groups内脏脂肪比例(%)Visceral fat weight/Body weight(%)胰腺质量(mg)Pancreas weight(mg)肝质量(mg)Liver weight(mg)腹围(cm)Abdominal circumference(cm)对照组Control group1.7±0.3181.8±24.21140.7±67.17.3±0.3干预组Intervention group7.1±0.3*** ##331.7±45.2***2065.2±243.7*** #10.9±1.5***#肥胖组Obesity group5.9±1.0***345.7±76.0***1708.0±422.4**9.7±0.6**
注:与对照组CON比较,*P<0.05,**P<0.01,***P<0.001。与肥胖组 OB 比较,#P< 0.05,##P< 0.01,###P<0.001。
Note.Compared with the control group(CON),*P<0.05,**P<0.01,***P< 0.001. Compared with the obesity group (OB),#P<0.05,##P<0.01,###P<0.001.
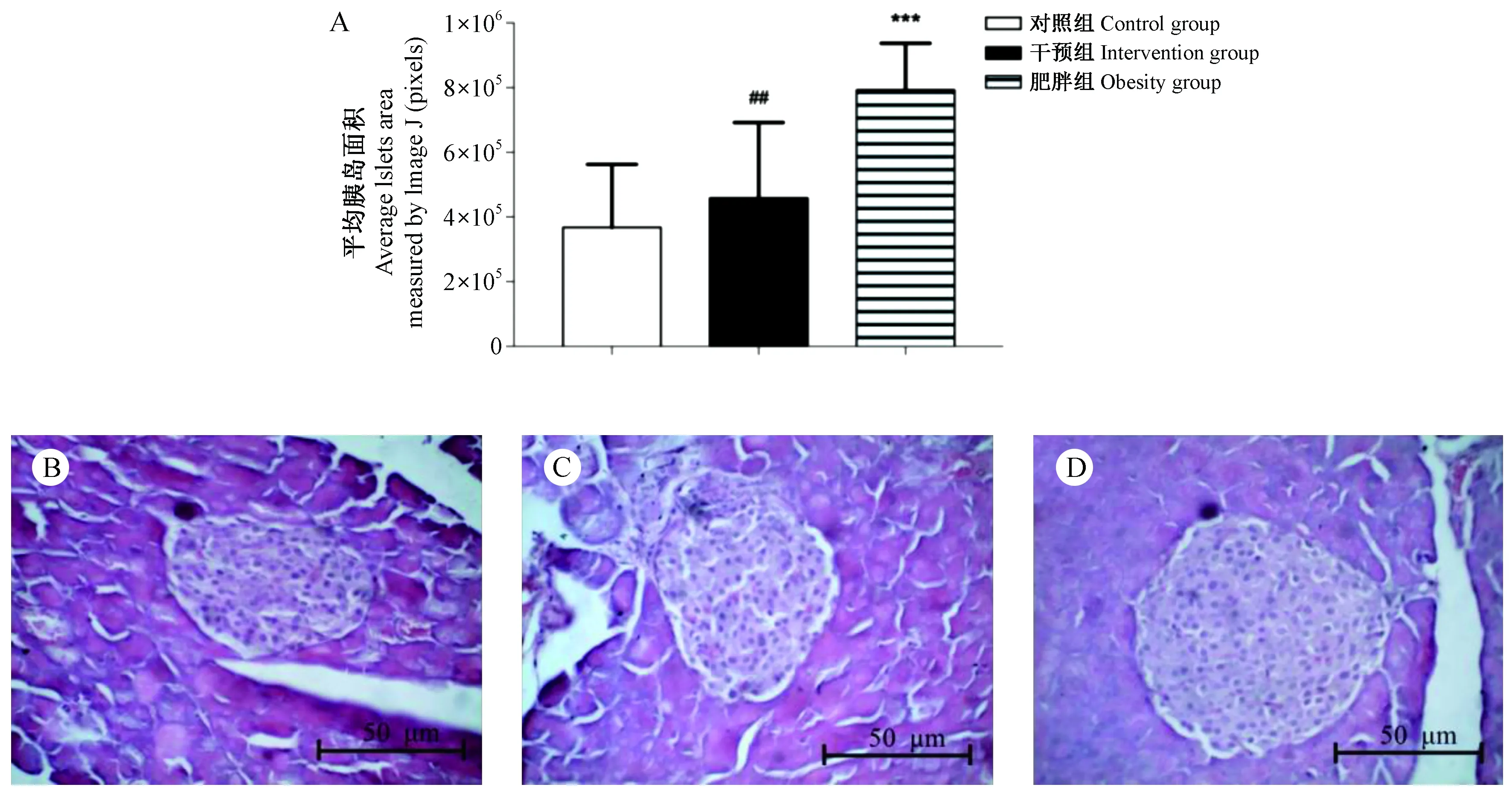
注:A. 三组胰岛面积比较。B. 对照组胰岛大小正常,形态规则,外分泌腺结构完整。C. 干预组胰岛较持续肥胖组显著减小,形态欠规则,外面分腺结构完整性差。D. 肥胖组胰岛大小较正常对照组显著增大,形态尚规则,外分泌腺结构完整。图3 小鼠胰腺病理(HE染色,×400)Note. A. Comparison of the three groups of islets. B. The islets of the control group were normal in size, regular in morphology, and the exocrine glands were intact. C. The islets of the intervention group were significantly reduced compared with those in the obesity group, the shape was not regular, and the structural integrity of the outer gland was poor. D. The islet size of the obesity group was significantly increased compared with that in the control group, the shape was regular, and the exocrine gland structure was intact.Figure 3 Pathology of the mouse pancreas(HE staining,×400)
3 讨论
本研究初始阶段为高热量饲料喂养肥胖,小鼠体重增长率低于其空腹血糖增长,其变化也晚于血糖,血糖水平的变化相比体重变化更快且敏感,这与既往文献报道一致[9-10];Magkos等[5]研究也表明体重变化5%即可显著改善血糖等代谢指标。血糖变化早于体重变化出现,且变化幅度更大。在此后的限食减重阶段,体重和血糖均相伴降低,分别减少35%和46%,血糖降幅更大但血糖值仍在正常低限3.9 mmol/L以上。而人肥胖减重干预使体重和血糖降低幅度相近[5],这可能与动物实验研究中可以准确控制限食量有关。因此,血糖升高变化要优于体重改变,更适合反映体重增长趋势。在本研究最后阶段是停止限食恢复高热量饲料饲养,小鼠体重及空腹血糖增长率均比第一阶段更快,体重为第一阶段的2.3倍,空腹血糖为5.1倍。因此,在减重终止后,体重和血糖均有较快增长且变化幅度大,必须要增加监测的频率才能更有效反映代谢指标变化。国外学者也有相似的报道,认为减重后高热量饲料喂养加速体重和脂肪量增速达1.6倍,这与摄食量增加和肠道细菌环境改变有关[7, 16~18]。
本研究中体重波动的肥胖小鼠(IT)腹腔内脂肪量与肥胖对照组(OB)相比显著增加,胰岛素敏感性下降,胰岛面积显著缩小,糖耐量受损更加严重。腹腔内脂肪量增加使胰岛素敏感性下降,进而影响葡萄糖代谢,血糖水平显著升高[16]。有研究显示体重波动可显著增加内脏脂肪含量,使脂肪分布更偏向中心型肥胖,肝脂肪沉积加重[8]。因体重波动可以显著增加内脏脂肪量,对胰岛素敏感性和葡萄糖代谢影响较大,内脏性肥胖及代谢异常应该受到更多关注。
关于体重波动对血糖及糖尿病发病的影响是国内外研究热点,目前体重波动对于糖尿病发病是否有不良影响报道不同[16-20]。本研究通过实验动物模型,在严格的实验条件下通过高热量、低热量摄食干预诱导小鼠体重波动,提出体重波动导致内脏脂肪量增加、胰岛素敏感性降低、葡萄糖耐量受损的实验证据,将为肥胖治疗和糖尿病防控提供理论依据。
