PLCζ对小鼠圆形精子细胞注射后卵母细胞受精及胚胎发育的影响
2019-01-07李冬宏郭玉佳林晨陈杏婷
李冬宏,郭玉佳,林晨,陈杏婷
(福建医科大学附属第一医院生殖医学中心,福州 350005)
1992年,Palermo等[1]成功应用卵细胞浆内单精子注射(intracytoplasmic sperm injection, ICSI)治疗严重少弱精子症病人以来,ICSI在治疗男性严重少弱精子症取得了重大治疗进展。随后,Devrogy等[2]发现有些无精子症患者的睾丸中存在少量精子,将这些精子应用于ICSI,获得临床妊娠成功。然而,仍有部分无精子症患者无法产生正常的成熟精子,但可以从患者精液或睾丸活检标本中收集到单倍体圆形精子细胞(round spermatid, ROS)。1994年,Ogura等[3]报道了首例ROS受精的小鼠出生,验证了ROS与成熟精子具有同样的受精和发育潜能。1995年,Tesarik等[4]从无精子症患者的精液中获得圆形精子细胞,将其注入卵子后,成功出生了2名正常的婴儿。圆形精子细胞注射(round spermatid injection, ROSI)获得了成功,预示着无精子症且无法产生正常成熟精子的患者也能拥有自己的遗传学后代。ROSI技术得以迅速发展,并且获得了一些成功案例的报道[5-7]。但ROSI的受精率、妊娠率极低,其影响主要为:圆形精子细胞、卵母细胞激活及遗传学等因素。因此,本研究将采用磷酸酯酶Cζ(phospholipase C zeta, PLCζ)作为ROSI后小鼠卵母细胞激活的激活剂,探讨PLCζ作为激活剂的可行性及对ROSI后卵母细胞受精及胚胎发育的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级KM小鼠,雄鼠10只,雌鼠30只,鼠龄6~8周,体重25~30 g,购自于闽侯县吴氏实验动物贸易有限公司【SCXK(闽)2017-0002】,饲养于福建医科大学实验动物中心【SYXK(闽)2017-0014】,饲养环境湿度恒定,温度(24±2)℃,适应性饲养一周后用于实验。本研究通过福建医科大学附属第一医院伦理委员会审批(2016038)。
1.1.2 实验试剂
表达质粒pCRII-TOPO(见图1)和人胚肾293T细胞(human embryonic kidney 293T cells,HEK293T)均购自BioVector质粒载体菌种细胞基因保藏中心;琼脂糖、质粒小提试剂盒、琼脂糖凝胶DNA回收试剂盒均购自天根生化科技有限公司;限制性内切酶BamHⅠ、XhoⅠ、TaKaRa LA Taq酶、1 Kbp DNA Ladder Marker、T4DNA连接酶均购自TaKaRa公司;QIAamp DNA Mini kit购自QIAGEN公司;jetPEI转染试剂试剂盒、胎牛血清(fetal calf serum,FCS)、培养基(Dulbecco’s modified Eagle’s medium,DMEM)、10% NuPAGE Bis-Tris Pre-cast Gel试剂盒(Invitrogen, UK)均购自诺斯蒂克(上海)医疗器械有限公司。
图1 真核表达质粒pCRII-TOPO DNA图谱Figure 1 The DNA map of eukaryotic expression vector pCRII-TOPO
1.2 方法
1.2.1 质粒pCRII-TOPO- PLCζ的构建、体外表达与鉴定
采集新鲜的小鼠睾丸组织,用Trizol法提取总RNA备用。根据GenBank(NCBI Reference Sequence: NM_054066.4)中PLCζ的基因序列,利用Primer Premier 5.0软件设计特异性引物,引物序列如下:上游引物ATGGATCCATGGAAAGCCAAC TTCATGA;下游引物CGCTCGAGAGTGAGAGACTT CATGGTTTG。上下游引物分别加入的酶切位点为BamHⅠ、XhoⅠ。其聚合酶链反应(PCR)的反应条件为:预变性95℃ 8 min、变性95℃ 45 s、退火55℃ 45 s、延伸72℃ 90 s、终延伸72℃ 5 min,30个循环。①采用基因重组技术构建真核表达质粒pCRII-TOPO- PLCζ。②采用jetPEI转染试剂试剂盒将构建好的真核表达质粒转染进HEK293T细胞。③将转染质粒后的HEK293T细胞转入含有FCS的DMEM中,并添加4 mmol谷氨酰胺,100 U/mL青霉素和0.1 mg/mL链霉素,置于5% CO2、37℃培养箱培养24 h后,将培养液改换成不含FCS的DMEM。④培养56 h后,收集HEK293T细胞;采用裂解液裂解细胞,10% NuPAGE Bis-Tris Pre-cast Gel试剂盒(Invitrogen, UK)纯化重组PLCζ蛋白。重组PLCζ蛋白经飞行质谱蛋白质组分析系统鉴定,并用免疫印迹法(Western blot)评价其抗原性,-80℃保存备用。
1.2.2 小鼠圆形精子细胞显微注射
(1)小鼠圆形精子细胞收集
取清洁级6~8周龄雄性KM小鼠双侧睾丸,剪碎后采用两步酶消化法制备细胞悬液,将处理好的细胞悬液用PBS液洗涤三次,每次670 r/min离心10 min,洗涤完后弃上清,用睾丸细胞培养液混悬后待用。非连续性Percoll梯度法:将Percoll梯度液配成浓度分别为45%、60%、90%浓度梯度;吸取1 mL 45% Percoll梯度液加入15 mL锥形离心管中,然后再依次吸取1 mL 60%和90%的Percoll梯度液深入离心管管底后分次缓慢加入;最后将制好的单细胞悬液加入到密度梯度液层的最上面;室温下,2184 r/min离心20 min;取最佳的梯度层用buffer液(1∶2)混匀;室温下,335 r/min离心8 min,弃上清混悬后待用。
(2)显微注射液的制备
将收集的小鼠圆形精子细胞与上述制备的重组PLCζ蛋白混合,配制成终浓度为10×10-3ng/L的混合液为实验组;另将小鼠圆形精子细胞与HEPES混合为空白组。将处理好的PLCζ激活剂与圆形精子细胞混合液在ROSI操作皿中制成微滴,其上方位置制作HEPES微滴,置于37℃培养箱加热预平衡1 h。
(3)小鼠卵母细胞获取
选取清洁级6~8周龄KM雌性小鼠,至少控光(光照7:00 - 19:00,黑暗19:00 - 7:00)饲养一周后进行促排处理;于17:00对小鼠进行腹腔注射PMSG 15 IU/只,48 h后注射HCG 10 IU/L;注射HCG 15 h后,利用颈椎脱臼法处死小鼠,在腹部下侧呈“V”字型打开腹腔,找到子宫与卵巢,剪下两者之间的输卵管放入盛有卵子处理液(HEPES)含5%胎牛血清(fetal calf serum,FCS)的培养皿中;在体视镜下用针刺破明显肿胀的输卵管壶腹部,将有液体流出,取出其中的卵丘卵母复合体(cumulus-oocyte complexes,COCs);将取出的COCs在受精液(Fertilization,10% FCS)中清洗2~3次后放入盛有Fertilization液(含5% FCS)的培养皿中置于5% CO2、37℃培养箱培养1~2 h;将收集的COCs用HEPES液(5% FCS)中清洗2~3次后放入含有0.1%透明质酸酶的HEPES液中处理1 min,然后用于卵母细胞直径相似的玻璃吸管反复吹吸去掉卵丘颗粒细胞,获得裸卵(deruded oocytes,DOs);将洗净的DOs放入Fertilization液(10% FCS),挑选出含有第一极体且形态正常的MⅡ期卵母细胞置于5% CO2、37℃培养箱培养。
(4)圆形精子细胞注射
将获取的卵母细胞放入HEPES微滴中,调整卵母细胞,使其第一极体位于12点或6点,持卵针于9点位置固定卵母细胞;显微折射针挑选圆形精子细胞并回吸3个刻度(操作臂上刻度),于3点位置刺入卵母细胞中,然后开始回吸胞质,直至破膜后立刻停止回吸,然后将圆形精子细胞缓慢注入卵母细胞胞质中,抽出注射针,固定针释放卵母细胞;
(5)胚胎观察
将圆形精子细胞注射后并激活的卵母细胞进行培养,ROSI后16~18 h(D1)观察每个卵母细胞原核出现情况;ROSI后44~46 h(D2)观察每个卵母细胞分裂并分级;68~70 h(D3)观察卵裂并分级,随即立刻转入囊胚培养液(含5% FCS)中培养,116~118 h(D5)观察培养成囊情况及分级。
1.3 统计学方法
本研究项目数据均采用统计学软件SPSS16.0进行统计分析,计数资料采用率[n(%)]表示,行方差分析,其P< 0.05为差异具有统计学意义。
2 结果
2.1 质粒pCRII-TOPO- PLCζ的构建结果
以小鼠基因组为模板进行目的基因PLCζ的扩增(见图2)。1%琼脂糖凝胶电泳显示目的条带大小约为1960 bp,与目的基因大小相符。
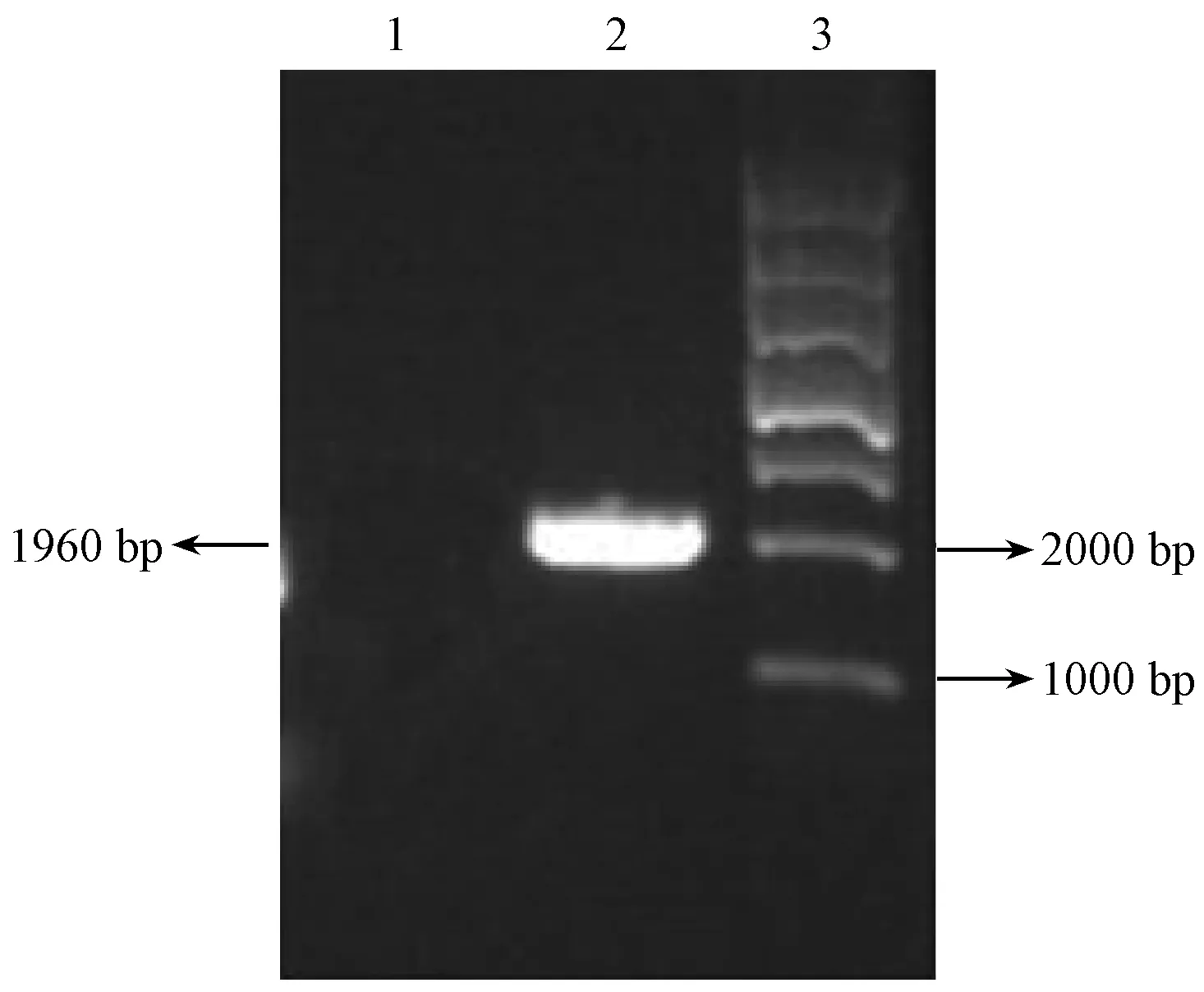
注:Lane1:阴性对照;Lane2:PCR扩增PLCζ产物;Lane3∶1 Kbp DNA Ladder Marker。图2 PCR产物凝胶电泳分析Note. Lane 1: negative control. Lane 2: PCR amplification of PLCζ products. Lane 3: 1 Kbp DNA ladder markers.Figure 2 Analysis of PCR product by gel electrophoresis
将重组质粒pCRII-TOPO- PLCζ进行双酶切鉴定(见图3)。双酶切后1%琼脂糖凝胶电泳显示目的条带大小分别为4000 bp和1960 bp,于原质粒pCRII-TOPO和目的基因大小相符。且经过测序,目的基因序列未发生突变。
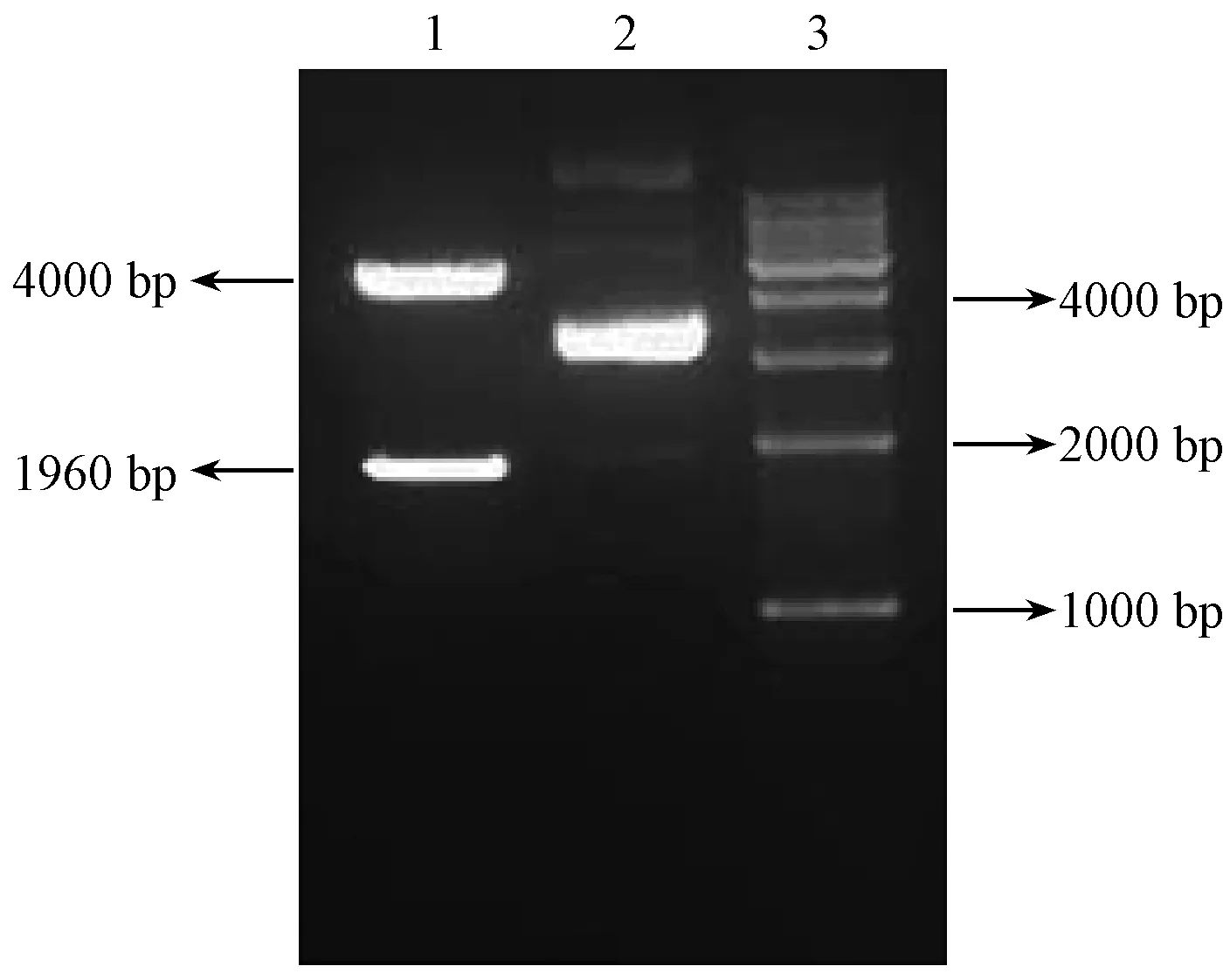
注:Lane1:重组质粒pCRII-TOPO- PLCζ双酶切样品;Lane2:重组质粒pCRII-TOPO- PLCζ样品;Lane3∶1 Kbp DNA Ladder Marker。图3 重组质粒pCRII-TOPO- PLCζ双酶切电泳图Note. Lane 1: recombinant plasmid pCRII-TOPO-PLCζ double digestion sample. Lane 2: recombinant plasmid pCRII-TOPO-PLCζ sample. Lane 3: 1 Kbp DNA ladder markers.Figure 3 Recombinant plasmid pCRII-TOPO-PLCζ double enzyme digestion electropherogram
2.2 重组PLCζ蛋白体外表达与鉴定结果
重组PLCζ蛋白经体外诱导表达后进行SDS-PAGE(见图4)。在90 kDa附近出现大量表达蛋白条带,与重组蛋白预计大小74×103Da相比略大。但切下该目的条带后进行质谱鉴定,为小鼠PLCζ蛋白。
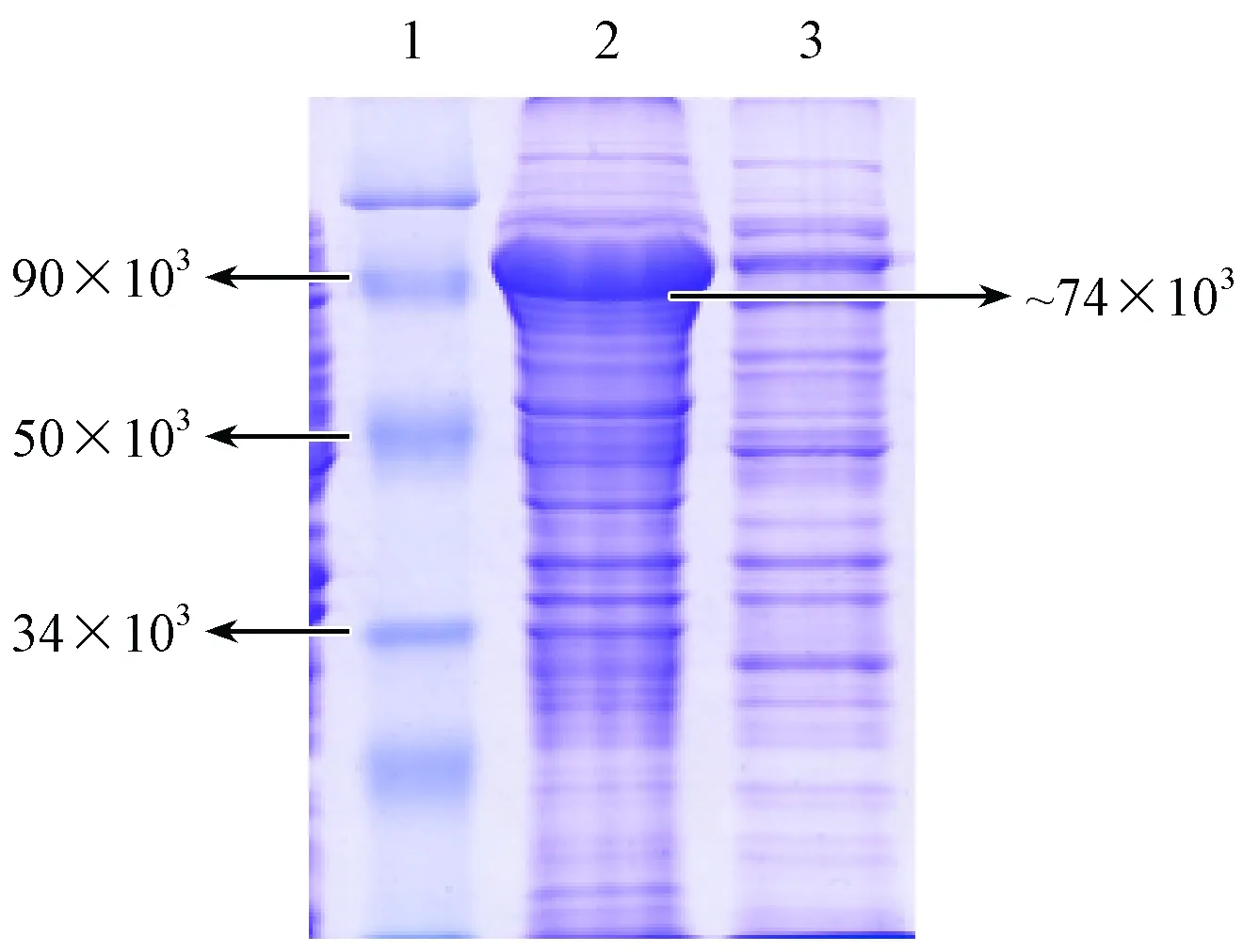
注:Lane1:蛋白Marker;Lane2:重组质粒pCRII-TOPO- PLCζ诱导样品;Lane3:空质粒pCRII-TOPO诱导样品。图4 体外诱导表达重组蛋白SDS-PAGE图Note. Lane 1: protein markers. Lane 2: recombinant plasmid pCRII-TOPO-PLCζ-induced sample. Lane 3: empty plasmid pCRII-TOPO-induced sample.Figure 4 SDS-PAGE analysis of recombinant protein expression in vitro
对该重组PLCζ蛋白用Western blot评价其抗原性(见图5)。在90×103Da以下出现了一条特异性条带,大小符合重组蛋白预计大小。
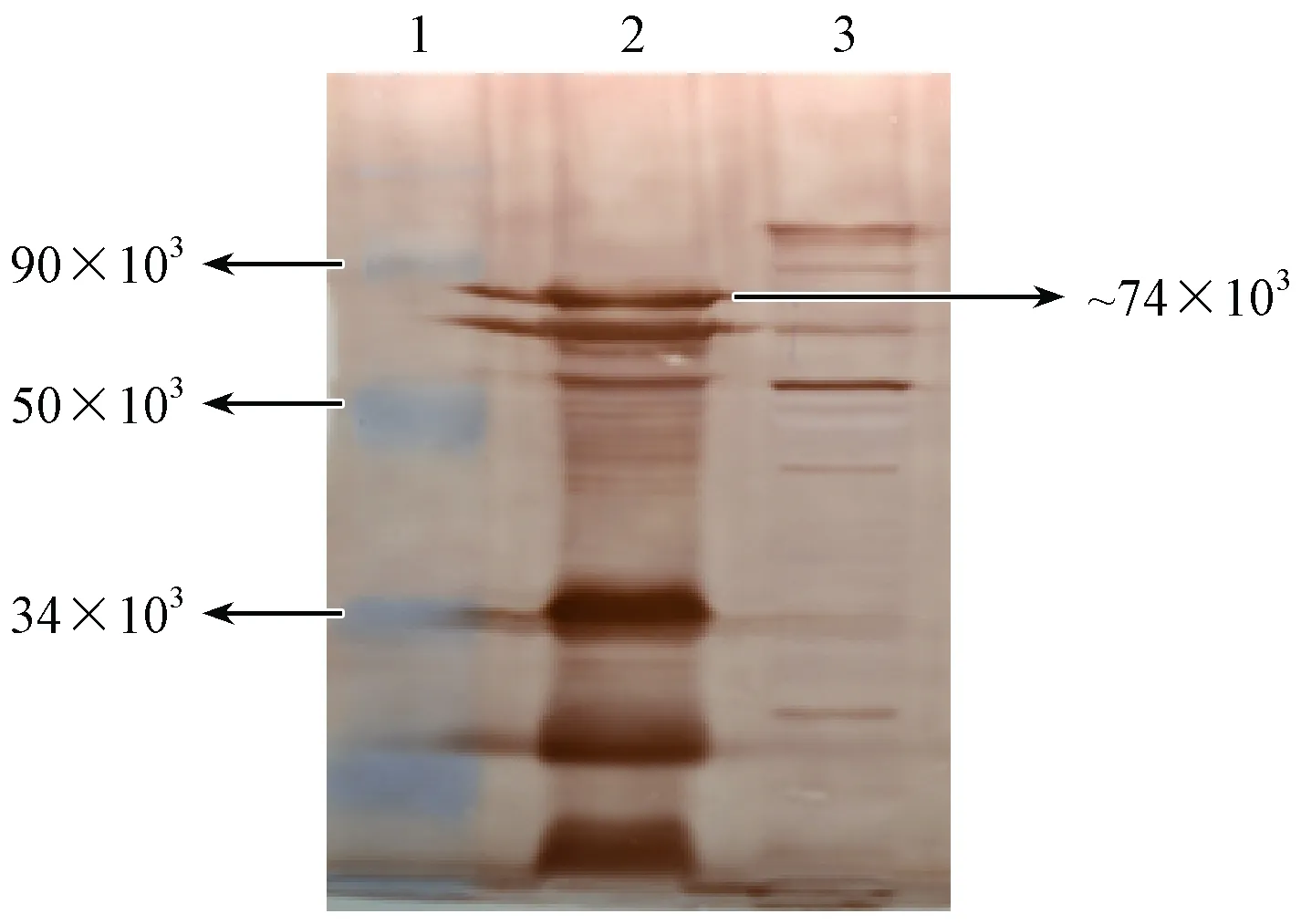
注:Lane 1:蛋白Marker;Lane2:重组质粒pCRII-TOPO- PLCζ诱导样品;Lane 3:空质粒pCRII-TOPO诱导样品。图5 体外诱导表达重组蛋白Western blot图Note. Lane 1: protein markers. Lane 2: recombinant plasmid pCRII-TOPO-PLCζ-induced sample. Lane 3: empty plasmid pCRII-TOPO-induced sample.Figure 5 Western blot analysis of recombinant protein expression in vitro
2.3 小鼠ROSI后卵母细胞受精及胚胎发育结果
将小鼠圆形精子细胞与重组PLCζ蛋白混合为实验组,另将小鼠圆形精子细胞与HEPES混合为空白组。分别进行RSOI后观察小鼠卵母细胞的受精情况和胚胎发育情况(见图6)。
将两组小鼠卵母细胞的受精情况和胚胎发育情况统计其结果如下表1所示。实验组的受精率高于空白组,两者之间的差异无显著性(P>0.05)。但实验组的2-4细胞率、8细胞率及成囊率均要略低于空白组,两者之间的差异无显著性(P>0.05)。

注:a:小鼠卵母细胞受精图;b:小鼠胚胎2-4细胞分裂图;c:小鼠胚胎8细胞及桑椹胚图;d:小鼠胚胎囊胚图。图6 小鼠ROSI后卵母细胞受精及不同时期胚胎发育图Note. a: mouse oocyte fertilization map after ROSI. b: mouse embryo two- to four-cell division graph. c: mouse embryo eight-cell stage and mulberry embryo graph. d: mouse embryo blastocyst graph.Figure 6 The fertilization map of mouse oocytes after ROSI and the embryo development map in different period
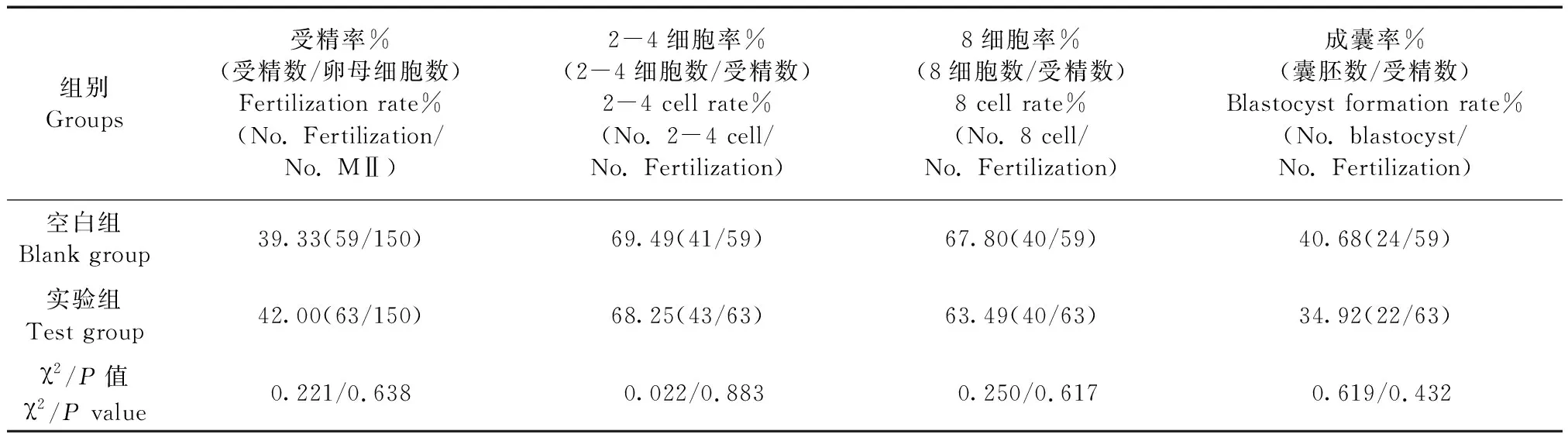
组别Groups受精率%(受精数/卵母细胞数)Fertilization rate%(No. Fertilization/No. MⅡ)2-4细胞率%(2-4细胞数/受精数)2-4 cell rate%(No. 2-4 cell/No. Fertilization)8细胞率%(8细胞数/受精数)8 cell rate%(No. 8 cell/No. Fertilization)成囊率%(囊胚数/受精数)Blastocyst formation rate%(No. blastocyst/No. Fertilization)空白组Blank group39.33(59/150)69.49(41/59)67.80(40/59)40.68(24/59)实验组Test group42.00(63/150)68.25(43/63)63.49(40/63)34.92(22/63)χ2/P值χ2/P value0.221/0.6380.022/0.8830.250/0.6170.619/0.432
3 结论
PLCζ是存在于脊椎动物精子中的一种特异性磷脂酶C,属于磷脂酶C家族的一员,为可溶性的单链结构,通过PLCζ介导磷脂酰肌醇信号通路[8]。PLCζ催化活性部分是高度保守的X区和Y区,该区酶蛋白经折叠靠近后形成催化活性中心,具有PLC的典型结构。XY结构区域分别含有170个氨基酸残疾和260个氨基酸残基,若其中一个氨基酸残基发生突变,PLCζ则会失去生物活性导致引发钙振荡的能力丧失[9-10]。Kashir等[11]利用人类细胞系表达重组人类PLCζ蛋白,将该蛋白注入小鼠卵子中,能够产生与正常受精相同的Ca2+振荡模式。再者Saunders等[8]将小鼠PLCζ mRNA注射入成熟卵子中也可引发与受精时相似的Ca2+振荡,而去除了PLCζ则不能引发卵母细胞Ca2+振荡。Joncs等[12]证实了精子中PLCζ活性要比其他组织高出2倍以上,单条精子的含量就可以引起Ca2+振荡。虽然目前研究已证实PLCζ可以引发卵母细胞发生Ca2+振荡,但PLCζ可否作为一种ROSI后卵母细胞的激活剂以及激活后对胚胎受精发育是否有影响,迄今为止研究甚少。因此,本研究将采用PLCζ作为ROSI后卵母细胞激活的激活剂,探讨PLCζ作为激活剂的可行性及对ROSI后卵母细胞受精及胚胎发育的影响。
本研究中成功构建了真核表达载体pCRII-TOPO-PLCζ,并在体外表达了重组PLCζ蛋白,且具有良好的抗原特性。但是将重组PLCζ蛋白作为小鼠ROSI后的卵母细胞激活剂,卵母细胞受精率略高于空白组,但不具有显著差异。PLCζ是影响男性生殖与不育的关键因素,也是一种重要的激活卵母细胞的精子因子。研究发现不能引发Ca2+振荡的都是因为精子的PLCζ出现异常[13]。但Swann等[14]研究表明没有功能的PLCζ不会影响精子的发生及精子质量参数,如精子活力、活动率和顶体反应能力。由于本研究没有对重组的PLCζ进行功能评价,可能是本研究中卵母细胞受精率没有发生显著变化这一阴性结果的原因之一,因此PLCζ对卵母细胞受精及胚胎发育无影响还需进一步实验验证。另外研究结果还显示2-4细胞率、8细胞率及成囊率却略低于空白组,却不具有显著差异,分析其原因可能是提纯的重组蛋白中含有其他种类的蛋白,会对胚胎的生长发育产生某些轻微影响,但目前尚无文献报道。
目前关于Ca2+振荡对于卵子最佳激活和随后胚胎发育的重要性已有相当的争论。改变Ca2+的数量和瞬变的频率可以微妙的影响胚胎基因的表达与发展潜力[15],但也有研究结果显示未检测到任何形式的Ca2+会影响缺失PLCζ精子的ICSI结果[16]。正如Hachem等[17]学者所述,现今由于精子不能诱导活化卵子造成的男性不育现象可以通过人为的干预(如机械法、电子法或化学刺激法)来刺激诱导卵子活化的方法来处理此类男性不育。但是这些处理诱导的Ca2+都是非生理性的,对人类发育的长期影响仍未明确,是值得广大医学工作者重点关注的问题。综上所述本研究中重组PLCζ蛋白对卵母细胞受精及胚胎发育无显著影响,作为小鼠ROSI后的卵母细胞激活剂的可行性值得商榷。
