射血分数保留的心力衰竭患者睡眠间歇性低氧状况
2019-01-07谢江,李菲
谢 江,李 菲
首都医科大学附属北京安贞医院呼吸与危重症科,北京 100023
心力衰竭具有较高死亡率和致残率,给患者和社会都带来很重的负担。对心力衰竭的合理评价能发现危险因素,从而指导干预,改善预后。超声心动图作为简单易行的无创检查手段能反映心脏的结构及收缩和舒张功能。然而近年有研究发现射血分数(ejection fraction,EF)保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF)患者长期预后并不比EF降低的心力衰竭(heart failure with reduced ejection fraction,HFrEF)患者好[1],具体机制尚不明确。睡眠呼吸暂停(sleep apnea,SA)主要表现为夜间反复出现的呼吸暂停伴低氧血症、白天嗜睡、未来心血管事件风险增加[2]。前瞻性研究显示中重度SA升高心力衰竭患者死亡的风险[3]。本研究回顾心力衰竭患者的病情稳定期睡眠呼吸检测资料,分析HFpEF和HFrEF两种心力衰竭患者主要睡眠参数的差异。
对象和方法
对象入选标准:回顾性分析2011年1月至2014年12月在北京安贞医院接受睡眠呼吸检测和超声心动图的患者。排除标准:既往诊断SA并接受气道正压、手术、口腔矫治器等治疗的患者。患有影响夜间血氧饱和度的先天性心脏病、慢性阻塞性肺疾病、肺栓塞的患者不纳入研究。心力衰竭确诊需符合当时《中华医学会心血管病学分会慢性心力衰竭诊断治疗指南》[4],由临床医生诊断。
睡眠呼吸检测采用Embletter 便携式睡眠呼吸监测设备(美国邦德公司)记录夜间10点至清晨6点睡眠呼吸事件。安装导联包括:口鼻气流、呼吸热敏、经皮指端氧饱和度、呼吸感应式胸腹运动体积描记、心电图监测等。采用美国睡眠医学会标准判读呼吸事件[5]。计算呼吸暂停低通气指数(apnea-hypopnea index,AHI),即平均每小时睡眠中呼吸暂停和低通气的次数,记录夜间最低血氧饱和度(minimum nocturnal saturation,minSaO2);睡眠呼吸检测装置自动计算夜间平均血氧饱和度(mean oxygen saturation during sleep,meanSaO2)和睡眠期间血氧饱和度低于90%占总睡眠时间的比例(percentage of total sleep time with saturation <90%,T90SaO2)。AHI≥5/h的患者诊断SA。中枢性睡眠呼吸暂停诊断需要符合AHI≥15/h且呼吸事件一半以上被判读为中枢性SA[6-7]。其他SA患者被诊断为阻塞性SA。
超声心动图回顾性收集经胸超声心动图资料,主要包括:反映收缩功能的EF和反映左心室舒张功能的二尖瓣前叶M型曲线上E峰和A峰比值(E/A)。根据EF将心力衰竭患者(n=216)分为HFpEF(EF≥50%)组和HFrEF(EF<50%)组[8]。
统计学处理连续变量以中位数(四分位间距)表示;分类变量以例数(百分比)表示。各组比较采用Wilcoxon’s秩和检验(连续变量)和卡方检验(分类变量)。使用Logistic回归分析寻找发生夜间睡眠中重度低氧(minSaO2<85%)的相关因素。多元统计模型中调整的变量包括年龄、性别、高血压、糖尿病、冠心病、肾功能不全和吸烟史。采用SPSS 17.0统计软件包进行统计学分析。P<0.05为差异有统计学意义。
结 果
一般情况在全部纳入研究的854例患者中,697例(81.6%) 被诊断为SA,其中阻塞性SA患者662例、中枢性SA 35例。与非心力衰竭组患者和HFrEF组患者相比,HFpEF组患者年龄较大(P<0.001),合并高血压比例较高(P=0.004)。HFrEF组患者与非心力衰竭患者和HFpEF组患者相比,男性(P<0.001)和吸烟(P=0.002)的比例较大,且合并糖尿病(P<0.001)、慢性肾功能不全(P<0.001)和冠心病(P<0.001)比例较高(表1)。
超声与睡眠资料与非心力衰竭患者相比,HFpEF和HFrEF组患者AHI显著偏高(P<0.001),minSaO2显著偏低(P<0.001),T90SaO2占比高(P=0.029)。两组心力衰竭患者(HFpEF和HFrEF)AHI和血氧饱和度指标差异无统计学意义(表2)。
相关性分析结果与非心力衰竭患者相比,HFpEF组患者发生中-重度低氧血症的可能性更高(OR=2.02,95%CI=1.34~3.11,P<0.001)。矫正年龄、性别、高血压、糖尿病、冠心病、肾功能不全、吸烟史等混杂因素后,HFpEF 与非心力衰竭患者发生中重度低氧血症的可能性仍显著偏高(OR=1.85,95%CI=1.20~2.90,P=0.006)。HFpEF 与 HFrEF和HFrEF 与 无心力衰竭患者发生中-重度低氧血症的概率差异无统计学意义(表3)。
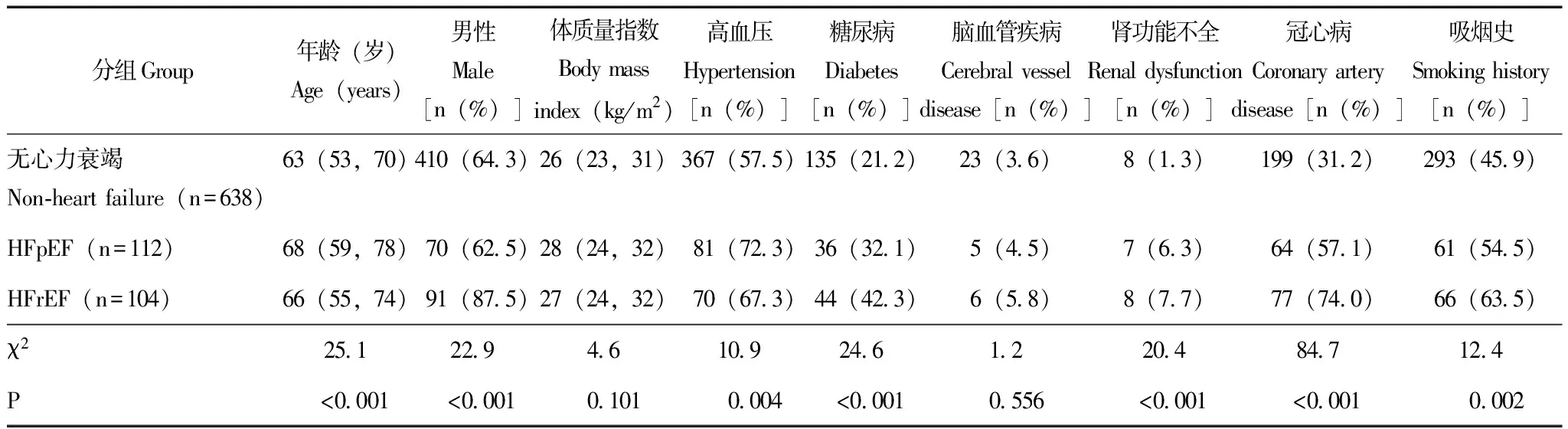
表 1 研究对象的基本临床资料Table 1 Characteristics of study subjects
HFpEF:射血分数保留的心力衰竭:HFrEF:射血分数降低的心力衰竭;连续变量以中位数(四分位间距)表示,分类变量以例数(百分比)表示
HFpEF:heart failure with preserved ejection fraction;HFrEF:heart failure with reduced ejection fraction;continuous variables were described as medians and 25thand 75thpercentiles,and dichotomous variables were described as frequency and percentage

表 2 854例患者的超声心动图及睡眠呼吸暂停检测特征[中位数(第25,第75百分位数)]Table 2 Echocardiographic and sleep apnea characteristics in 854 cases studied[median(the 25th and 75th percentiles)]
EF:射血分数;E/A:二尖瓣前叶M型曲线上E峰和A峰比值;AHI:呼吸暂停低通气指数;minSaO2:夜间最低血氧饱和度;meanSaO2:夜间平均血氧饱和度;T90SaO2:睡眠期间血氧饱和度低于90%占总睡眠时间的比例
EF:ejection fraction;E/A:ratio of E to A waves in echocardiogram;AHI:apnea-hypopnea index;minSaO2:minimum nocturnal saturation;meanSaO2:mean oxygen saturation during sleep;T90SaO2:percentage of total sleep time with saturation <90%
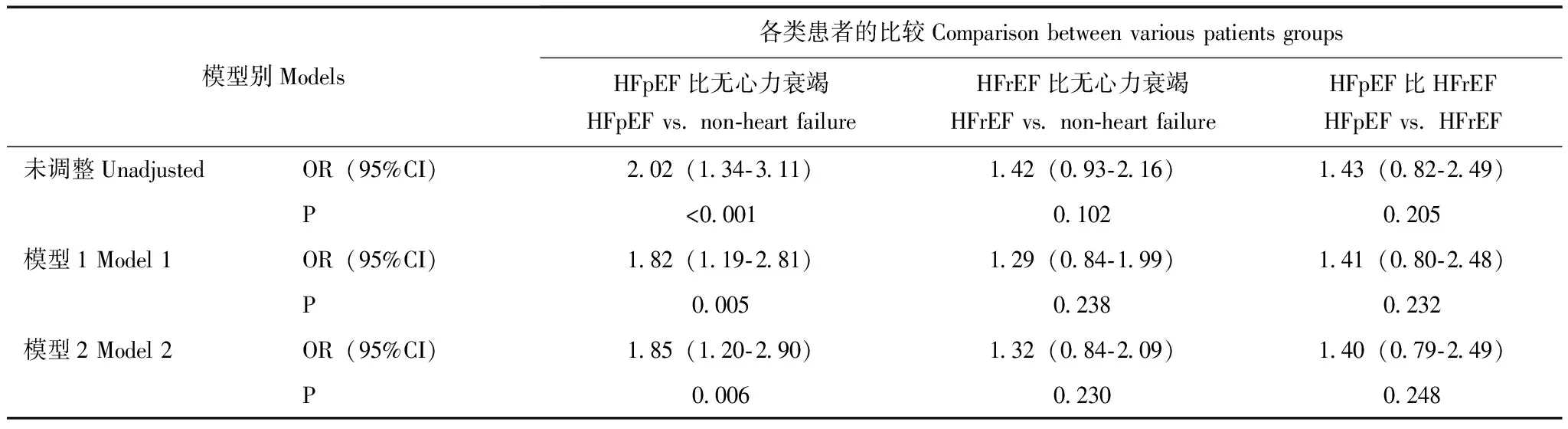
表 3 各类患者发生中-重度低氧血症的风险[OR(95%CI)]Table 3 Odds for moderate-severe hypoxemia in various patients groups[OR(95%CI)]
模型1:调整年龄、性别;模型2:调整年龄、性别、高血压、糖尿病、冠心病、肾功能不全、吸烟史
Model 1:adjusted for age and sex;Model 2:adjusted for age,sex,histories of hypertension,diabetes,coronary artery diseases,renal dysfunction and smoking
讨 论
本研究证实心力衰竭患者发生SA风险很高。HFpEF患者比非心力衰竭者发生睡眠间歇低氧血症的风险高。在校正各种临床重要因素后,HFpEF患者比非心力衰竭患者发生中-重度低氧血症的风险高出近两倍。需要有进一步的研究关注HFpEF患者频繁出现的夜间间歇低氧血症是否与预后相关,以及对其干预能否改善HFpEF患者的长期预后。
本研究心力衰竭患者(HFpEF和HFrEF)比非心力衰竭患者的夜间血氧饱和度水平低,这一结果与此前研究结论相一致[9]。心力衰竭患者组织水肿,尤其是上气道的水肿会加重咽喉塌陷,导致或者加重SA和间歇低氧的发生[10]。目前还没有研究表明SA增加HFpEF的死亡风险,但是有研究证实SA升高舒张性心功能不全患者的生物标记物,如B型利钠肽[11],后者与心力衰竭预后高度相关[12]。
因为低氧血症是SA最重要的病理生理过程[13],也是睡眠检测指标中与心血管疾病预后关系最密切的因素[14],所以本研究关注心力衰竭患者的夜间间歇缺氧状态。值得关注的是,HFpEF患者比非心力衰竭患者发生中-重度低氧血症的概率显著增加;同时HFpEF患者与HFrEF患者相比发生低氧血症的概率相当(甚至可能更高)。目前还没有研究关注HFpEF患者夜间血氧饱和度显著下降的原因。可能的推测是,所有的心力衰竭患者都可能存在上气道水肿,加重气道阻塞,但是HFpEF患者睡眠期间发生阻塞性SA的概率大于HFrEF患者,由于存在呼吸努力,耗氧量大幅增加导致血氧下降明显。而HFrEF患者由于存在心脑循环时间的延长等因素[15],中枢性SA检出率高达25%~50%[16],此类呼吸事件中不存在呼吸肌做功,因此耗氧量相对较少,血氧水平往往高于阻塞性SA患者。尽管还没有研究关注持续正压通气(continuous positive airway pressure,CPAP)对HFpEF患者的治疗效果,但从本研究的结果推测,此类患者可能是从CPAP获益的重要人群,原因是消除了影响心血管疾病不良预后的最主要因素(重度缺氧)。与之相反的是,在自伺服通气治疗收缩性心功能不全患者中枢性睡眠呼吸暂停研究中,EF降低的中枢性SA患者从自伺服通气中并不能受益[17];相对较好的治疗前夜间血氧饱和度(AHI≈45/h情况下,minSaO2≈81%)可能也是治疗后长期预后没有改善的原因之一。
稳定的心力衰竭患者间歇低氧的发生主要来自于呼吸事件,而单纯的补氧并不能纠正呼吸暂停和睡眠片段化[18]。同时补氧也带来延长呼吸暂停持续时间和高碳酸血症的忧虑[19-20]。Gottlieb等[21]发现CPAP治疗能降低SA患者的高血压,而补氧则不能。当然,也有学者在合并肺动脉高压的SA患者所开展的研究证实夜间补氧能改善其预后[22-23]。因此对于CPAP不能耐受的SA患者,补氧可以考虑作为替代疗法以减轻缺氧导致的靶器官损害从而改善预后。当然最明智的做法是在CPAP治疗消除呼吸事件后,对minSaO2仍旧低于88%的患者实施氧疗[24]。另外,肥胖作为重要的心血管疾病危险因素,与SA的发生密切相关。高危人群控制体重既减少呼吸事件,也可能降低未来心血管事件的风险,改善长期预后。
本研究有一定的局限性需要指出。研究收录部分老年患者,这些人存在二尖瓣退行性变的风险。血流频谱E/A作为判断左心室舒张功能不全的指标存在假阴性的可能,不能完全确定患者心脏的舒张功能。另外本研究连续选取完成睡眠呼吸检测和超声心动图的患者,入选过程可能存在偏倚。例如临床出现心力衰竭症状的患者更容易被建议接受超声检查;因此入选的研究对象心力衰竭诊断率高于普通住院患者,研究结果难以推广到一般人群。同时,由于接受睡眠呼吸检测的患者多已被疑诊睡眠呼吸紊乱,因此研究对象SA检出率过高也限制了研究结论的推广。
综上,因疑诊睡眠障碍而接受睡眠呼吸检测的心力衰竭患者SA及其所致的间歇低氧检出率非常高。HFpEF是发生夜间中-重度低氧血症的独立相关因素。需要有进一步的研究探讨纠正这一特殊人群的低氧血症是否能改善长期预后。
