CTA对不同部位急性颈内动脉闭塞特征的诊断效果评价
2019-01-07孟淑春黄贤会韩兴军肖建国朱丽娜
孟淑春 ,黄贤会 ,韩兴军 ,肖建国 ,朱丽娜
(1.聊城市第三人民医院影像科,山东 聊城 252000;2.河北医科大学第四医院影像科,河北 石家庄 050035)
急性颈内动脉(Internal carotid artery,ICA)闭塞的脑梗死患者常常预后不良,即使在常规静脉注射组织型纤溶酶原激活剂(Intravenous tissue plasminogen activator,IV-tPA)治疗后,血管再通率也低于其他类型的急性脑梗死患者[1-3]。近年来,针对急性ICA闭塞的疗效研究取得了良好的效果,其中,及时准确的血管评估是这些治疗取得成功的关键[4-8]。目前,用于血管评估的主要方法是急诊CT或CT血管造影(CT angiography,CTA)。CTA可以清晰显示血管细节,与血管造影(Digital subtraction angiography,DSA)相比,CTA 无创、操作简便,可大大减轻患者的痛苦,与磁共振血管造影(Magnetic resonance angiography,MRA)相比,CTA 检查速度更快、分辨率更高,因此,利用CTA诊断急性ICA的闭塞部位具有重要的临床应用价值[9]。但是,由于CTA的成像结果取决于特定扫描时间内该血管的血流量,因此成像结果可能存在误导,比如,当上游血流停滞或血流速度减慢时,远端闭塞可能被误认为近端闭塞[10]。基于此,有必要对CTA诊断急性ICA闭塞特征的准确性进行评价。我们通过将CTA的诊断结果与金标准DSA的诊断标准进行比较,以评估CTA对不同部位急性ICA闭塞特征的诊断效果,为CTA的临床应用提供依据。
1 资料与方法
1.1 研究对象
本研究回顾性分析了2012年1月—2016年12月在我院就诊的急性脑梗死患者的临床特征和影像学特点。纳入标准:①症状和体征符合前循环脑梗死的患者;②CTA提示伴有近端脑动脉闭塞需要进行血管内治疗的患者;③美国国立卫生研究院卒中量表(Nationalinstitutes ofhealth stroke scale,NIHSS)评分≥5;④经DSA确诊的症状性ICA闭塞患者。排除标准:①已进行支架治疗的缺血性卒中患者;②伴有后循环闭塞或大脑中动脉闭塞或大脑前动脉闭塞的患者;③无大动脉闭塞的患者(即使有明显的MRI弥散加权成像(Diffusion weight image,DWI)的梗死灶也应排除);④除大动脉闭塞外怀疑有其它病变(如颈动脉夹层)的患者。最终,共纳入161名患者。患者或家属均签署知情同意书,该研究获伦理委员会批准。
1.2 研究方法
1.2.1 急性卒中患者诊治方案
怀疑急性脑梗死的患者,立即进行急诊CT平扫+增强和CTA检查。CTA采用最大强度投影法(Maximal intensity projection,MIP)和容积再现法(Volume-rendering techniques,VRT)进行重建。 诊断为脑梗死后,发病4.5 h内的患者给予IV-tPA(0.9 mg/kg,最大剂量 90 mg),发病 6 h内且无禁忌症的患者尽快进行血管内治疗[11]。血管再通率由神经介入医师根据DSA的检查结果确定。发病后48 h进行CT平扫检查,在入院后1天内进行MRI检查,包括轴向T2加权成像、DWI和梯度回波T2加权成像(Gradientecho T2-weighted images,GRET2*WI)。
1.2.2 图像获取
本研究中,患者进行的CT检查包括头部平扫、增强和血管造影成像。首先进行CT平扫,层厚5mm。然后进行CTA扫描,层厚1 mm,扫描范围为主动脉弓水平至颅顶水平。在CTA扫描前经肘正中静脉注射100 mL 68%的非离子型对比剂,流速为4~5 mL/s。当颈总动脉增强达到120 HU时开始进行CTA扫描。使用1.5 mm层厚和1.0 mm重建间隔的软组织算法实现CTA原始数据的重建。CTA源图像采用MIP和VRT进行后处理,创建冠状、矢状和轴向多平面重组的3D图像。诊断为急性ICA患者的CTA图像见图1。ICA闭塞部位定义为静脉期达最大延迟时间时造影剂停止的位置。双侧颈内动脉和椎动脉均检查。血管再通情况依据脑梗死溶栓分级(Thrombolysis in cerebral infarction,TICI)灌注分级进行评价,TICI评分为2b到3分表明再通成功[12]。
1.2.3 图像分析
由两名高年资的影像学医师分别对CT、MRI和DSA的图像进行分析,有争议的图像由影像科及神经内科医师组成的评定小组进行决策。CTA的成像特征主要考虑以下四个方面:①颈动脉闭塞残端的形状:可分为树桩状、矛头状和条纹状3种类型(图2)[13];②颈动脉钙化情况:存在颈动脉钙化定义为存在至少一处≥1 mm2且衰减≥500 HU的病变部位[14];③Willis环的闭塞形状:可分为T型、L型和I型[15];④软脑膜侧支循环(Leptomeningeal collaterals,LMC)状态:“差”定义为>50%的大脑中动脉区域与对侧灌注相比没有或少有侧支循环,“良好”定义为与对侧相比有相似的甚至更多的侧支循环。ICA的闭塞部位由DSA确认,不考虑ICA以外的闭塞损伤。根据Bouthillier等[16]提出的分段法,可将ICA闭塞部位分为 7 段:C1颈段、C2岩段、C3破裂(孔)段、C4海绵窦段、C5床段、C6眼段和C7交通段。在48 h CT平扫成像中,脑梗死出血性转化(Hemorrhagic transformation,HT)分为4个亚型:出血性脑梗死(Hemorrhagic infarction,HI)的 1 型和 2 型,脑实质出血(Parenchymal hemorrhage,PH)的1型和2型。症状性颅内出血定义为NIHSS评分升高≥4分。梗死体积由 MRI-DWI测量(b=1 000 s/mm2)。

图1 急性ICA闭塞患者的CTA成像。Figure 1.CTA imaging of patients with acute occlusion of the ICA.
1.2.4 短期预后及病因分析
所有患者在发病第1、3、7天评估NIHSS评分。在发病第90天时通过面对面或电话随访的方式进行改良Rankin量表(mRS)评分评估患者预后,患者预后情况分为良好(mRS 0~2)和不良(mRS 3~6)两类。根据卒中发生的病因不同,将所有患者分为3类:大动脉粥样硬化、心源性栓塞和两者兼有。
1.3 统计分析
所有数据采用SPSS 19.0统计软件处理,计数资料(性别等)采用卡方检验进行比较;计量资料(年龄等)均采用(MEAN±SD)表示,两组间比较采用独立样本t检验,两组以上比较采用单因素方差分析,P<0.05认为有统计学差异。利用受试者工作特征(Receiver operating characteristic,ROC)曲线来评价CTA对不同部位ICA闭塞的诊断效果,共探讨了五种诊断方式,分别为:①根据CTA确定的颈动脉闭塞残端形状诊断;②根据CTA确定的颈动脉钙化情况诊断;③根据CTA确定的Willis环闭塞形状诊断;④根据CTA确定的LMC状态诊断;⑤综合前四种诊断方式的联合诊断。为了分析急性ICA闭塞患者短期预后不良(mRS 3~6)的危险因素,我们首先对以下潜在的相关因素进行单因素Logistic回归分析:患者的一般资料(包括性别、年龄、发病至CT检查的时间)、卒中严重程度(包括基线NIHSS评分和梗死体积)、阻塞部位、病因、治疗方式、血管再通成功率、症状性脑出血(Intracerebral hemorrhage,ICH);然后将潜在的有意义的预测因子(P<0.1)纳入多因素回归分析模型中进行分析。
2 结果
2.1 患者的临床特征和预后
本研究共纳入161例患者,根据ICA闭塞部位不同,可将其分为三组:C1颈段闭塞患者56例,C4海绵窦段闭塞患者72例,C6眼段或C7交通段闭塞患者33例。各组患者的临床特征比较详见表1。三组患者在年龄、性别、发病至CT检查时间、治疗方式和血管再通成功率方面的比较差异均无统计学意义(P>0.05);越远端的闭塞部位,发病时神经功能缺损的程度越严重(NIHSS评分),梗死体积越大,比较差异具有统计学意义(P<0.05);闭塞部位与脑梗死发生的病因、脑梗死后并发症的发生(包括HT和症状性 ICH)以及患者的预后有关(P<0.05)。
2.2 CTA成像特征
不同ICA闭塞部位患者的CTA成像特征比较见表2。三组患者的CTA成像在颈动脉闭塞残端的形状、颈动脉钙化情况、Willis环的闭塞形状和LMC状态四个方面比较差异均有统计学意义(P<0.05)。
2.3 CTA对不同ICA闭塞部位的鉴别情况
不同ICA闭塞部位患者的5种CTA诊断方式比较情况见ROC曲线(图3)。对于C1颈段部位闭塞而言,最优诊断方式为联合诊断(AUC=0.966),最差的为LMC状态良好(AUC=0.578)。对于C4海绵窦段闭塞而言,最优诊断方式为联合诊断方式(AUC=0.878),最差的为 LMC 状态差(AUC=0.518)。对于C6眼段或C7交通段闭塞而言,最优诊断方式为联合诊断方式(AUC=0.902),最差的为Willis环闭塞形状为T型(AUC=0.579)。

表1 不同ICA闭塞部位患者的临床特征比较
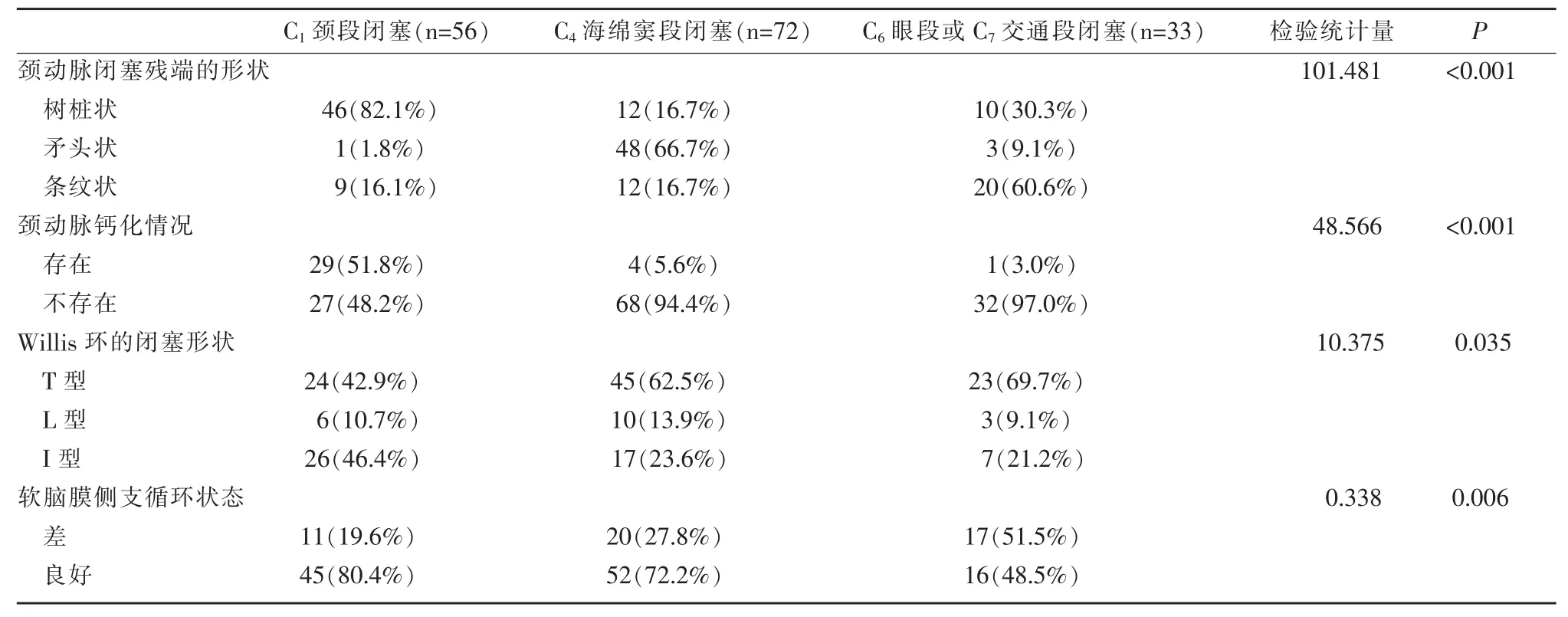
表2 不同ICA闭塞部位患者的CTA成像特征比较

图3 不同ICA闭塞部位患者的5种CTA诊断方式比较情况(ROC曲线)。Figure 3.Comparison of the five CTA diagnostic methods in patients according to the DSA-confirmed ICA occlusion sites(ROC curves).
2.4 短期预后不良的危险因素分析
急性ICA闭塞患者短期预后良好与不良患者临床特点比较见表3,其中年龄、性别、基线NIHSS评分、梗死体积、闭塞部位、病因和症状性ICH的P值小于0.1,纳入多因素Logistic回归模型中。多因素Logistic回归分析结果如表4所示,年龄较大和ICA远端闭塞是预后不良的危险因素(P<0.05)。

表3 预后良好组与预后不良组临床特点比较
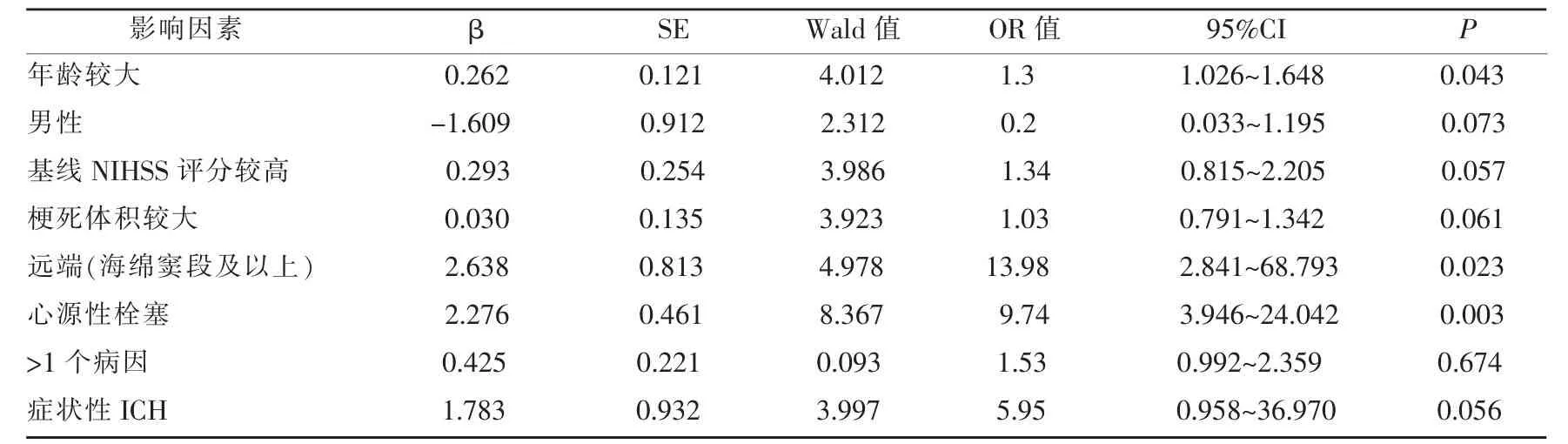
表4 急性ICA闭塞患者短期预后不良的多因素Logistic回归分析
3 讨论
随着我国步入老龄化社会,ICA闭塞引起的急性脑梗死患者逐年增加,急需快速有效的诊断方法为患者的治疗赢得时间。本研究中,分析了利用CTA成像特征诊断患者ICA闭塞部位的5种诊断方法,其中,联合诊断可达到较高的诊断效果,有望为患者提供一种快速、无副作用的诊断方法。
ICA闭塞患者有不同的临床表现(单眼失明、偏瘫、皮质症状和昏迷等),严重程度也不同[17]。我们的研究表明,ICA闭塞的临床表现(包括神经功能缺损严重程度、梗死体积、病因、脑梗死后并发症的发生以及患者的预后)与闭塞部位显著相关。越远端的闭塞部位,发病时神经功能缺损的程度越严重,梗死体积越大,脑梗死后并发症的发生率越高,患者的预后越差,这可能是由于远端闭塞时Willis侧支循环建立的情况较差,缺血脑组织的灌注不足引起[18-19]。
ICA闭塞患者的CTA影像学表现也与闭塞部位显著相关。不同闭塞部位的患者,在颈动脉闭塞残端的形状、颈动脉钙化情况、Willis环的闭塞形状和LMC状态四个方面的影像学表现也不同,如:C1颈段闭塞的患者更易表现为树桩状的闭塞残端、存在颈动脉钙化、I型Willis环的闭塞和良好的LMC状态。C4海绵窦段闭塞的患者更易表现为矛头状的闭塞残端、无颈动脉钙化、T型Willis环的闭塞和良好的LMC状态。而C6眼段或C7交通段闭塞的患者更易表现为条纹状的闭塞残端、无颈动脉钙化、T型Willis环的闭塞和较差的LMC状态。这可能是由于海绵窦段以上的血管具有特殊的解剖结构,此段血管相对坚硬且无分支,因此,当此段完全闭塞时,更不易恢复动脉血流,因此呈现为T型Willis环的闭塞和较差的LMC[15]。而对于颈段闭塞,由于分叉后的分流缺少足够的入口长度来获得足够的流动动量,因此可能呈现树桩状的闭塞形状[20]。此现象说明,根据不同的CTA特征来鉴别ICA闭塞部位是可行的,也为我们筛选不同的CTA诊断方式提供了依据。
为了寻找利用CTA成像特征诊断患者ICA闭塞部位的最佳方法,我们探索了5种诊断方式。其中,结合了颈动脉闭塞残端的形状、颈动脉钙化情况、Willis环的闭塞形状和LMC状态特征的联合诊断取得了较高的诊断效果,值得在临床推广。
由于急性ICA闭塞患者常常预后不良,因此,我们对预后不良的患者进行了多因素危险因素分析,结果显示,年龄较大和ICA远端闭塞是预后不良的危险因素。与前面分析的相同,这可能是由于缺少侧支循环引起的,也提示我们对于年龄较大和ICA远端闭塞的患者,更应引起重视,及早进行有效的治疗。
当然,本研究也存在一些不足,一是此研究的样本量较少,且为单中心研究,仍需要更多高质量的研究进行进一步论证;二是本研究未包括已进行支架治疗的缺血性卒中患者,因此,有必要对这种新技术的情况进行更详细的研究。
综上所述,ICA闭塞的临床表现和CTA影像学表现均与闭塞部位有关,利用CTA提示的颈动脉闭塞残端的形状、颈动脉钙化情况、Willis环的闭塞形状和LMC状态特征的联合诊断方法可有效地对不同部位的急性ICA闭塞进行诊断,值得在临床上广泛推广。
