2型糖尿病患者踝肱指数与早期肾脏损害关系的研究
2019-01-06毛盛程丁丽青吴翔陈丽莉
毛盛程 丁丽青 吴翔 陈丽莉
[摘要] 目的 探讨伴蛋白尿阴性的2型糖尿病(T2DM)患者踝肱指数(ABI)异常与早期肾脏损害的关系。 方法 收集2015年1月~2018年12月于我院内分泌科住院并接受ABI检查的654例T2DM患者作为研究对象,根据尿白蛋白/尿肌酐比值(UACR)分为三组:正常蛋白尿组(UACR<30 mg/g)、微量蛋白尿组(30 mg/g≤UACR<300 mg/g)和大量蛋白尿组(UACR≥300 mg/g),分析ABI异常在各组的发生率;剔除正在使用ACEI或ARBs类药物的患者,纳入蛋白尿阴性的患者215例,根据eGFR水平分为两组:eGFR正常组[eGFR≥90 mL/(min·1.73 m2)]、eGFR轻度下降组[eGFR≥60且<90 mL/(min·1.73 m2)],分析ABI异常在两组的发生率及Logistic回归分析ABI异常与糖尿病患者早期肾脏损害的关系。 结果 整体T2DM患者中ABI异常发生率为25.08%,与正常蛋白尿组(11.84%)相比,微量蛋白尿组及大量蛋白尿组的ABI异常发生率呈显著性升高,分别为31.75%、56.79%(P<0.01),呈上升趋势。伴蛋白尿阴性的T2DM患者215例中的ABI异常发生率为16.28%(35/215),与eGFR正常组(11.56%)相比,eGFR轻度下降组的ABI异常发生率显著升高,为35.72%(P<0.01)。Logistic回归分析显示,调整相关危险因素后,ABI异常是伴蛋白阴性的T2DM患者发生早期肾脏损害的危险因素(OR=2.16,P=0.002);同时,年龄、糖尿病病程、HbA1c、SBP、HDL-C、合并高血压是伴蛋白尿阴性的T2DM患者发生早期肾脏损害的影响因素。 结论 ABI异常是伴蛋白尿陰性的T2DM患者发生早期肾脏损害的独立危险因素。
[关键词] 2型糖尿病;踝肱指数;糖尿病肾病;蛋白尿;肾小球滤过率
[中图分类号] R587.2;R692.9 [文献标识码] B [文章编号] 1673-9701(2019)32-0032-05
Relationship between ankle brachial pressure index abnormality and early renal damage in patients with type 2 diabetes
MAO Shengcheng DING Liqing WU Xiang CHEN Lili
Department of Endocrinology, Zhejiang Provincial Tongde Hospital, Hangzhou 310012,China
[Abstract] Objective To investigate the relationship between ankle brachial pressure index (ABI) abnormality and early renal damage in patients with proteinuria-negative type 2 diabetes mellitus (T2DM). Methods Six hundred and fifty-four patients with T2DM who were hospitalized in the Department of Endocrinology of our hospital from January 2015 to December 2018 and underwent ABI examination were enrolled and divided into three groups according to the urine albumin-to-creatinine ratio (UACR) as the normal proteinuria group (UACR<30 mg/g), the micro-proteinuria group (30 mg/g≤UACR<300 mg/g) and the massive proteinuria group (UACR≥300 mg/g). The incidence of ABI abnormality in each group was analyzed. Excluding patients who were using ACEI or ARBs, 215 patients with negative proteinuria were divided into two groups according to eGFR levels: normal eGFR group[eGFR≥90 mL/(min·1.73 m2)] and mildly reduced eGFR group[eGFR≥60 and <90 mL/(min·1.73 m2)]. The incidences of ABI abnormality in the two groups were analyzed and logistic regression analysis of the relationship between ABI abnormality and early renal damage in diabetic patients was conducted. Results The incidence of ABI abnormality in patients with T2DM was 25.08%. Compared with the normal proteinuria group (11.84%), the incidences of ABI abnormality in the micro-proteinuria group and massive proteinuria group were significantly increased(P<0.01), with 31.75% and 56.79% respectively, indicating an upward trend. The incidence of ABI abnormality in patients with proteinuria-negative T2DM was 16.28%(35/215). Compared with the normal eGFR group (11.56%), the incidence of ABI abnormality in the mildly reduced eGFR group was significantly higher (P<0.01), with 35.72%. It was found Logistic regression analysis that ABI abnormalitiy was the risk factor for early renal damage in patients with proteinuria-negative T2DM after adjusting relevant risk factors (OR=2.16, P=0.002). Meanwhile, age, duration of diabetes, HbA1c, SBP, HDL-C and hypertension with diabetes were also influential factors for early renal damage in patients with proteinuria-negative T2DM. Conclusion ABI abnormality is an independent risk factor for early renal damage in patients with proteinuria-negative T2DM.
[Key words] Type 2 diabetes; Ankle brachial pressure index; Diabetic nephropathy; Proteinuria; Glomerular filtration rate
随着2型糖尿病(T2DM)的患病率逐年上升,糖尿病肾脏病变(DN)和糖尿病肾病(DKD)已成为终末期肾病(ERSD)的主要原因,也是T2DM的主要微血管并发症之一[1]。极高比例的糖尿病患者发生DKD,其一旦进入临床蛋白尿期,进展极快,且没有特别有效的治疗,关键在于预防,因此早期诊断、延缓DKD的发生发展对降低大血管事件的发生风险、改善糖尿病患者的生活质量及提高其存活率具有重要意义[2]。
踝肱指数(ABI)是目前临床上判断外周动脉疾病(PAD)严重程度的一项重要临床指标,其敏感性高、特异性强、价格低廉、安全无创,广泛应用于临床[3-5]。ABI是评估全身动脉粥样硬化负荷的一个重要指标,其减低与心脑血管疾病、糖尿病足的发生发展及全因死亡率的增高密切相关[6-8]。近年来研究报道在普通人群中ABI减低与肾功能减退密切相关[9],但很少有糖尿病患者ABI减低与DKD的关系的研究报告,尤其缺乏中国T2DM患者的相关研究。本研究拟分析T2DM患者ABI异常的发生率,并进一步探讨伴蛋白尿阴性的T2DM患者ABI异常与早期肾脏损害的关系。
1 资料与方法
1.1 一般资料
收集2015年1月~2018年12月于我院内分泌科住院并接受ABI检查的654例T2DM患者作为研究对象。入选标准:研究对象均符合《中国2型糖尿病防治指南(2017年版)》[10]中T2DM诊断标准。排除标准:(1)1型糖尿病、妊娠糖尿病、特殊类型糖尿病;(2)3个月内发生糖尿病急性代谢并发症;(3)合并其他原因导致的视网膜病变、周围神经病变者;(4)伴有其他慢性肾脏疾病,如肾小球疾病及其他类型肾病;(5)伴有结缔组织疾病、恶性肿瘤、严重感染等。患者或亲属均签署知情同意书。
1.2 方法
1.2.1 一般资料 记录患者的性别、年龄、糖尿病病程、吸烟情况、用药情况、既往疾病史等。测量身高、体重、收缩压(SBP)、舒张压(DBP)、腰围等,计算体重指数(BMI)。
1.2.2 实验室检查 研究对象禁食8~10 h。高压液相法检测糖化血红蛋白(HbA1c);免疫比浊法检测尿白蛋白;全自动生化仪检测血糖、尿素氮(BUN)、血肌酐(Scr)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)等。
1.2.3 eGFR测定和分组 采用简化MDRD公式计算:eGFR[mL/(min·1.73 m2)]=186×Scr(-1.154)×年龄(-0.203)×(0.742女)[11]。参考2002年美国肾脏基金制定的《慢性肾脏病临床实践指南》K/DOQI[12]制定 eGFR分组标准:(1)eGFR正常组:eGFR≥90 mL/(min·1.73 m2);(2)eGFR轻度下降组:eGFR≥60且<90 mL/(min·1.73 m2)。
1.2.4 ABI测定和分组 根据 2013版《美国心脏病学学会基金会/外周动脉疾病指南》制定本研究ABI测定方法和分组标准[13]。ABI测定:专业技师采用多普勒血流探测仪测量患者仰卧位时双侧肱动脉和踝动脉血压(分别测定胫后动脉或足背动脉血压,取高值),ABI=踝/肱动脉血压比值,筛选双侧ABI中较低值纳入本研究。ABI分组:(1)ABI正常组:ABI>0.9;(2)ABI异常组:ABI≤0.9(注:本研究中无 ABI≥1.4的病例)。
1.2.5 蛋白尿诊断和分组 根据2019版中国糖尿病肾脏疾病防治临床指南[2]制定蛋白尿分组标准,蛋白尿分组:(1)正常蛋白尿组:UACR<30 mg/g;(2)微量蛋白尿组:30 mg/g≤UACR<300 mg/g;(3)大量蛋白尿组:UACR≥300 mg/g。
1.2.6 糖尿病视网膜病变(DR)和糖尿病周围神经病变(DNP)诊断标准 根据2002年糖尿病性视网膜病变国际临床分型标准[14]:眼科专科医生行眼底检查,确诊DR。根据《中国2型糖尿病防治指南(2017年版)》[10]DNP诊断标准确诊DNP:(1)糖尿病病史;(2)确诊糖尿病后发生的神经病变;(3)临床体征、症状符合DNP的表现;(4)下列5项中有2项或2项以上出现异常:振动觉异常;踝反射消失;温度觉异常;足部感觉消失或减退;神经传导速度减缓。
1.3 统计学方法
采用SPSS21.0统计学软件进行分析。正态分布的计量资料以均数±标准差(x±s)表示,采用t检验;非正态分布的计量资料以中位数(四分位数间距)表示,组间比较采用秩和檢验;计数资料以[n(%)]表示,组间比较采用χ2检验。Logistic回归分析ABI减低与早期肾脏损害的关系。P<0.05或P<0.01为差异有统计学意义。
2 结果
2.1 研究对象的基本资料
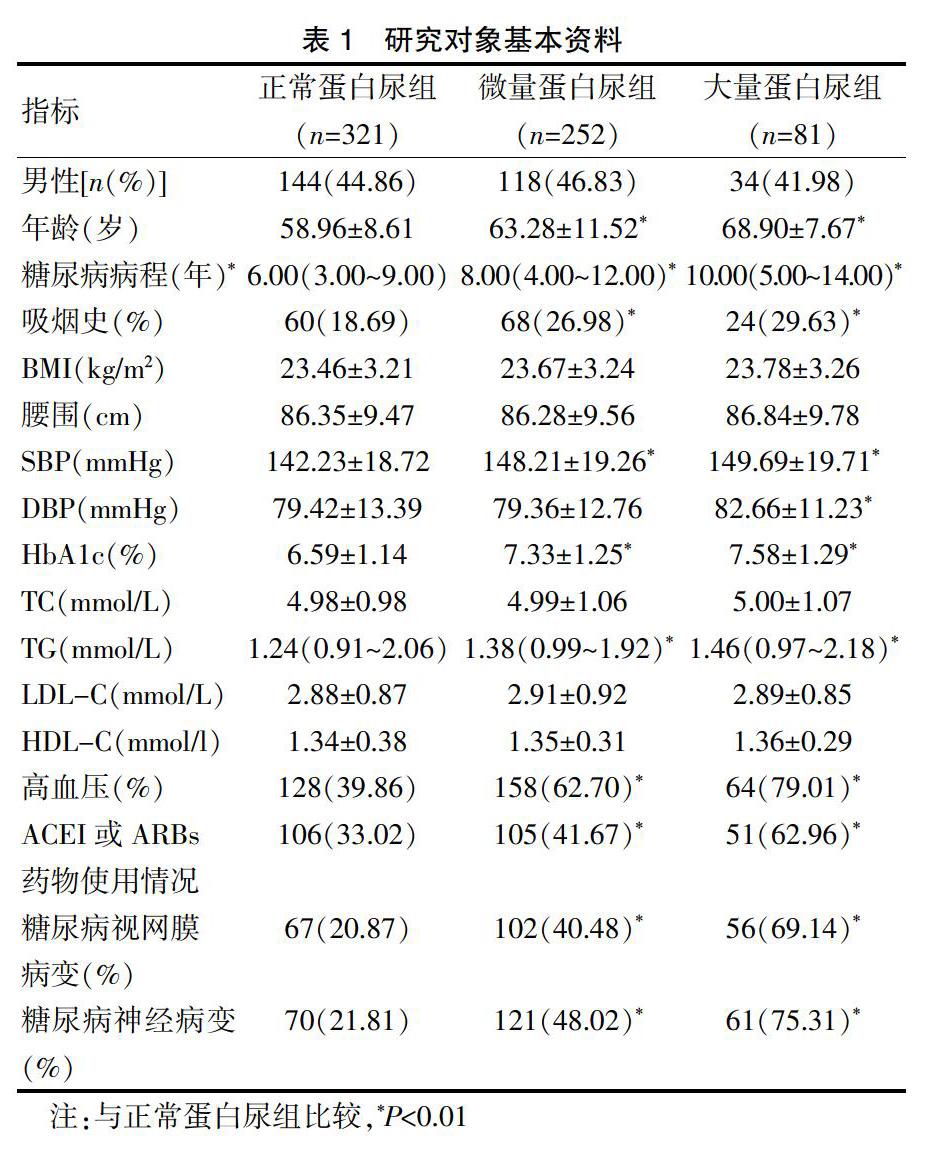
本研究共纳入T2DM患者654例,其中男296例(45.26%),根据UACR水平分为三组,其中正常蛋白尿组321例(占49.08%),微量蛋白尿组252例(占38.53%),大量蛋白尿组81例(占12.39%)。见表1。与正常蛋白尿组相比,微量蛋白尿组和大量蛋白尿组的年龄、糖尿病病程、吸烟比例、SBP、HbA1c、TG、高血压、ACEI或ARBs药物使用比例、糖尿病视网膜病变、糖尿病神经病变等呈显著性升高。见表1。
表1 研究对象基本资料
注:与正常蛋白尿组比较,*P<0.01
2.2不同蛋白尿组的ABI各组分布情况
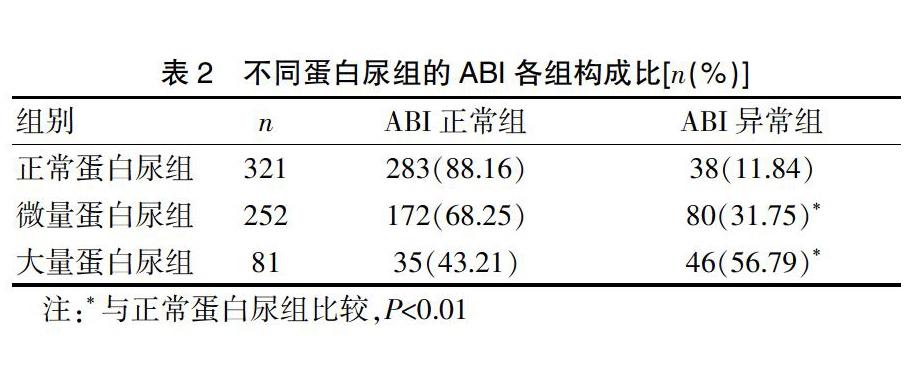
纳入本研究的654例T2DM患者,其ABI异常发生率为25.08%。与正常蛋白尿组(11.84%)相比,微量蛋白尿组及大量蛋白尿组的ABI异常发生率呈显著性升高,分别为31.75%、56.79%(P<0.01),呈上升趋势。见表2。
表2 不同蛋白尿组的ABI各组构成比[n(%)]
注:*与正常蛋白尿组比较,P<0.01
2.3 伴蛋白尿阴性的T2DM患者ABI水平与早期肾脏损害的相关性研究
剔除正在使用ACEI或ARBs类药物的患者,伴蛋白尿阴性的T2DM患者为215例(32.87%),其eGFR均≥60 mL/(min·1.73 m2),根据eGFR水平分成两组:eGFR正常组,共173例;eGFR轻度下降组,共42例。
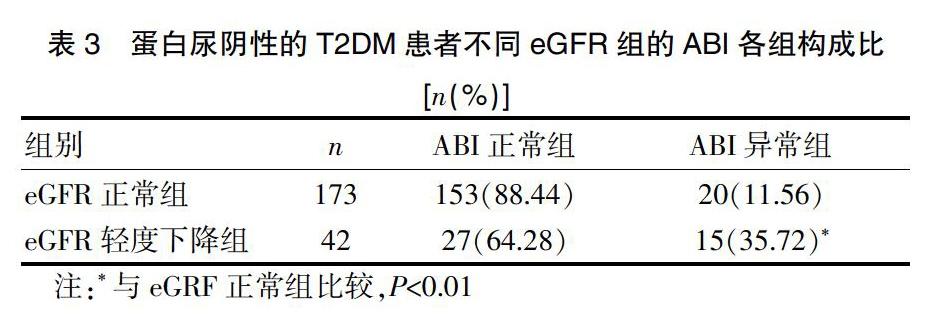
2.3.1 不同eGFR组的ABI各组的分布情况 伴蛋白尿阴性的T2DM患者215例中的ABI异常的发生率为16.28%(35/215),较总体T2DM患者有所下降。与eGFR正常组(11.56%)相比,eGFR轻度下降组的ABI异常发生率显著升高,为35.72%(P<0.01)。见表3。
表3 蛋白尿阴性的T2DM患者不同eGFR组的ABI各组构成比
[n(%)]
注:*与eGRF正常组比较,P<0.01
2.4 伴蛋白尿阴性的T2DM患者早期肾脏损害的相关危险因素分析
2.4.1 伴蛋白尿阴性的T2DM患者发生早期肾脏损害的单因素二元Logistic回归分析 分析T2DM患者早期肾脏损害的影响因素,以eGFR水平分组为因变量,以性别、年龄、糖尿病病程、吸烟史、SBP、HbA1c、腰围、BMI、TG、HDL-C、LDL-C、是否合并高血压、是否合并糖尿病视网膜病变,是否合并糖尿病神经病变作为自变量,做单因素二元Logistic回归分析,结果显示:ABI异常是伴蛋白阴性的T2DM患者发生早期肾脏损害的危险因素(OR=2.27,P=0.001)。同时,性别、年龄、糖尿病病程、吸烟史、HbA1c、SBP、BMI、HDL-C、合并高血压是伴蛋白尿阴性的T2DM患者发生早期肾脏损害的影响因素。见表4。
表4 伴蛋白尿阴性的T2DM患者发生早期肾脏损害的单因素Logistic回归分析
2.4.2 伴蛋白尿阴性的T2DM患者发生早期肾脏损害的多因素二元Logistic回归分析 以单因素二元Logistic回归分析有意义的变量作自变量,eGFR水平分组为因变量,作多因素二元Logistic回归分析,结果显示:ABI异常是伴蛋白阴性的T2DM患者发生早期肾脏损害的危险因素(OR=2.16,P=0.002);同时,年龄、糖尿病病程、HbA1c、SBP、HDL-C、合并高血压是T2DM患者发生早期肾脏损害的影响因素。见表5。
3讨论
T2DM患病率呈上升趋势,其慢性并发症致死率、致残率极高,已成为全世界面临的共同难题。最新国际糖尿病联盟(IDF)调查发现,80%以上的ESRD由高血压、糖尿病或两种疾病共同引起,其中12%~55%的ESRD由糖尿病引起,另外,糖尿病患者的ESRD的发病率较无糖尿病患者高10倍[15],造成了严重的医疗经济负担。DKD是糖尿病最常见慢性微血管并发症之一,其起病隐匿,早期临床症状不明显,容易忽视,一旦进入临床蛋白尿期进展极快,是导致糖尿病患者死亡的主要原因,需早期诊断与治疗。
本研究发现在整体T2DM患者中,微量蛋白尿组ABI异常发生率较正常蛋白尿组显著升高,而大量蛋白尿组ABI异常发生率更显著,可见ABI异常与蛋白尿发生密切相关。国内的一项回顾性研究显示在200例T2DM患者中,ABI异常组UACR异常率显著高于ABI正常组,Spearman相关性分析显示ABI与UACR呈显著负相关[16]。Chen FA等[17]研究发现在中晚期肾损害患者中,ABI异常患者UACR水平显著高于ABI正常患者,经过平均13个月的随访观察,ABI异常患者eGFR水平下降较ABI正常患者更显著。另外一项临床研究显示与ABI正常组相比,ABI异常组eGFR水平显著下降,且ABI异常是eGFR下降的独立危险因素[18]。
传统意义上我们认为DKD的病程首先出现eGFR水平增加,然后出现微量白蛋白尿,随着尿蛋白水平增加继而出现肾功能减退,最终进展为ESRD。近来随着糖尿病肾脏病的研究深入,发现有部分糖尿病患者在蛋白尿阴性时,已出现肾功能不全。国外一项研究发现有10%的蛋白尿阴性的1型糖尿病患者出现早期进行性肾功能减退(1年内eGFR下降率大于3.3%),其早期进行性肾功能减退与ESRD发生风险独立相关[19]。DEMAND研究发现在11 315例合并腎功能损害的T2DM患者,有20.5%的患者蛋白尿阴性[20]。另外,Retnakaran R等[21]对4000多例肾功能正常的T2DM患者进行随访观察15年,结果显示有28%的患者出现不同程度的肾功能下降,但肾功能下降患者中有51%的患者UACR水平正常。因此,进一步探讨伴蛋白尿阴性的T2DM中,其ABI异常与早期肾脏损害的关系是十分必要的。
本研究发现在654例T2DM患者中,蛋白尿阴性患者占49.08%,其中eGFR轻度下降组的ABI异常发生率高达35.72%,较eGFR正常组显著升高,同时,ABI异常是伴蛋白尿阴性的T2DM患者发生早期肾脏损害的独立危险因素。可见,ABI异常与伴蛋白尿阴性的T2DM患者发生早期肾脏损害密切相关,我们需早期进行ABI监测,以便早期诊断糖尿病肾病,延缓病情进展。
本研究存在以下局限性:首先,本研究人群为内分泌科住院患者,存在一定局限性,可进一步对社区糖尿病人群进行研究分析。其次,很多老年糖尿病患者可能存在下肢动脉硬化,ABI结果呈假阴性,本研究未去除此部分患者,可能对研究结果有一定影响。再次,本研究是横断面研究,需要进一步进行前瞻性研究,探讨ABI减低与ERSD的关系,为DKD的预防及治疗提供依据。
[参考文献]
[1] The American Diabetes Association. Summary of revisions for the 2010 clinical practice recommendations[J]. Diabetes Care,2010,33(1):S3.
[2] 中华医学会糖尿病学分会. 中国糖尿病肾脏疾病防治临床指南[J]. 中华内分泌代谢杂志,2019,(1):15-28.
[3] Chen SC,Lee MY,Huang JC,et al. Association of far-infrared radiation therapy and ankle-brachial index of patients on hemodialysis with peripheral artery occlusive disease[J]. Int J Med Sci,2016,13(12):970-976.
[4] Saeed L,Kifayat U,Imtiaz M,et al. Prevalence of peripheral arterial disease diagnosed by ankle brachial index among chronic kidney disease patients in a tertiary care unit[J]. Saudi Journal of Kidney Diseases and Transplantation,2015,26(5): 924-930.
[5] Bird CE,Criqui MH,Fronek A,et al. Quantitative and qualitative progression of peripheral arterial disease by non-invasive testing[J]. Vase Med,1999,(4):15-21.
[6] 张净,薛耀明. 2型糖尿病踝肱指数异常相关危险因素分析对糖尿病足的预测价值[J]. 中华内科杂志,2013, 52(11):951-954.
[7] Alvarez-Sabin J,Quintana M,Santamarina E,et al. Low ankle-brachial index predicts new vascular events and functional outcome after 1 year in patients with non-cardioembolic stroke:Our experience and review[J]. Eur J Neuurol,2014,21(1):100-106.
[8] 盧生芳,于峰,韩伏莅,等. 踝臂指数与缺血性脑卒中的关系[J].同济大学学报(医学版),2013,34(1):81-84.
[9] Xu B,Dai M,Li M,et al.Low grade albuminuria is associated with peripheral artery disease in Chinese diabetic patients[J]. Atherosclerosis,2014,(232):285-288.
[10] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版)[J]. 中华糖尿病杂志,2018,10(1):4-67.
[11] Levey AS,Bosch JP,Lewis JB,et al. A more accurate method to estimate glomerular filtration rate from serum creatinine:A new prediction equation. Modification of diet in renal disease study group[J]. Ann Intern Med,1999, 130(6):461-470.
[12] National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease:Evaluation,classification,and stratification[J]. Am J Kidney Dis,2002,39(1):S1-S266.
[13] Anderson JL,Halperin JL,Albert NM. Management of patients with peripheral artery disease(complilation of 2005 and 2011 ACCF/AHA guideline recommendations):A report of the American college of cardiology foundation/American heart association task force on practice guidelines[J]. Circulation,2013,127(13):1425-1443.
[14] Wilkinson CP,Ferris FR, Klein RE,et al. Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales[J]. Ophthalmology,2003,(110):1677-1682.
[15] Cho NH,Shaw JE,Karuranga S,et al. IDF Diabetes Atlas:Global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Research and Clinical Practice,2018,(138):271-281.
[16] 嚴丽,龚建忠,孔令怡. 2型糖尿病病人踝臂指数与尿微量白蛋白/肌酐比值的相关性分析[J]. 安徽医药,2019, 23(2):313-317.
[17] Chen FA,Yang CY,Yang WC,et al. Ankle-brachial index is a powerful predictor of renal outcome and cardiovascular events in patients with chronic kidney disease[J].Scientific World Journal,2012,2012(6):1-6.
[18] Jin X,Ma JH,Shen Y,et al. An analysis of the relationship between ankle-brachial index and estimated glomerular filtration rate in type 2 diabetes[J]. Angiology,2013, 64:237-241.
[19] Krolewski AS. Progressive renal decline:The new paradigm of diabetic nephropathy in type 1 diabetes[J]. Diabetes Care,2015,38(6):954-962.
[20] Dwyer JP,Parving HH,Hunsicker LG,et al.Renal dysfunction in the presence of normoalbuminuria in type 2 diabetes:Results from the DEMAND study[J]. Cardiorenal Med,2012,(2):1-10.
[21] Retnakaran R,Cull CA,Thorne KI,et al. Risk factors for renal dysfunction in type2 diabetes:U.K. prospective diabetes study 74[J]. Diabetes,2006,55(6):1832-1839.
(收稿日期:2019-08-30)
