弥散性血管内凝血诊断标准的变迁与展望
2019-01-05宋景春
■ 文 宋景春
弥散性血管内凝血(disseminated or diffuse intravascular coagulation,DIC)是临床常见的病理生理过程,可由感染、肿瘤、创伤、中毒、病理产科、肝病、血管病、热射病和自身免疫性疾病等多种疾病引起。经典DIC通常是指在上述致病因素作用下,凝血因子和血小板被激活,大量促凝物质入血,使凝血酶增加,进而微循环中形成广泛的微血栓,大量微血栓形成消耗了大量凝血因子和血小板,同时继发纤维蛋白溶解功能增强,导致患者出现明显的出血、休克、多器官功能障碍和溶血性贫血等临床表现的综合征。由于DIC致病因素的不同,其所对应DIC病理生理过程和临床特点也各有不同,故此增加了临床诊断的难度,现行的诊断标准也很难对各种病因的DIC都做到精确诊断。因此,本文拟针对DIC概念的演进、DIC现行诊断标准的评价、DIC亚型分型诊断标准和研究展望几个方面进行介绍。
DIC概念的演进
1928年,美国Gregory Shwartz man博士发现将少量的脑膜炎双球菌培养滤液注射到家兔皮下,经过8~24小时后,再将少量的同一滤液注射到静脉中时,4~8小时左右在皮内注射部位可引起出血和坏死等强烈的皮肤反应,这一现象被命名为“局部Shwartz man现象”。其后发现第一次通过静脉注入多种小剂量细菌培养液,经过8~24小时后第二次静脉注入内毒素,家兔除了出现局部皮肤损害外,还会出现血压下降甚至休克、双侧肾上腺皮质坏死、急性出血坏死性胰腺炎、暴发性紫癜、血小板与粒细胞减少症等多器官损害,这种现象被命名为“全身Shwartz man现象”。1951年,Schneider提出胎盘早剥的患者会出现纤维蛋白栓塞(Fibrin embolism),并将这一疾病正式命名为DIC。1955年,Stetson提出Shwartz man现象普遍存在凝血系统的显著改变,其机理主要与内毒素有关。同年,Crowell报道复苏后的急性循环衰竭也会出现严重凝血紊乱;Ratnoff报道妊娠期相关疾病如胎盘早剥、羊水栓塞、宫内死胎、先兆子痫等均可引起DIC;1956年Hardaway报道不同类型的输血会导致血管内凝血(Intravascular Coagulation)。1958年,美国陆军医院的Robert M报道用羊水静脉注射和异型血输注的方法成功复制狗的DIC模型,结果显示,DIC模型组肝、肺和肾的微动脉、微静脉和毛细血管均广泛形成血栓,并伴有血压下降,应用肝素治疗可减轻血栓负荷。1964年,凝血瀑布学说的提出让DIC研究者认识到DIC并不仅仅是血栓弥散形成的现象,而是一个涉及凝血与纤溶系统紊乱的多器官损害的综合征。1969年,DONALDG.MCKAY博士发表了题为《DIC研究进展》的综述,明确提出DIC的形成涉及血小板聚集、凝血因子Ⅴ、Ⅶ、Ⅷ、Ⅸ、Ⅹ的活化、纤维蛋白血栓形成、纤溶系统活化和纤维蛋白被分解成纤维蛋白单体一系列病理生理过程。DONALD同时也认为DIC的诊断应该综合临床表现、病理检查、止血机制检测和肝素治疗试验。当时的DIC概念已经对DIC的病理生理过程有了较为全面的认识,但是临床诊断要求微血栓形成的证据和出血倾向的临床表现,而临床实践中很难直接明确诊断微血栓,这为DIC的诊断造成很大困难。2001年国际血栓止血学会(International Society on Thrombosis and Haemostasis,ISTH)将 DIC 定义为不同病因导致局部损害而出现以血管内凝血为特征的一种继发性综合征,它既可由微血管体系受损而致,又可导致微血管体系损伤,严重损伤可导致多器官功能衰竭。这一定义强调了微血管体系在DIC发生中的地位,指出DIC作为各危重疾病的中间环节,终末损害是多器官功能衰竭。
DIC现行诊断标准及评价
1987年日本厚生省(the Japanese Ministry of Health,Labor and Welfare,JMHLW)颁布第一个DIC诊断积分系统。
该系统主要纳入临床症状、凝血酶原时间(prothrombin time,PT)比率、PLT计数、纤维蛋白降解产物(fibrin degradation products,FDP)和纤维蛋白原这些临床较普及的指标,根据不同程度的积分值来诊断DIC,评分≥7分即可诊断DIC,使DIC的临床诊断简便可行。JMHLW标准从典型DIC的凝血与纤溶系统的稳态破坏的角度对DIC进行诊断,是对DIC诊断的巨大贡献。该诊断标准提出时并未对DIC做出定义,是该评分系统的不足。
2001年,ISTH的科学标准委员会(the Scientific and Standardization Committee,SSC)正式颁布了目前国际上使用最广泛的诊断标准。这个DIC诊断积分系统主要采用PT、PLT、纤维蛋白原(fibrinogen,Fig)和D-二聚体等指标进行积分,积分≥5即可诊断为显性DIC,<5分为非显性DIC,需要继续每日评估。相对于JMHW标准,ISTH标准去除了临床症状体征,强调了DIC基础疾病的重要性。ISTH诊断标准发布时同时确定了DIC的定义,提出了显性DIC与非显性DIC的概念,并强调凝血紊乱的动态观察。ISTH诊断标准还强调了凝血系统分子标志物的重要性,其在非显性DIC诊断标准中提出了可溶性纤维蛋白单体(soluble fibrin monomer complex,sFMC)、 抗 凝血酶(antithrombin,AT)、蛋白 C(protein C,PC)、凝血酶-抗凝血酶复合物(thrombin-antithrombin complex,TAT)、纤维蛋白凝血酶原片段F1+2、纤溶酶-抗纤溶酶复合物(plasmin-antiplasmin complex,PAP)等,但是ISTH诊断标准并未给出分子标志物的具体变化范围。同样在显性DIC标准中,针对D-二聚体等纤溶指标也没有明确给出中度升高和重度升高的具体标准。根据多数文献研究的规范,通常把D-二聚体升高到正常值范围的2~10倍定义为中度升高,5倍以上定义为重度升高。有学者对JMHW和ISTH显性DIC诊断标准进行比较研究,结果显示两者的诊断一致率为67.4%,特别是对白血病患者两者诊断一致率较高。ISTH显性DIC诊断标准与JMHW标准相比特异性较高,但是敏感度低,提示ISTH显性DIC标准对诊断典型DIC效果显著,但很难诊断出早期阶段的DIC。
2005年,日本危重病协会(Japanese Association for Acute Medicine,JAAM)再次提出新的DIC诊断标准——JAAM诊断标准。出于对脓毒症的重视,JAAM诊断标准专门纳入SIRS评分,并且将血小板计数变化比率纳入积分,结合常规凝血项目评分,≥4分即可诊断DIC。JAAM标准更加关注DIC的炎凝交互作用,取消了纤维蛋白原这一低敏感、高特异的指标,增加了严重损伤的积分比重,提高了JAAM标准对炎症反应尤其是脓毒症相关凝血异常的敏感度。这三种DIC诊断标准对患者死亡率的敏感度和特异度各不相同,一般来说,JAAM标准的28d死亡率敏感度最高(80%,p<0.001), 而 ISTH显性DIC标准的特异度最高(71.4%,p<0.001)。近年来随着研究的不断深入,发现SIRS评分对预后的判断价值不大。2016年,脓毒症的定义进行了第三版更新,取消了SIRS的概念。因此,同年JAAM就对DIC诊断标准进行了修订。修订后JAAM诊断标准更偏重脓毒症,以AT3作为评价指标取代SIRS评分,以AT3活性≤70%积1分,>70%不积分评价DIC。研究结果显示,新版JAAM诊断标准对DIC患者的死亡率判断与原JAAM诊断标准类似,其益处在于引入AT3指标可能对脓毒症患者启动抗凝治疗的时机更加敏感。
此外,韩国血栓与止血学会(KoreanSociety of Thrombosis and Haemostasis,KSTH)在 2007年也颁布DIC的诊断标准,该标准主要纳入血小板计数、PT、APTT、纤维蛋白原和D-二聚体,总分采用3分制。有研究报道在131例患者中评价DIC患者,KSTH标准与ISTH相比诊断符合率为85%。2012年意大利血栓与止血学会颁布的《DIC诊断与治疗指南》中对于可疑DIC患者,建议应用ISTH、JMWH、JAAM评分,但不建议使用KSTH标准。
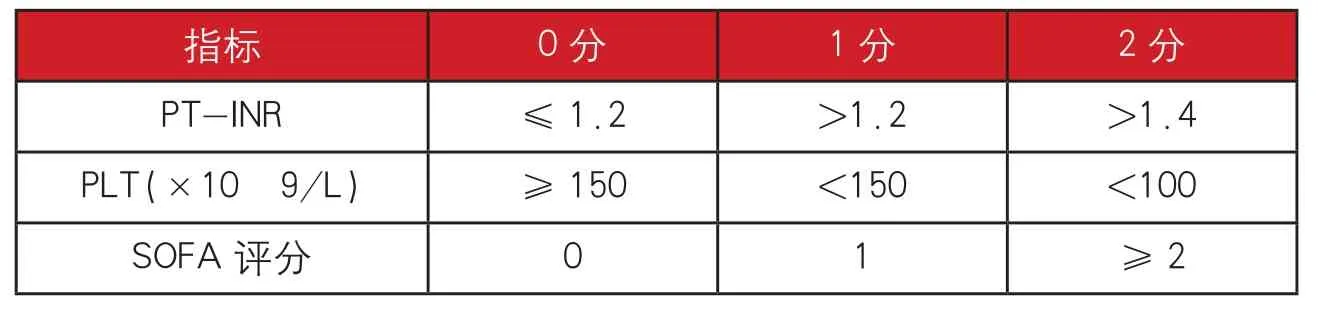
表1:脓毒症性凝血病评分系统Scoring for the diagnosis of sepsis-induced coagulopathy
DIC亚型的诊断标准
因为感染、肿瘤、创伤、中毒、病理产科、肝病、血管病、热射病和自身免疫性疾病等多种疾病均可引起DIC,因此ISTH的DIC诊断标准致力于用一种标准涵盖所有病因引起的DIC。但是越来越多的研究发现,不同病因引起的DIC在病理生理机制上有所不同,因此诊断标准也应有所不同。例如我国1999年第六届全国血栓与止血会议(武汉)制定的DIC诊断标准就包括针对肝病和白血病的特殊标准。2014年4月,日本学者Hideo Wada按照DIC的临床症状(病理机制)将DIC分为四种类型,即出血型(高纤型)、器官衰竭型(高凝低纤型)、大出血型(消耗型)和无症状型(前期)。出血型(高纤型)以纤溶亢进机制为主,临床主要表为出血,常见于创伤、白血病、产科疾病或主动脉瘤;器官衰竭型(高凝低纤型)以高凝低纤溶机制为主,临床主要表为微血栓导致的器官衰竭,常见于脓毒症;大出血型(消耗型)常见于严重外伤或产科疾病导致凝血因子严重消耗的患者,无症状型(前期)患者可仅有实验室检查异常而不表现临床症状。这种分类方法有机结合病因、病理机制和临床表现的分型,对临床治疗有一定的指导意义。
脓毒症所引起的DIC是经典DIC的病理生理过程,可分为经典的高凝期、消耗性低凝期、继发性纤溶亢进期,主要机制包括促凝机制上调、生理性抗凝机制受损和纤溶抑制。
2014年,日本学者Hiroyasu Ishikura等提出应用JAAM DIC诊断标准联合脓毒症诊断标准制定新的脓毒症性DIC诊断标准。研究筛选出两个新的脓毒症性DIC分子标志物Presepsin和PC。Presepsin是CD14的N端片段,亦称可溶性CD14亚型(sCD14-ST)。符合JAAM-DIC诊断标准的患者根据Presepsin和PC可分为三层:重度,presepsin>900 pg/mL且PC<45%;轻度,presepsin<650 pg/mL且PC>45%,或 650 < presepsin<900 pg/mL 并PC>55%;中度,即处于轻中度之间。该诊断标准对脓毒症性DIC诊断的灵敏度和特异度依次为80.7%和87.5%,轻中重度分级的死亡率依次为7.14%、15.4%,和28.6%。这样的诊断标准因为新型分子标记物在临床检验中的限制,很难在实际工作中应用。在脓毒症3.0定义颁布后,日本学者Iba T也相应提出新的脓毒症性凝血病的诊断标准。标准纳入PT比率、血小板计数和序贯器官衰竭(SequentialOrgan Failure Assessment,SOFA)评分三项指标,评分≥4分或前两项凝血相关积分之和>2分即可诊断(详见表1)。该标准对死亡率预测价值优于JAAM-DIC诊断标准(38.4%vs 34.7%)。

创伤大出血引发的凝血障碍也是近年来研究的热点问题,对于创伤时的凝血障碍是创伤性凝血病还是DIC的一种亚型还有不少争议。1975年,B.Schiefer等就提出了消耗性凝血病的概念,并阐述了DIC和消耗性凝血病的病理生理机制的区别,即DIC以广泛的血管内纤维素沉积为特征,而后者以凝血因子消耗造成出血为特征。后续临床研究中也出现了急性创伤性凝血病(acute traumatic coagulopathy,ATC)、创伤性凝血障碍(trauma-inducedcoagulopathy,TIC)、创伤早期的凝血病(early coagulopathy trauma)等诸多名词。2008年,美国学者John R.Hess在创伤杂志(Journal of Trauma)提出了“急性创伤休克性凝血病”(Acute Coagulopathy of Trauma-Shock,ACoTS)的概念,强调ACoTS的主要发病机制包括组织损伤、休克、血液稀释、低体温、酸中毒和炎症反应这六个方面,并强调ACoTS与DIC应该作为两种疾病来处理。
日本学者Gando则认为创伤性凝血病本质上是DIC的纤溶型,在急诊创伤患者接受急诊医疗干预之前就已出现,创伤、外科手术、感染和缺血再灌注损伤所带来的炎症、神经内分泌异常、凝血和纤溶失衡都只是机体的非特异反应,血液稀释和低体温仅是开始救治创伤后才出现的会影响DIC发展的因素。因此,ACoTS的概念并不具备独立提出的条件,反而不如应用DIC纤溶型(或出血型)更适合。临床诊断方面,创伤性凝血病目前常采用的诊断标准为:在明确创伤病史的前提下,APTT>35S和/或INR>1.2。这个诊断标准相对于DIC评分法比较宽松。2014年,学者Akiko Oshiro应用DIC评分法分析了562名创伤性凝血病患者,结果发现创伤早期DIC患者的高FDP、D-二聚体水平和高FDP/D-二聚体比率可以判定纤溶型DIC。纤溶型DIC会持续展现为低水平的PLT计数、纤维蛋白原水平和抗凝血酶活性,以及较高的INR、FDP和D-二聚体水平。血栓弹力图(thrombelastography,TEG)在评价创伤患者凝血功能障碍及指导成分血输注方面具有显著临床价值,对凝血异常的灵敏度高于普通凝血检查项目。笔者对应用TEG诊断128例创伤患者进行回顾性研究,结果显示采用TEG评分总分≥2分作为TEG DIC诊断标准,诊断DIC的发病率要高于ISTH—DIC诊断标准(TEG积分项目:R>582s=1;K>394s=1;Angle<39°=1;MA<39.5mm=1)。
研究展望
DIC作为一种临床综合征,迄今尚无金标准的诊断方法,采用积分法是目前主流的临床诊断方法,但是因为积分法纳入的诊断项目要考虑临床开展的可操作性,也可能影响到DIC诊断的敏感度和特异度。所以,要细化DIC分期、分型的早期诊断标准,势必需要筛选灵敏度和特异度都比较高的分子标志物。
目前针对DIC研究的分子标志物很多,涉及到血管内皮功能损伤、血小板活化、凝血系统启动、抗凝机制和纤溶活化等诸多方面,如何筛选到高效且便于开展的分子标志物,仍是下一步研究的重点。全血监测设备针对凝血功能监测具有明显优势,但对于DIC尚缺乏广泛认可的诊断标准,这也是后续研究的方向。
