槲皮素通过调控PI3K/Akt信号通路对血管内皮祖细胞发挥保护作用
2019-01-05温昌明张保朝暴向阳
孙 军,温昌明,张保朝,暴向阳
(1. 南阳市中心医院神经内科,河南 南阳 473000;2. 中国人民解放军军事医学科学院神经内科,北京 100850)
血管内皮细胞的前体细胞既称为成血管细胞,也称为内皮祖细胞(endothelial progenitor cells,EPCs),这类细胞可以积极参与到损伤血管的修复活动,其数量多少维持血管的正常活动[1]。EPCs能调控缺血性脑卒中疾病新生血管活动,保证EPCs的数量对于缺血性疾病的治疗是一个新的研究方向[2]。在血管氧化应激的状态下,外周血循环中EPCs的数量影响着损伤血管的内皮修复程度,同时,损伤时产生氧化应激反应会降低EPCs的生成。减轻氧化应激反应对EPCs损伤的影响,可有利于增加EPCs数量,促进新生血管的形成及血管内皮的修复,最终起到脑缺血部位保护修复作用[3]。PI3K/Akt信号通路能调节细胞代谢、生长、迁移、增殖等生理过程,文献指出,EPCs分化为内皮细胞过程中,PI3K/Akt的参与能促进EPCs分化为内皮细胞,使缺血部位得到新生和修复。
槲皮素(quercetin,Que)具有扩张血管降血压、防治冠心病、防治心肌缺血/再灌注损伤、抗血栓形成等多种功效,除此以外,Que还具有抗氧化的生物学活性,从而发挥对脑血管缺血病灶的修复和保护。研究也表明,Que能促进EPCs的增殖,但具体的机制尚未明确[4]。本文拟通过研究Que对氧化应激损伤EPCs的修复作用,探讨Que调控PI3K/Akt信号通路对损伤部位的作用机制。
1 材料与方法
1.1材料
1.1.1试剂 Que购自美国 Sigma 公司,纯度大于98%,以0.2 mmol·L-1溶于DMSO中;人纤连蛋白、碱性成纤维细胞生长因子(basic fibroblast growth factor,b-FGF)、FITC标记的荆豆凝集素-1(FITC-UEA-1),均购于Sigma公司;DiI标记的乙酰化低密度脂蛋白 (DiI-ac-LDL)购于Abcam公司;血管内皮生长因子(vascular endothelial growth factor,VEGF)购于Hyclone公司;胎牛血清购于Gibco公司;p-Akt、Akt、β-actin及二抗,均购自Abcam公司;WST-1检测试剂盒购自碧云天;cDNA, InvitrogenTM合成试剂盒、SYBR Green qPCR SuperMix(Thermo公司)。
1.1.2仪器 酶标仪、凝胶成像仪、电泳仪(Bio-Rad公司);荧光显微镜(日本奥林巴斯公司);LightCycler 480 System RT-PCR(Roche公司)。
1.2EPCs的分离及培养取自南阳市中心医院健康分娩新生儿的脐血(每份60 mL),已得到新生儿母亲的同意用于科学研究实验,该实验在南阳市中心医院重点实验室中进行。单个核细胞通过密度梯度离心方法进行分离,运用细胞培养技术接种于用人纤连蛋白包被的培养板上,加入一定量的M199培养液培养4 d,用缓冲液洗掉非贴壁细胞,M199培养液继续培养至d 7时,进行细胞鉴定。
1.3EPCs的鉴定EPCs在培养至d 7后,直接放在倒置相差显微镜下,观察细胞形态特征是否符合EPCs的特点。并利用染料DiI-ac-LDL与FITC-UEA-1进行染色,荧光显微镜下鉴定并拍照。
1.4实验分组及WST-1法筛选合适的Que实验浓度分离接种后的细胞培养至d 7后,用0.25%胰酶(不含EDTA)消化贴壁细胞,将细胞密度调整至2×109·L-1,每孔吸取2 mL均匀接种于6孔板,随机分为空白对照组(无细胞)、Que组(分别加入0、30、60、90、120 μmol·L-1Que预处理30 min,加入500 μmol·L-1H2O2再处理8 h)。每组设6个复孔,用WST-1法检测实验组4个浓度Que对EPCs增殖的影响,24 h后吸弃培养液,每孔加入WST-1溶液10 μL,培养箱内孵育2h后把96孔板置于摇床上摇动1 min,充分混匀在450 nm处测定吸光度(A)值。细胞活力=(A加药-A空白)/(A0加药-A空白)×100%。
1.5EPCs不同时段增殖情况将培养好的EPCs以2×103个均匀接种至96孔板,待细胞完全贴壁后,用M199培养液(不含血清)培养24 h,使每孔细胞生长情况一致。按分组再加入各种干预因素,根据WST-1结果筛选出两个浓度,Que实验组(60、90 μmol·L-1)分别加入60、90 μmol·L-1Que预处理30 min,再加入500 μmol·L-1H2O2处理8 h,期间每隔24 h换液1次,并按分组加入干预物质。培养12、24、48 h后,每孔分别加入10 μL WST-1溶液孵育2 h,酶标仪波长设置为450 nm,测定OD值。每组均设6个复孔,同时进行培养和检测。
1.6Westernblot检测Akt和磷酸化Akt蛋白的表达培养的细胞弃培养液,用PBS进行冲洗,加入裂解液15 min,刮下细胞进行超声和离心,BCA法测定蛋白浓度,调至等浓度。SDS-PAGE电泳,转膜,而后将膜封闭1 h,加入小鼠抗人Akt、磷酸化Akt单克隆抗体(1 ∶1 000),于4 ℃条件下轻摇过夜,d 2用TBST漂洗3次,每次10 min,加入HRP标记的二抗,室温轻摇2 h,再用TBST漂洗3次,用化学发光法进行曝光和显影,用Image J软件分析蛋白相对量。
1.7qPCR检测各组细胞PI3K、AKT3mRNA的表达用TRIzol法提取各组3个时间点的细胞总RNA,按cDNA合成试剂盒操作说明步骤进行扩增,设置反应条件:37 ℃反转录15 min,85 ℃ 5 s终止反应。引物序列见Tab 1,由上海生工生物公司设计合成。逆转录后,检测RNA纯度,并取适量逆转录产物按荧光定量PCR试剂盒操作说明进行扩增,设置扩增反应条件:95 ℃预变性30 s后,95 ℃ 5 s,60 ℃ 34 s扩增40个循环。扩增结果采用ABI7500SDS 软件中的Relative Quantification (ddCt) Study分析PI3K、AKT3 mRNA的相对表达量。

Tab 1 Prime sequence and PCR product length

2 结果
2.1EPCs的鉴定如Fig 1所示,刚分离得到的单核细胞置于倒置相差显微镜下观察,细胞形态呈圆形,胞体折光性好,为光亮透明的状态。培养7 d后,显微镜观察细胞体积增大,大多细胞呈梭形,生长呈集落样,并有一定的方向性,形态鉴定即为内皮祖细胞。培养7 d后的贴壁细胞,用Dil-ac-LDL和 FITC-UEA-1荧光染料处理后,在激光共聚焦显微镜下,双染色荧光黄阳性细胞为正在分化的 EPCs。

Fig 1 DiI-ac-LDL and FITC-UEA-1
2.2Que对EPCs的影响如Fig 2所示,Que在0~90 μmol·L-1范围内,无明显的细胞毒性,但30 μmol·L-1Que对EPCs增殖无任何作用。根据结果,后续实验选择60、90 μmol·L-1Que进行干预。
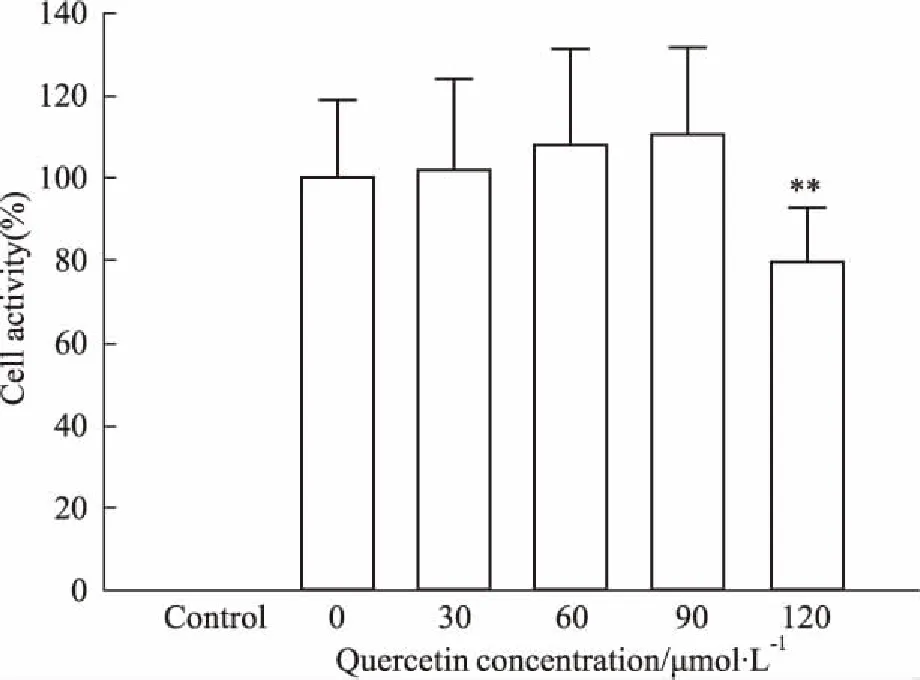
Fig 2 Effect of different concentrations of Que

**P<0.01vscontrol group
2.3Que对EPCs增殖的影响如Tab 2所示,在氧化应激条件下,与空白对照组比较, H2O2组EPCs增殖能力明显降低(P<0.01),加入60、90 μmol·L-1的Que处理后,H2O2诱导的EPCs损伤后的细胞增殖能力有明显改善,与H2O2组比较,差异有统计学意义(P<0.05,P<0.01)。
Tab 2 Effects of quercetin on EPCs proliferation at different
**P<0.01vscontrol;#P<0.05,##P<0.01vsH2O2
2.4Que对氧化应激时ECPs中Akt和p-Akt表达的影响Fig 3、Tab 3、Tab 4结果显示,与对照组比较,H2O2处理后的模型组各时间点Akt及磷酸化Akt表达明显下降。与H2O2模型组比较,加入Que 60、90 μmol·L-1从24 h开始,Akt和磷酸化Akt表达量明显升高,差异具有统计学意义。
2.5Que对EPCsPI3K、AKT3mRNA表达的影响如Tab 5、6 所示,与正常对照组相比,H2O2模型组细胞中PI3K、AKT3 mRNA 水平明显下降;与H2O2模型组比较,Que(60、90 μmol·L-1)干预后,3个时间点的PI3K mRNA水平明显升高;Que(60、90 μmol·L-1)干预后,3个时间点 AKT3 mRNA水平较 H2O2模型组明显上升(P<0.01,P<0.05) 。

Fig 3 Western blot analysis of Akt and p-Akt after 24 h
Tab 3 Expression of Akt after each period
*P<0.05vscontrol;##P<0.01vsH2O2

Tab 4 Expression of p-Akt after each cell culture period
*P<0.05vscontrol;##P<0.01vsH2O2
3 讨论
EPCs能分化为血管内皮细胞,其分化可以使血管重生和重新内皮化作用,其生理过程能在血管内壁修复损伤、新生血管、改善肿瘤病理等方面有多样的应用前景。据相关文献报道,EPCs一开始来源于骨髓,能释放至外周血中进行生理活动,并在条件和环境的变化中分化成内皮细胞,进行血管的新生和内皮破损地方修复,在各病理和组织工程学领域均有广泛的应用[5-6]。由于EPCs对于血管的功能的重要性,因此对作用机制及其影响因素进行探讨显得尤为重要,作为血管内皮的前体细胞能够定位到受损的血管壁的新生内膜中,成功分化为有修复功能的内皮细胞。氧化应激反应能够削弱EPCs的增殖、分化、黏附、迁移能力,其受损后的氧化代谢物能进一步加速EPCs的凋亡[7]。脑血管病是一种脑部动脉或支配脑的颈部动脉受损的疾病,极易导致颅内血液流动发生障碍,氧化应激过度产生的活性氧代谢物质,能造成缺血/再灌注氧化应激血管再度损伤,因此,从氧化应激角度保护EPCs是一项重要的课题[8]。H2O2能产生大量氧自由基,引起细胞内氧化应激反应,是建立细胞氧化应激反应模型常用试剂之一。本实验证实,H2O2培养8 h后,EPCs的增殖能力降低且活性低,多数细胞处于凋亡状态,证实细胞氧化应激模型的存在,在此模型上,研究Que对于氧化应激病理过程中EPCs的修复作用是如何进行的。

Tab 5 Effects of PI3K mRNA levels after cell culture
**P<0.01vscontrol;#P<0.05,##P<0.01vsH2O2

Tab 6 Effects of AKT3 mRNA levels after cell culture
**P<0.01vscontrol;#P<0.05,##P<0.01vsH2O2
文献报道,EPCs分化为内皮细胞的过程可能与PI3K/Akt信号通路有关。同时有研究显示,高密度脂蛋白可以激活PI3K/Akt信号通路,促使血管EPCs向内皮细胞分化的过程,进而诱导一氧化氮合酶生产,促进EPCs的增殖和分化[9]。这些研究结果均阐明,PI3K/Akt能作为促进EPCs增殖、分化的重要因素。Akt是位于PI3K下游的靶蛋白,是细胞内信号传导途径中重要的蛋白激酶,也是PI3K/Akt信号传导途径的中心环节影响蛋白,调节EPCs的代谢、生长、迁移及增殖过程。Akt的持续激活是EPCs生存增殖分化和抑制细胞凋亡功能的重要步骤。当膜外刺激信号激活PI3K蛋白后,其与Akt的结构域进行结合,使其信号转导到胞膜上,通过磷酸化多个底物蛋白,调节EPCs的分裂增殖、分化和存活[10]。本研究表明,模型组氧化应激模型下,内皮祖细胞Akt蛋白表达明显下降,PI3K、AKT3 mRNA明显下降,表明氧化应激反应能影响PI3K/Akt信号,对细胞的增殖分化形成阻碍作用,使EPCs的增殖减弱,细胞凋亡量增加。
Que是一种黄酮类化合物,对其功效研究日益增多,现代药理学研究证实,Que具有抗炎、抗氧化、清除氧自由基、抗黏附、免疫调节等功效,这些功效对于血管修复可以起到作用,使其在心血管疾病的防治修复方面具有广阔的临床应用前景。相关研究证实,Que能有效对抗氧化应激所致的内皮细胞凋亡,该功能对于保持血管内皮细胞的生理功能完整性和病理状态修复性都是有帮助的,能够有效减轻内皮细胞受到氧化应激刺激后的各种不良反应[11-12]。但是对于其如何作用于处于氧化应激状态下的EPCs,机制尚未明确,本研究从氧化应激相关信号通路入手,研究Que具体抗血管EPCs氧化应激下细胞凋亡的作用机制。
实验结果显示,与空白对照组对比,经过氧化氢处理的EPCs增殖能力明显降低,且通过检测磷酸化Akt、PI3K和AKT3的含量,从PI3K/Akt信号传导途径了解氧化应激对于EPCs的作用点。加入60、90 μmol·L-1Que处理12、24、48 h后,损伤的EPCs细胞增殖能力明显增加,与模型组对比差异具有统计学意义。同时,明显升高EPCs磷酸化Akt蛋白的表达,以及PI3K、AKT3 mRNA表达。Que发挥修复EPCs的作用与调节细胞内PI3K/Akt表达水平有明显的相关性,推测Que很可能是通过直接激活氧化应激下的EPCs下游的PI3K/Akt信号通路,来影响EPCs的各种生物学行为。后续实验将研究Que对于PI3K/Akt信号通路的作用靶点,深入探讨Que对氧化应激血管的修复机制。
(致谢:本实验在南阳市中心医院重点实验室完成,感谢课题组成员的支持和协助。)
