中间锦鸡儿CiPUB22基因克隆与功能分析
2019-01-04岳文冉于秀敏岳俊燕韩晓东王瑞刚李国婧
岳文冉,于秀敏,岳俊燕,杨 杞,韩晓东,王瑞刚,李国婧
(内蒙古农业大学 生命科学学院,内蒙古自治区植物逆境生理与分子生物学重点实验室,内蒙古自治区抗逆植物遗传资源利用与分子改良科技创新团队,呼和浩特 010018)
泛素/26S蛋白酶体途径(ubiquitin proteasome pathway, UPP)是一类重要的蛋白质翻译后修饰过程,它能有效地调节功能蛋白质的选择性降解[1],也是细胞进行自身功能调控的重要机制,包括两个连续的过程:第一步,在ATP存在下,泛素化系统将底物蛋白泛素化;第二步,26S蛋白酶体降解泛素化的靶蛋白[2]。UPP途径主要由泛素(Ub)、泛素活化酶(E1)、泛素结合酶(E2)、泛素连接酶(E3)和26S蛋白酶体组成,其中,泛素连接酶E3在底物的选择性降解过程中起到主要的作用[3]。
泛素连接酶E3的主要功能是识别将要被泛素化的靶蛋白,使活化的泛素接近特异靶蛋白的赖氨酸(Lys),从而将泛素转移到底物上去。在拟南芥中,编码E3基因的数量约1 400个[4],水稻中有1 300个[5]。植物中目前已经鉴定出的E3共分成5类[6]:HECT (homologous to E6-APC-terminus)、RING (really interesting new gene)/U-box、APC (anaphase promoting complex,后期促进复合物)、SCF (Skpl/Cullin or CDC53/F-box protein)复合体和CUL3-BTB。
U-box泛素连接酶是最早发现的E3泛素连接酶,结构域最早从酵母UFD2 (ubiquitin fusion degradation protein 2)中发现,含有70多个保守的氨基酸,是一种泛素链延长因子[7]。U-box是一种改造过的RING结构域,其含有保守组氨酸和半胱氨酸,通过分子间作用力整合金属离子稳定高级结构。目前,在拟南芥中有64个基因编码含有U-box的E3泛素连接酶[8],水稻中已经发现了77个[9]。
已有的研究表明,植物U-box型E3泛素连接酶参与对植物生长发育、生物及非生物胁迫响应等过程中关键步骤的控制[10]。近年来,已有很多关于PUB22和其同源基因PUB23的功能报道。拟南芥2个同源的U-box型E3泛素连接酶PUB22和PUB23与RPN12a互作并可以泛素化RPN12a,进而来调控植物对干旱胁迫的响应过程[11]。辣椒(Capsicumannuum) CaPUB1 (putative U-box protein 1),与拟南芥PUB22和PUB23同源性分别为51%与52%,研究发现,CaPUB1能够与RPN6互作,通过体外泛素化RPN6来调控植物对干旱和高盐胁迫响应[12]。Seo D H等[13]研究发现PUB22和PUB23在调控干旱胁迫响应过程中是不依赖ABA的,但是其调控机制还不清楚。Cho S K等[14]研究表明PUB22和PUB23能泛素化并降解RNP6。Zhao J F等[15]研究发现,拟南芥PUB22和PUB23通过泛素化降解ABA受体PYL9 (pyrabactin resistance-like)负调控拟南芥对干旱的耐受性。除此之外,PUB22和PUB23还参与PAMP (pathogen-associated molecular patterns)信号途径[16]和MPK3 (mitogen-activated protein kinase3)引起的免疫响应[17]。
中间锦鸡儿(Caraganaintermedia)属于豆科蝶形花亚科锦鸡儿属多年生落叶灌木,具有耐旱、耐寒、耐高温、耐盐碱等特性,是干旱草原、荒漠地带的优良固沙和水土保持植物;除此之外,中间锦鸡儿还有饲用价值和药用价值,也是生物质能源和造纸材料[18-19]。本研究在中间锦鸡儿干旱胁迫转录组文库中找到1条E3泛素连接酶编码基因的全长cDNA序列,生物信息学分析发现其属于U-box型E3泛素连接酶PUB22。利用荧光定量PCR技术对CiPUB22在脱水、干旱、盐和ABA等处理下的表达进行了定量分析。并通过构建植物表达载体,将CiPUB22在拟南芥中过表达,对转基因纯合体株系在种子萌发过程中对盐和渗透胁迫的耐受性进行了初步分析。为进一步探究CiPUB22基因在中间锦鸡儿响应逆境胁迫过程中的功能奠定了基础。
1 材料和方法
1.1 实验材料及植物处理方法
中间锦鸡儿种子采于内蒙古自治区乌兰察布市四子王旗,播种于营养土和蛭石(1∶2)的混合土中,置于22 ℃、16 h光照/8 h黑暗的温室中进行培养。
选1个月苗龄长势一致的植株进行脱水、NaCl和ABA处理。将苗从土中小心取出,洗净分别置于滤纸、含300 mmol/L NaCl、100 μmol/L ABA溶液中处理,分别在处理后的0、1、3、6、12、24和48 h进行取样,每个时间点取3株植物的地上部分,液氮速冻,-80 ℃保存。每种处理均进行3次生物学重复实验。
干旱处理:植株正常生长1个月,最后一次浇水1 d后取样作为对照,之后停止浇水,每隔3 d取样1次,干旱16 d后复水,复水2 d后再取样,取样时间点分别为0、3、6、9、12、15和17 d (16F),取样方法同上。
野生型拟南芥(Arabidopsisthaliana) Columbia-0生态型(Col-0)由本实验室保存,植物表达载体pCanG-HA由中国科学院遗传与发育研究所谢旗研究员惠赠,大肠杆菌DH5a及农杆菌GV3101由本实验室保存。
1.2 方 法
1.2.1总RNA提取与反转录利用Trizol法提取中间锦鸡儿总RNA。用超微量核酸蛋白测定仪(美国Quawell-超微量分光光度计Q5000)对RNA浓度进行测定,用琼脂糖凝胶电泳检测RNA质量,选取质量好的RNA进行cDNA第一链的合成,按试剂盒(全式金,AT311-03)说明书进行操作。
1.2.2不同胁迫处理下的表达分析根据转录组数据库中获得的基因序列,利用软件Primer 5设计引物F-CiPUB22-Q (TCAGAAAAGGTAACAA-AAGCGACA)和R-CiPUB22-Q (TTCAGCTCTTCCCTCAGCACA)。采用SYBR GreenⅠ荧光染料法检测,利用LightCycler 480实时荧光定量PCR仪(Roche公司)进行扩增。反应体系为:10 μL SYBR Premix Ex Taq (TaKaRa公司),上下游引物各0.4 μL(10 μmol/L),稀释模板5 μL,DEPC水4.2 μL,总体积20 μL。反应程序为: 95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火15 s,72 ℃ 延伸30 s,40个循环,实验结果用2-ΔΔCt方法计算。
所用内参引物为qCiEF1α-F (CAAAAAGTCCCCTCGTTGTCTC) 和qCiEF1α-R (AGCAATC-GTTCTTCCTAATGATCTAA);qAtEF1α-F (AGAA-GGGTGCCAAATGATGAG)和qAtEF1α-R (GGA-GGGAGAGAGAAAGTCACAGA)。
1.2.3基因克隆与表达载体构建以中间锦鸡儿1个月苗龄幼苗的cDNA为模板,根据pCanG-HA表达载体的多克隆位点,设计含有SalⅠ和SacⅠ酶切位点的特异引物F-CiPUB22 (GCGTCGACATGGATGAGATCGATGTTCCT,下划线为SalⅠ酶切位点)和R-CiPUB22 (GCGAGCTCTTTCACACATAATTAGGGTACGA,下划线为SacⅠ酶切位点)进行PCR扩增,扩增条件为:98 ℃预变性3 min,98 ℃变性15 s,57 ℃退火30 s,72 ℃延伸1 min, 30个循环;72 ℃补充延伸10 min。利用琼脂糖凝胶回收试剂盒(天根生物公司)回收目的片段,并连入pEASY-Blunt Simple 载体中(北京全式金生物公司),转化大肠杆菌DH5a感受态细胞,菌落PCR及酶切验证重组子,菌液送测序,将验证正确的质粒连入表达载体pCanG-HA中,进行菌落PCR及酶切验证,将验证正确的重组质粒电转化农杆菌GV3101,挑取阳性克隆进行PCR与测序验证,本实验所用引物及测序由上海生工生物工程技术服务有限公司完成。
1.2.4拟南芥遗传转化通过浸花法将重组质粒pCanG-CiPUB22转化野生型拟南芥[20],把收取的种子种在含有25 mg/L卡那霉素的1/2MS培养基中筛选阳性植株,筛选得到T3代纯合体株系。提取纯合体株系RNA,将其反转录成cDNA,利用实时荧光定量PCR对转基因纯合体株系表达量进行检测,选取表达量较高的3个株系进行后续实验。
1.2.5胁迫处理下种子萌发率检测拟南芥种子先用75%乙醇灭菌10 min,再用无水乙醇灭菌10 min,待种子晾干后分别种在含有150 mmol/L NaCl、1 μmol/L ABA、400 mmol/L甘露醇和对照的1/2MS培养基中,每个株系55颗种子,4 ℃同步化处理3 d,取出置于22 ℃、16 h光照/8 h黑暗的温室中进行培养,24 h后开始统计萌发率。
2 结果与分析
2.1 CiPUB22基因的克隆和表达载体构建
分析显示中间锦鸡儿干旱转录组文库中获得的E3泛素连接酶编码基因,具有完整的开放阅读框和部分UTR序列。因此,根据pCanG-HA表达载体设计含有SalⅠ和SacⅠ酶切位点的特异引物F-CiPUB22和R-CiPUB22,利用中间锦鸡儿cDNA为模板,进行PCR扩增,得到目的片段(图1, A)。将克隆得到的序列片段连入pEASY-Blunt-Simple 克隆载体中,将测序验证正确的序列用SalⅠ和SacⅠ酶切后连入表达载体pCanG-HA中,将重组表达载体pCanG-CiPUB22转化大肠杆菌,挑取阳性克隆菌落质粒,用SalⅠ和SacⅠ酶切(图1, B),结果表明酶切片段正确,重组载体构建成功。将验证正确的重组质粒电转化农杆菌GV3101,挑取阳性克隆进行PCR验证,结果如图1, C所示。
2.2 CiPUB22基因序列分析
克隆得到的CiPUB22基因的cDNA序列,包含1 260 bp开放阅读框,起始密码子ATG,终止密码子TGA,编码419个氨基酸(图2)。将氨基酸序列在NCBI上进行BlastP比对,发现其具有U-box型结构域,与苜蓿(Medicagotruncatula) PUB23蛋白(XP_013450220.1)、鹰嘴豆(Cicerarietinum) PUB22蛋白(XP_004494254.1)、木豆(Cajanuscajan) PUB22蛋白(XP_020225250.1)、拟南芥PUB22 (NP_190813.1)和PUB23蛋白(OAP08906.1)相似性分别为84%、84%、81%、58%和58%,说明克隆得到的该基因属于U-box型基因,因此将其命名为CiPUB22。利用MEGA5邻近相接法构建系统进化树(图3),CiPUB22与苜蓿PUB23和鹰嘴豆PUB22蛋白聚类到一起,序列比对结果显示蛋白序列相似度分别为84%,亲缘关系最近。
2.3 CiPUB22基因表达分析
利用荧光定量PCR对CiPUB22基因在不同胁迫处理下的表达模式进行分析,干旱胁迫处理12 d后CiPUB22基因的表达量达到最高水平,约为未处理时表达量的2.5倍,15 d后逐渐下降(图4, A)。脱水胁迫处理1 h后CiPUB22表达量上升到最高水平,达到未处理的12倍左右,3 h后表达量开始逐渐下降,12 h达最低,低于未处理的表达量,24 h基本恢复到未处理时的表达水平。在NaCl胁迫处理后,CiPUB22基因在1 h后表达量达最高约为未处理的35倍左右,3 h后呈逐渐下降趋势。在ABA处理1 h后,CiPUB22基因表达量最高约为未处理的7倍,但3 h后表达量下降,基本与未处理的表达量一致,6 h后低于未处理的表达量(图4, B)。这些结果表明CiPUB22的转录水平受非生物胁迫诱导,推测CiPUB22可能参与中间锦鸡儿抵抗非生物胁迫的分子机制。
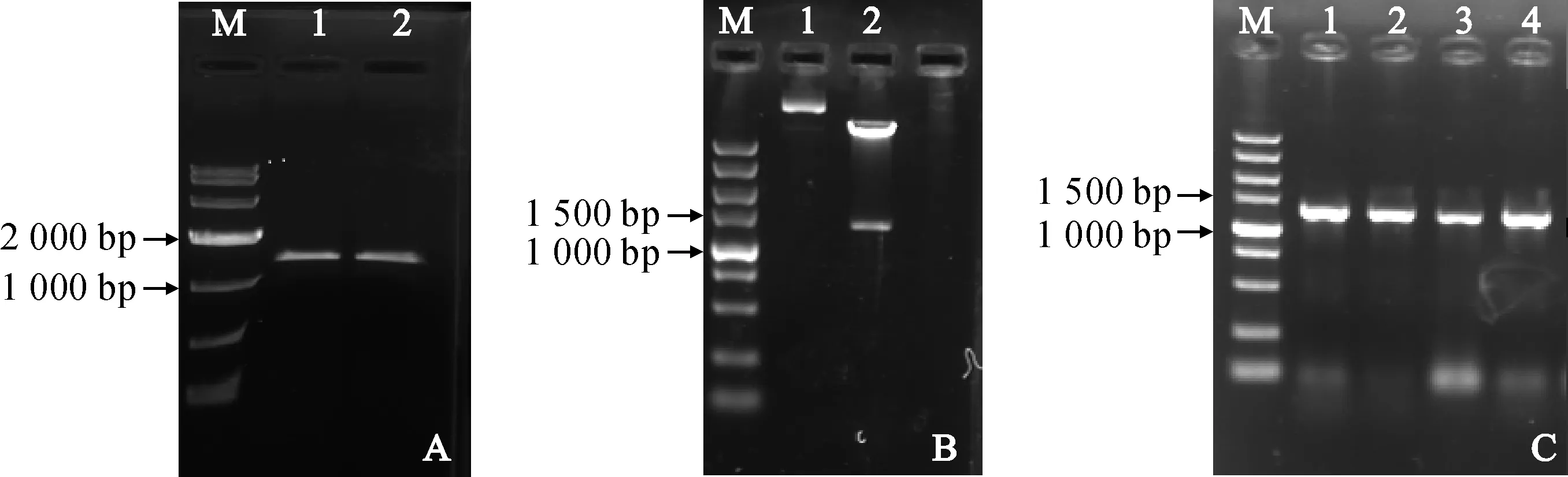
A. CiPUB22, M. DL10000; 1和2. CiPUB22 cDNA; B. pCanG-CiPUB22重组载体酶切验证; 1.重组载体对照; 2. Sal Ⅰ和Sac Ⅰ双酶切结果; M. DL5000; C. pCanG-CiPUB22菌落PCR验证; 1~4. 单克隆; M. DL5000图1 pCanG-CiPUB22表达载体构建A. CiPUB22, M. DL10000; 1, 2. CiPUB22 cDNA. B. Identification of pCanG-CiPUB22 digested by restriction enzyme. 1. Vector control; 2. Digest with Sal Ⅰ and Sac Ⅰ; M. DL5000; C. Identification of pCanG-CiPUB22 by colony PCR; 1-4. Random single colony; M. DL5000Fig.1 The construction of pCanG-CiPUB22 recombinant vector

图3 CiPUB22与其他植物相关蛋白系统进化分析Fig.3 Phylogenetic analysis of CiPUB22 and other related proteins
2.4 CiPUB22转基因纯合体表达分析
将重组植物表达载体pCanG-CiPUB22转入野生型拟南芥,筛选出具有卡那霉素抗性的T3代阳性纯合植株8株,提取这些株系的RNA,反转录合成cDNA,利用基因特异引物F-CiPUB22和R-CiPUB22进行PCR鉴定,如图5, A所示,以野生型拟南芥cDNA为模板没有扩增出目的条带,而中间锦鸡儿和8个转基因株系均扩增出目的条带,表明CiPUB22基因在转基因株系中表达,利用qRT-PCR对8个转基因株系的表达水平进行检测,如图5, B所示,选取表达量最高的3个株系T3-6、T3-19和T3-24进行后续实验分析。
2.5 CiPUB22转基因拟南芥种子萌发率检测
将野生型拟南芥和3个过表达株系的种子,分别种在含有0、150 mmol/L NaCl、1 μmol/L ABA和400 mmol/L甘露醇的1/2 MS培养基中,统计种子萌发情况。在1/2MS培养基中,3个过表达株系的萌发率与野生型一致(图6, A和E),1 μmol/L ABA处理第4天时,野生型萌发率为97%,3个过表达株系的萌发率分别为90%、75%和82%(图6, B和F)。在含有150 mmol/L NaCl的培养基中,萌发第5天时野生型的萌发率为94%,3个过表达株系的萌发率分别为86%、61%和66%(图6, C和G)。在400 mmol/L甘露醇处理下,3个过表达株系的萌发率均低于野生型(图6, D和H)。以上结果表明:异源表达CiPUB22基因降低了拟南芥种子萌发阶段对盐、渗透胁迫和ABA的耐受力。
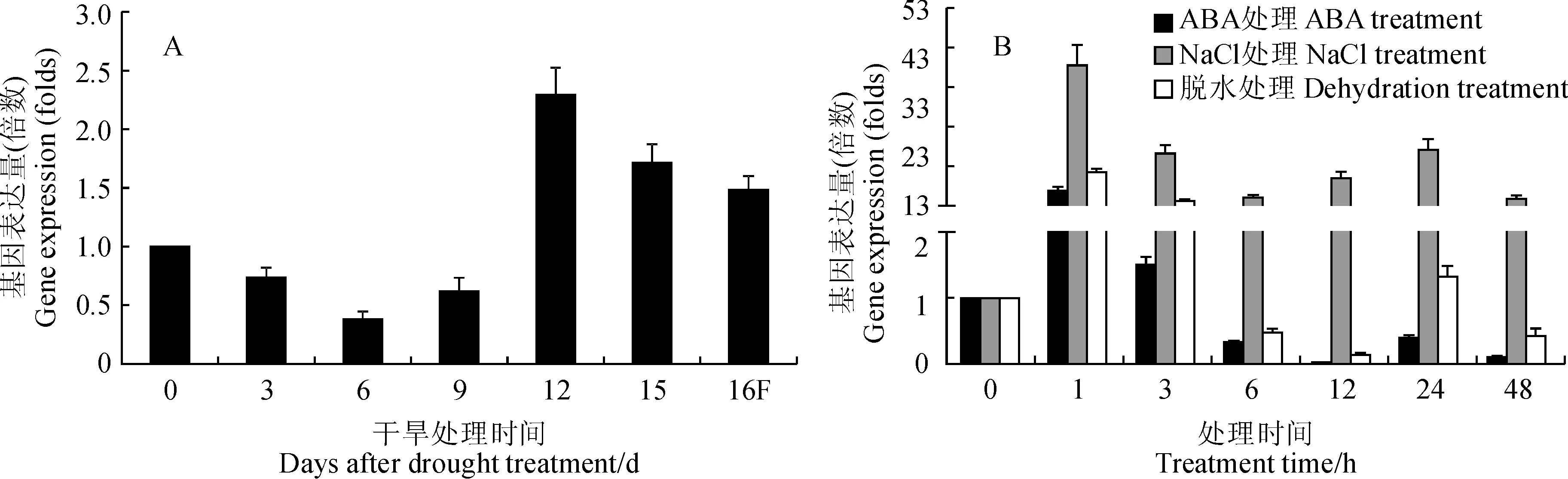
图4 qRT-PCR检测各种处理条件下CiPUB22基因的表达Fig.4 The expression of CiPUB22 under different treatments detected by qRT-PCR

A. CiPUB22转基因株系RT-PCR鉴定: M. DL2000; C-. 阴性对照(拟南芥cDNA);C+. 阳性对照(中间锦鸡儿cDNA); B. qRT-PCR鉴定CiPUB22转基因株系表达量图5 CiPUB22转基因株系验证与表达水平检测A. RT-PCR identification of CiPUB22 transgenic Arabidopsis lines: M. DL2000; C-. Negative control (Arabidopsis cDNA); C+. Positive control (Caragana intermedia cDNA); B. qRT-PCR analysis of CiPUB22 expression in CiPUB22 transgenic Arabidopsis linesFig.5 Identification and expression analysis of CiPUB22 transgenic Arabidopsis lines
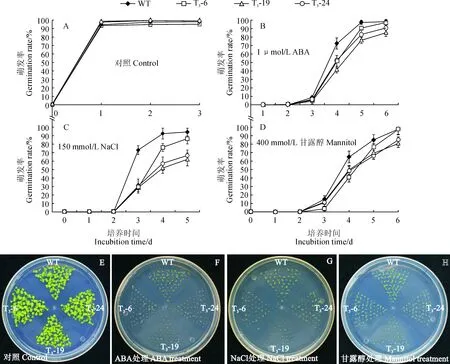
A~D.野生型和过表达株系萌发率统计; E~H. 对照, 1 μmol/L ABA, 150 mmol/L NaCl 和400 mmol/L甘露醇处理野生型和过表达株系生长情况, 图片为生长第6天拍照图6 不同处理下转基因株系与野生型萌发率检测A-D. Seed germination rates of the wild-type and CiPUB22 transgenitic lines. E-H. Phenotypes of the wild-type and CiPUB22 transgenic lines on 1/2MS medium supplemented with or without 150 mmol/L NaCl, 1 μmol/L ABA and 400 mmol/L mannitol. Photographs were taken 6 days after the end of stratificationFig.6 Germination assays of the transgenic lines and wild type under different treatments
3 讨 论
环境胁迫,如干旱、盐碱、极端温度等严重影响农作物的产量和品质。植物受到胁迫以后会激活一系列生理反应过程来应对胁迫,泛素化过程是真核生物所特有的选择性降解体内蛋白的过程,生物胁迫和非生物胁迫都会诱导泛素化过程发挥功能,而E3泛素连接酶在选择性降解靶蛋白中发挥重要作用,因此对E3泛素连接酶的研究已经成为了热点。
已有实验证明,拟南芥PUB22和PUB23两个同源U-box型E3泛素连接酶基因,其转录水平受非生物胁迫诱导,但是对ABA不敏感[12]。在本实验中,通过Blast分析发现,该基因属于plant U-box型E3泛素连接酶PUB22基因,CiPUB22受脱水、干旱和盐等胁迫的不同程度的诱导与报道的结果一致,说明CiPUB22基因参与响应干旱和盐胁迫,可能与植物抗逆胁迫有关。前人报道PUB22不受ABA处理诱导[12],本实验发现CiPUB22基因在ABA处理1 h后,表达量最高约为未处理的7倍左右, 3 h后表达量下降基本与未处理的表达量一致,6 h后低于未处理的表达量。说明CiPUB22基因能够受ABA诱导,这一结果与前人报道不一致,还有待于进一步研究。
ABA在植物生长发育和响应逆境胁迫过程中发挥重要作用,包括调控种子发育与抑制种子萌发[21],已有研究证明,很多U-box型E3泛素连接酶参与种子萌发过程,如AtPUB18 和AtPUB19是2个同源性最高的蛋白,AtPUB18 或者AtPUB19任意一个基因突变以后与野生型相比,对ABA和盐抑制的种子萌发都没有任何变化;但是pub18pub19双突变体种子萌发则表现出对ABA和盐抑制不敏感的表型[13];pub44和pub43的突变体种子萌发表现出对ABA抑制的不敏感表型[22]等。种子萌发率实验中发现,在150 mmol/L NaCl和400 mmol/L甘露醇处理后,过表达株系的萌发率低于野生型,说明CiPUB22减弱了转基因拟南芥在种子萌发阶段对盐和渗透胁迫的耐受力。在本研究中发现,ABA处理以后过表达株系的萌发率低于野生型,说明CiPUB22增加了转基因拟南芥对ABA的敏感性。目前还没有报道证明CiPUB22基因在种子萌发过程中的功能,其具体作用机制还需要进一步验证。
