不同油脂水平日粮添加胆汁酸对肉鸡肝脏及其脂代谢的影响
2019-01-03葛晓可李璐马晓娇孟慧园王安谙冯程程张婧菲周岩民李金宝王恬张莉莉
葛晓可 李璐 马晓娇 孟慧园 王安谙 冯程程 张婧菲 周岩民 李金宝 王恬 张莉莉


摘要:旨在研究在不同油脂水平的日粮中添加胆汁酸(BAs)对肉鸡肝脏损伤及其脂质代谢功能的影响。选取360羽1日龄、体质量相近的AA(Arbor Acres)肉鸡,随机分配到4个组中,试验采用2×2因子设计,即2个油脂添加水平(基础日粮:前期添加量为2%,后期添加量为4%。高脂日粮:前期添加量为3%,后期添加量为5.5%),以及2个BAs添加水平(水平1:前期添加量为0 g/t,后期添加量为0 g/t。水平2:前期添加量为60 g/t,后期添加量为80 g/t),每组设6个重复,每个重复设15羽鸡,试验期为42 d。结果表明,高脂日粮显著提高了肉鸡的肝脏指数和腹脂率(P<0.05),增加了肉鸡肝脏中的甘油三酯(TG)含量,增强了血清中的丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)活性(P<0.05)。此外,高脂日粮显著增强了肝脏脂肪酸合成酶(FAS)活性(P<0.05),降低了激素敏感脂酶(HSL)活性(P<0.05),并且在增加了载脂蛋白B基因(ApoB)和肝型脂肪酸结合蛋白基因(L-FABP)表达量(P<005)的同时,显著降低了脂蛋白脂酶基因(LPL)表达量(P<0.05)。而在日粮中添加BAs则显著降低了肉鸡的腹脂率以及肝中的TG水平(P<0.05),并降低了血清中的AST、ALT活性(P<0.05)。此外,BAs还显著降低了肝脏的FAS活性和L-FABP的基因表达量(P<0.05),并提高了HSL活性和LPL基因表达量(P<0.05)。另外,BAs可以显著降低高脂日粮介导的肝脏指数以及肝中ApoB基因表达量的提高(P<0.05)。综合试验结果可以看出,在日粮中添加BAs对肉鸡肝脏有保护作用,并可以在一定程度上缓解高脂日粮引起的肝脏损伤与脂代谢功能异常。
关键词:胆汁酸;肉鸡;脂肪肝;肝损伤;脂代谢;高脂日粮;添加剂
中图分类号: S831.5文献标志码: A
文章编号:1002-1302(2019)21-0236-05
收稿日期:2018-09-05
基金项目:江苏省自然科学基金青年基金(编号:BK20160739)。
作者简介:葛晓可(1992—),女,安徽滁州人,硕士研究生,主要从事动物营养与饲料科学方面的研究。E-mail:470688924@qq.com。
通信作者:王恬,博士,教授,主要从事动物营养与饲料科学方面的研究,E-mail:twang18@163.com;张莉莉,博士,副教授,主要从事动物营养与饲料科学方面的研究,E-mail:zhanglili@njau.edu.cn。
油脂除了能提供畜禽生长所必需的脂肪酸外,还是饲料能量的主要来源,在饲料中添加油脂,不仅能够提高饲料报酬,还能提高畜禽的生长性能[1-2]。然而,较多研究表明,在实际生产中,对于家禽,尤其是幼禽来说,体内有限的消化酶及乳化剂常常不能对日粮中的油脂及其他脂溶性营养素进行有效的吸收和利用,这不但会造成资源浪费,还会对家禽的健康带来不利影响[3-4]。家禽对日粮油脂吸收的不完全,会造成体脂过度沉积,降低胴体品质,同时,高脂日粮还可能会增加肝脏负担,导致肝脏损伤,造成机体物质能量代谢紊乱[5-6],势必会给养殖业带来较大损失,这也成为目前畜牧生产实践中关注的热点问题之一。
胆汁酸(BAs)是肝脏细胞内胆固醇的一种代谢产物,其分子既具有亲水性又具有亲脂性,这种两性结构使其成为一种表面活性较强的乳化剂,能有效乳化脂类物质,加速机体对脂类营养素的吸收与消化[7]。近几年来,BAs在畜牧业中的积极作用已经有相关报道,在日粮中添加BAs可以提高肉鸡的生长性能,促进饲料养分利用率的提高,改善胴体品质等[8-9]。除了作为促进脂质吸收的乳化剂,BAs还可作为一种信号分子,通过激活法尼基衍生物X受体(FXR)、G蛋白偶联膜受體等参与机体糖脂代谢的调节[10-11]。BAs对肝脏的保护及对肝病的治疗作用在人类医学研究中已有较多成果,其激活的FXR作为治疗非酒精性脂肪肝的疗法已经得到越来越多的证实[12-14]。目前,关于BAs对家禽肝脏及其相关功能影响的研究鲜有报道。本试验通过在不同油脂水平的日粮中添加BAs,探究其对肉鸡肝脏损伤以及脂代谢功能的影响,以期为今后BAs在畜牧兽医生产研究中的应用提供相应的科学依据。
1材料与方法
1.1试验材料
本试验中所用BAs购自山东龙昌动物保健有限公司(纯度为99%);试验所用AA(Arbor Acres)肉鸡购自安徽和威农牧有限公司。
1.2试验设计与饲养管理
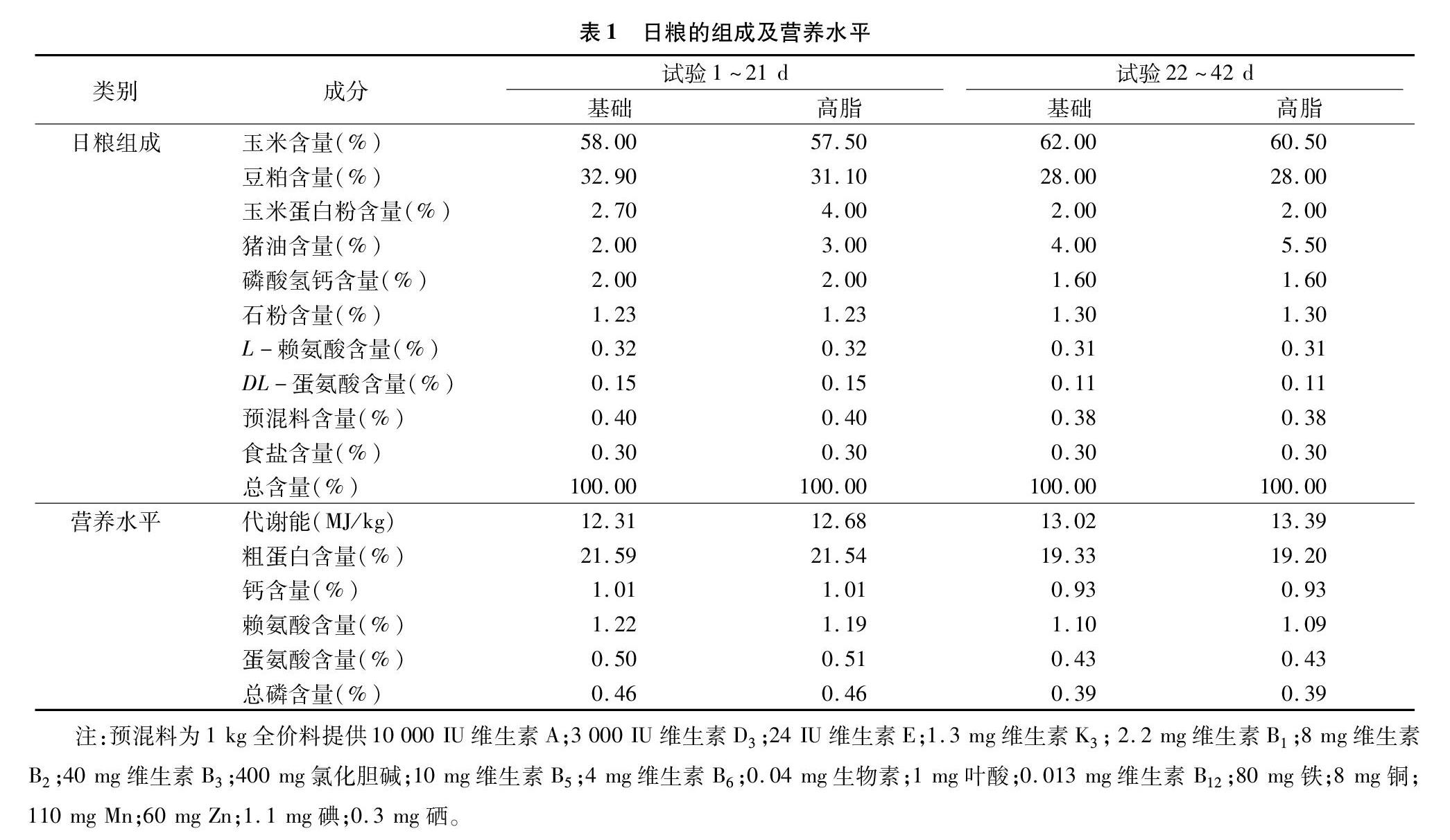
选取360羽(44.71±0.27) g、1日龄的AA肉鸡,随机分成4组,采用2×2因子设计,即2个油脂添加量水平(水平1的前期添加量为2%,后期添加量为4%;水平2的前期添加量为3%,后期添加量为5.5%),以及2个BAs添加量水平(水平1的前期添加量为0,后期添加量为0;水平2的前期添加量为60 g/t,后期添加量为80 g/t),每组设6个重复,每个重复设15羽鸡。肉鸡采用多层笼饲养,自由饮水,连续24 h光照,免疫程序按照常规进行,每天06:00、17:00喂料,试验期为42 d。日粮配方和营养水平见表1[营养需要参照2017年美国国家科学研究委员会(NRC)制定的标准]。
1.3样品采集
在试验后42 d的06:00(此前停饲12 h,自由饮水),每个重复随机抽取1羽鸡,称质量后颈静脉放血于离心管中,于4 ℃放置,待血清完全析出后,3 500 r/min离心15 min后获得血清,保存于-20 ℃冰箱中待测。颈动脉放血致死后立即解剖,完整剥离腹脂并称质量,分离取出肝脏,在同一侧取约2 g肝脏组织放入冻存管内,置于-80 ℃冰箱内待测。
1.4测定指标及方法
1.4.1血清指标血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)活性采用试剂盒测定,所用试剂盒均购自南京建成生物工程研究所。
1.4.2肝脏脂质含量和脂代谢酶活性称取0.3 g左右肝脏组织样品,按1 g ∶9 mL的比例加入生理盐水,匀浆后离心取上清,即肝脏组织匀浆液,于-20 ℃冰箱保存待用。肝脏甘油三脂(TG)、总胆固醇(T-CHO)含量采用试剂盒检测;肝脏脂肪酸合成酶(FAS)、乙酰辅酶A羧化酶(ACC)和激素敏感脂酶(HSL)活性采用酶联免疫吸附测定(ELISA)试剂盒测定,所用试剂盒均购于南京建成生物工程研究所。
1.4.3肝脏脂代谢相关基因表达量采用实时荧光定量PCR(qRT-PCR)法测定肝脏中载脂蛋白B(ApoB)、肝型脂肪酸结合蛋白(L-FABP)、脂蛋白脂酶(LPL)和羟甲基戊二酸单酰辅酶A还原酶(HMGCR)的mRNA表达水平。使用TRIzol(Invitrogen公司)提取肝脏RNA,随后采用Prime ScriptTM试剂盒(TaKaRa公司)进行反转录,得到相应的cDNA。用SYBR Premix Ex TaqTM试剂盒(TaKaRa公司)进行qRT-PCR,所有操作步骤严格按照说明书进行,以β-actin作为内参基因,结果用2-ΔΔCT法进行计算。目的基因的引物序列根据GenBank上鸡的相关序列进行设计,详见表2。
1.5数据分析
试验数据采用SPSS 20.0软件中的一般线性模型(general liner model,简称GLM)进行主效应(油脂、BAs)及互作效应分析。当P<0.05时,认为差异显著;当互作效应有显著差异(P<0.05)时,则各处理组采用Duncans法进行多重比较。统计结果以平均值±总标准误(SEM)表示。
2结果与分析
2.1在不同油脂水平日粮中添加BAs对肉鸡肝脏指数和腹脂率的影响
由表3可知,高脂日粮能显著提高肉鸡的肝脏指数和腹脂率(P<0.05),而BAs组肉鸡的肝脏指数和腹脂率却显著下降(P<0.05),并且油脂水平和BAs对肉鸡肝脏指数的影响存在交互作用(P<0.05),添加BAs能显著降低高脂组肉鸡的肝脏指数(P<0.05)。日粮的BAs和油脂水平对肉鸡活质量无显著影响。
2.2在不同油脂水平日粮中添加BAs对肉鸡肝脏损伤程度的影响
由图1可知,高脂日粮会导致肉鸡血清的ALT、AST活性以及肝脏中的TG含量显著升高(P<0.05),而在日粮中添加BAs能显著降低肉鸡血清的ALT、AST活性以及肝脏中的TG水平(P<0.05),并且日粮油脂水平和BAs添加量对肉鸡肝脏AST活性存在交互作用(P<0.05),相比于在基础日粮中添加BAs,在高脂日粮中添加BAs降低肉鸡肝脏AST活性的效果更显著(P<0.05)。油脂和BAs水平对肉鸡肝脏中T-CHO 含量无显著影响。
2.3在不同油脂水平日粮中添加BAs对肉鸡肝脏脂代谢酶活性的影响
由表4可知,日粮油脂、BAs水平对肉鸡肝脏ACC活性无显著影响;高脂日粮会导致肉鸡肝脏的FAS活性上升,并降低HSL活性(P<0.05),而在日粮中添加BAs,会降低肉鸡肝脏的FAS活性并且升高HSL活性(P<0.05)。日粮中的油脂、BAs水平对肉鸡肝脏ACC、FAS和HSL活性无显著的交互作用。
2.4在不同油脂水平日粮中添加BAs对肉鸡肝脏脂代谢基因的影响
由图2可知,高脂日粮能显著增加肉鸡肝脏LPL、ApoB、L-FABP基因的mRNA表达量(P<0.05),而相比于未添加BAs的处理组,BAs处理组则可以显著降低LPL、ApoB、L-FABP基因的mRNA表达量(P<0.05)。此外,油脂水平、BAs对肉鸡肝脏ApoB基因表达量存在互作影响(P<0.05),在高脂饲料中添加BAs,可以顯著降低ApoB基因的mRNA表达量(P<0.05);日粮油脂、BAs水平对肉鸡肝脏HMCGR基因的表达量无显著影响。
3讨论
油脂是饲料中能量来源的首选添加物,适当地增加日粮中的油脂水平,能够促进家禽生长,官丽辉等的研究指出,相比于其他日粮,高脂日粮中较高的能量水平能显著增加乌骨鸡的体质量,并且能够提高鸡肉的营养价值,但是其试验结果也表明,日粮中能量与肝脏指数成正比[15-16],这与本试验结果一致。此外,本研究还发现,高脂日粮会使肉鸡产生较高的腹脂率,过度的脂肪沉积会导致胴体品质下降,不利于肉鸡的经济效益。腹脂是肉鸡的储脂库,若其沉积过多,在一定程度上能够反映机体脂代谢出现异常。Fouad等的研究也证实,
高脂饲粮会促进肉鸡的腹脂沉积[17]。而肝脏是家禽最重要的脂代谢器官,暗示较高的腹脂率可能与异常的肝脏指数有一定的联系。Zaman等的试验结果也表明,高脂日粮会导致肝脏内较高的TG水平[18],这似乎也解释了高脂组较高的肝脏指数,与本试验结果一致。肝脏内脂质积聚是影响非乙醇性脂肪肝形成的1个重要因素,还可能会继续发展成肝炎、肝硬化甚至是肝癌等一系列肝病[19];转氨酶活性同样是反映肝脏损失的重要指标,当较多肝脏细胞出现变性、损伤等情况时,肝脏中大量的ALT、AST就会被释放进入血液中[20]。本试验结果显示,高脂组肉鸡血清中的ALT、AST活性显著升高,这些在一定程度上证实了高脂日粮会对肉鸡的肝脏造成相应的损伤,导致肉鸡机体代谢紊乱,不利于肉鸡的健康,同时会给养殖业带来巨大损失。乳化剂作为饲料添加剂来促进饲粮中脂质营养素的吸收,已经有较多的报道,Lai等的研究结果均证实,在日粮中添加BAs,能够显著降低肉鸡的腹脂率,促进饲料养分的吸收等[9,21]。本试验结果也表明,在日粮中添加BAs,可以降低肉鸡的腹脂率,并且显著减少高脂日粮造成的肝脏TG过度积聚以及血清ALT活性的升高,这也进一步提示,BAs对肉鸡有积极的保肝作用。
FAS、ACC是脂肪酸合成过程中的关键酶,而HSL是脂肪酸分解过程中的限速酶,因此,FAS、ACC、HSL活性是影响肉鸡肝脏脂代谢及体脂沉积的关键因素之一[22-24]。本试验结果显示,高脂日粮显著增加了肝脏的FAS活性,并降低了HSL活性。以往的研究也证实,高脂饮食会造成动物机体肝脏FAS活性升高,此外,HSL活性的降低也与高脂饮食有直接关系[25-26]。在本试验中,添加BAs后,肉鸡肝脏的FAS活性显著下降,而HSL活性显著上升,显然,高脂日粮是通过增加脂肪酸合成酶活性并抑制其分解酶的活性从而导致肉鸡出现肝脏脂代谢紊乱、腹脂沉积过多等问题,而添加BAs后,这种异常得到缓解也是通过调节脂代谢酶活性来完成的。Piekarski等的研究结果也显示,BAs日粮可以显著降低肉鸡肝脏包括FAS在内的生脂基因的表达量,并促进分解脂肪酸有关酶基因的表达[8],这与BAs作为信号分子通过信号途径参与机体物质能量代谢是分不开的。众多研究结果表明,BAs能够激活FXR,而FXR可以抑制FAS、ACC等有关脂肪酸合成酶基因的表达,从而抑制相关酶的活性[27-28]。这可能与BAs组肉鸡较低的肝脏指数联系在一起,BAs下调肝脏生脂酶活性并上调降脂酶活性,抑制肝脏脂肪酸的过度合成,也避免了肝脏脂质的异常积聚,这似乎能进一步证实BAs对于防治肉鸡肝病以及肝脏脂代谢的积极作用。
为了进一步探究BAs对高脂日粮介导的肉鸡肝脏脂代谢的影响,本试验还测定了相关基因的表达量。LPL是催化TG水解过程的1种限速酶,因此,肝脏LPL活性的降低可能会导致脂质在肝内的过度积聚[29],这与本试验的结果一致。高脂日粮组肉鸡肝脏的LPL表达量显著降低,而BAs可以增加其表达量,促进肝脏TG的水解,表明BAs可以通过增加脂质的分解从而减少脂质在肝内的蓄积。Ouyang等的试验还表明,肉鸡肝脏中LPL基因表达量的上调与腹脂率的降低存在一定的关系[30],而这种相关性仍需要进一步研究。ApoB作为与机体脂代谢密切相关的载脂蛋白 是合成极低密度脂蛋白的主要蛋白,作用是将肝内TG、T-CHO运送至外周组织,而L-FABP是参与将脂肪酸转运至线粒体进行β-氧化的关键蛋白[31-32]。本试验结果显示,高脂日粮导致ApoB、L-FABP 基因表达量增多,这可能是机体自身的一种适应,当机体摄取的脂质营养过多时,肝脏自身可能会有一些反馈,比如增加相应转运蛋白的表达量将脂质转运至肝外分解等。冯爱娟等的研究也指出,高脂饮食会增加老鼠体内L-FABP基因的表达量,这是自身反馈,同时也是脂代谢紊乱或者发生脂肪肝的一种信号[33]。本试验结果显示,添加BAs能够显著降低肉鸡肝脏ApoB、L-FABP基因表达量,这可能揭示了BAs组较低的腹脂率是由于BAs可以抑制类似ApoB、L-FABP 等基因的表达,从而避免过多的内源性脂质转运到外周组织造成体脂的过度沉积。同样地,国内外相关报道也指出,下调ApoB、L-FABP基因表达量可能是治疗脂肪肝过程中的潜在机制[34-35]。这也进一步暗示,BAs不仅可以通过促进脂肪酸分解来减少肝脏脂质的蓄积,并且可以在一定程度上抑制脂质转运,从而减少腹脂及其他体脂的沉积,而关于BAs对肉鸡肝脏损伤及脂代谢方面的具体作用机制,仍然需要更加深入的研究。
综合本试验研究结果得出,高脂日粮会导致肉鸡腹脂率、肝脏TG含量增加,并对肝脏脂质代谢功能造成不利的影响;而BAs可以通过抑制脂肪酸的合成及转运,并促进脂肪酸分解、降低肉鸡腹脂率及肝脏的TG水平,缓解肝脏损伤并维持其脂代谢的稳定,因此,BAs在动物健康以及畜禽生产上的应用价值值得期待。
参考文献:
[1]Abudabos A M. Effect of fat source,energy level and enzyme supplementation and their interactions on broiler performance[J]. South African Journal of Animal Science,2014,44(3):280-287.
[2]Fascina V B,Carrijo A S,Souza K,et al. Soybean oil and beef tallow in starter broiler diets[J]. Brazilian Journal of Poultry Science,2009,11(4):249-256.
[3]Ravindran V,Tancharoenrat P,Zaefarian F,et al. Fats in poultry nutrition:digestive physiology and factors influencing their utilisation[J]. Anim Feed Sci Technol,2016,213:1-21.
[4]Lilburn M S,Loeffler S. Early intestinal growth and development in poultry[J]. Poultry Science,2015,94(7):1569-1576.
[5]Xie M,Zhao J N,Hou S S,et al. The apparent metabolizable energy requirement of White Pekin ducklings from hatch to 3 weeks of age[J]. Animal Feed Science and Technology,2010,157(1/2):95-98.
[6]劉振. 饲粮类型对鸡脂肪肝形成的影响及表观调控机制[D]. 北京:中国农业科学院,2016.
[7]Russell D W. Fifty years of advances in bile acid synthesis and metabolism[J]. Journal of Lipid Research,2009,50(11):S120-S125.
[8]Piekarski A,Decuypere E,Buyse J,et al. Chenodeoxycholic acid reduces feed intake and modulates the expression of hypothalamic neuropeptides and hepatic lipogenic genes in broiler chickens[J]. General and Comparative Endocrinology,2016,229(4):74-83.
[9]Lai W Q,Huang W G,Dong B,et al. Effects of dietary supplemental bile acids on performance,carcass characteristics,serum lipid metabolites and intestinal enzyme activities of broiler chickens[J]. Poultry Science,2018,97(1):196-202.
[10]Watanabe M,Houten S M,Mataki C,et al. Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation[J]. Nature,2006,439(775):484-489.
[11]Lefebvre P,Cariou B,Lien F,et al. Role of bile acids and bile acid receptors in metabolic regulation[J]. Physiological Reviews,2009,89(1):147-191.
[12]Fuchs M. Non-alcoholic fatty liver disease:the bile acid-activated farnesoid X receptor as an emerging treatment target[J]. Journal of Lipids,2012(10):1-8.
[13]Li Y,Jadhav K,Zhang Y. Bile acid receptors in non-alcoholic fatty liver disease[J]. Biochemical Pharmacology,2013,86(11):1517-1524.
[14]鄧阳,张毕奎,樊新荣,等. 基于胆汁酸代谢网络分析异甘草素通过氧化/化学应激防御通路Nrf2/ARE的保肝作用[J]. 中国药学杂志,2015,50(21):1905-1911.
[15]官丽辉,刘海斌,张立永,等. 日粮不同能量水平对育成鸡营养物质代谢及肌肉品质的影响[J]. 中国兽医学报,2014,34(3):511-516.
[16]官丽辉,刘海斌,张立永,等. 日粮不同能量水平对育成鸡体增质量、血液生化指标及内脏器官发育的影响[J]. 中国兽医学报,2014,34(2):350-356.
[17]Fouad A M,El-Senousey H K. Nutritional factors affecting abdominal fat deposition in poultry:a review[J]. Asian-Australasian Journal of Animal Sciences,2014,27(7):1057-1068.
[18]Zaman Q U,Mushtaq T,Nawaz H,et al. Effect of varying dietary energy and protein on broiler performance in hot climate[J]. Animal Feed Science and Technology,2008,146(3/4):302-312.
[19]Lai Y S,Lee W C,Lin Y E,et al. Ginger essential oil ameliorates hepatic injury and lipid accumulation in high fat diet-induced nonalcoholic fatty liver disease[J]. Journal of Agricultural and Food Chemistry,2016,64(10):2062-2071.
[20]Rangboo V,Noroozi M,Zavoshy R,et al. The effect of artichoke leaf extract on alanine aminotransferase and aspartate aminotransferase in the patients with nonalcoholic steatohepatitis[J]. International Journal of Hepatology,2016(3):1-6.
[21]Maisonnier S,Gomez J,Brée A,et al. Effects of microflora status,dietary bile salts and guar gum on lipid digestibility,intestinal bile salts,and histomorphology in broiler chickens[J]. Poult Sci,2003,82(5):805-814.
[22]李洁琼,郑世学,喻子牛,等. 乙酰辅酶A羧化酶:脂肪酸代谢的关键酶及其基因克隆研究进展[J]. 应用与环境生物学报,2011,17(5):753-758.
[23]罗建学,李春风,初晓辉,等. 脂肪酸合成酶基因的研究进展[J]. 中国畜牧兽医,2011,38(6):118-123.
[24]罗建学,兰玉倩,杨桂秀,等. 激素敏感脂酶基因研究进展[J]. 生物技术世界,2015(3):189-190.
[25]Ramgopal M,Kruthika B S,Surekha D A. Terminalia paniculata bark extract attenuates non-alcoholic fatty liver via down regulation of fatty acid synthase in high fat diet-fed obese rats[J]. Lipids in Health and Disease,2014,13(1):1-7.
[26]Ma W,Zhao D,Su C,et al. Gene expression of hormone sensitive lipase and lipoprotein lipase in obesity-prone and obesity-resistant rats induced by high-fat diet[J]. J Hyg Res,2007,36(3):320-322.
[27]Noel O F,Still C D,Argyropoulos G,et al. Bile acids,FXR,and metabolic effects of bariatric surgery[J]. Journal of Obesity,2016(3):1-7.
[28]Schonewille M,de Boer J F,Groen A K. Bile salts in control of lipid metabolism[J]. Current Opinion in Lipidology,2016,27(3):295-301.
[29]Strauss J G,Frank S,Kratky D,et al. Adenovirus-mediated rescue of lipoprotein lipase-deficient mice. Lipolysis of triglyceride-rich lipoproteins is essential for high density lipoprotein maturation in mice[J]. Journal of Biological Chemistry,2001,276(39):36083-36090.
[30]Ouyang K,Xu M S,Jiang Y,et al. Effects of alfalfa flavonoids on broiler performance,meat quality,and gene expression[J]. Canadian Journal of Animal Science,2016,96(3):332-341.
[31]聞治国,侯水生,谢明,等. 肝脏极低密度脂蛋白合成和分泌的研究进展[J]. 动物营养学报,2011,23(11):1854-1861.
[32]Ong K T,Mashek M T,Davidson N O,et al. Hepatic ATGL mediates PPAR-α signaling and fatty acid channeling through an L-FABP independent mechanism[J]. J Lipid Res,2014,55(5):808-815.
[33]冯爱娟,陈东风. 大鼠非酒精性脂肪肝中L-FABP的动态表达[J]. 世界华人消化杂志,2004,12(6):1373-1375.
[34]杨宗辉,魏征人,尹建元,等. 秦皮提取物对实验性脂肪肝的治疗作用及其机制[J]. 中国老年学杂志,2007,27(6):517-519.
[35]Chen A P,Tang Y C,Davis V,et al. Liver fatty acid binding protein (L-Fabp) modulates murine stellate cell activation and diet-induced nonalcoholic fatty liver disease[J]. Hepatology,2013,57(6):2202-2212.
