探析镁与乙酸溶液的反应机理
2019-01-03吴文中

摘要: 通过数字化实验获取镁分别与pH基本相同的乙酸溶液、盐酸反应中的pH和温度变化曲线,利用原电池模型研究镁与水溶液作用的动力学机理。认为主导镁与乙酸溶液释出H2的主因是乙酸分子能有效破壞氢氧化镁保护膜所致,设计比较钠和镁分别与纯醋酸作用等实验,提出镁与乙酸溶液反应的微观本质是镁与乙酸分子直接作用的结果,同时通过实验证实镁与氯化铵溶液反应主要是镁与铵根离子之间相互作用的事实。
关键词: 镁; 乙酸分子; 保护膜; 微观机理; 实验探究
文章编号: 1005-6629(2019)12-0070-06 中图分类号: G633.8 文献标识码: B
1 问题来源
金属镁与乙酸溶液反应,一般微观过程表征如下:
CH3COOH+H2OCH3COO-+H3O+
Mg-2e-Mg2+
2H++2e-2H, 2HH2↑
当反应体系中消耗H3O+后,乙酸的电离平衡向电离方向移动,溶液中H3O+浓度得以补充以保证金属镁与乙酸溶液持续反应释出H2。
为此进行[实验1]以期验证上述微观过程的正确性。
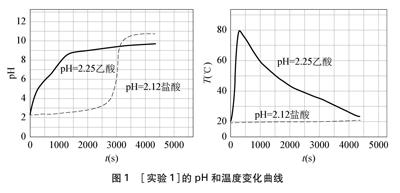
[实验1]把形状大小一样、质量为1.3g(过量)的镁条分别同时放入80mL pH=2.25的乙酸溶液和pH=2.12的盐酸中,使用数字化传感技术测定上述2个反应体系的pH和温度随反应时间变化曲线(如图1所示)。
图1 [实验1]的pH和温度变化曲线
开始阶段镁与乙酸反应剧烈,溶液温度显著升高,短时间内温度达80℃左右,镁与盐酸反应平缓,有少量气泡,溶液温度几乎不变;随着反应进行,在反应3000s前,盐酸体系中的pH始终小于乙酸溶液体系中的pH;3000s后盐酸体系中pH发生突跃(这是由于镁与盐酸反应结束,发生了Mg+2H2OMg(OH)2+H2↑,Mg(OH)2部分溶于水,使体系溶液pH显著增大所致)。对该实验现象,学者施志斌[1]在相关实验中也有相似的实验结果,但施志斌老师并未从微观视角解释其反应过程。
上述实验带来了如下疑问: 3000s前盐酸体
*2018年浙江省教研课题立项规划课题“基于学科理论认知模型的创新实验与疑难问题研究”研究成果(立项编号: G18191);江苏省教育科学“十三五”规划课题“化学教师对模型的认识与应用研究”的阶段性研究成果(项目编号: D/2018/02/09)。
系中pH始终小于乙酸溶液体系中pH,c(H3O+)比乙酸溶液体系中大得多,但镁与盐酸的反应速率却远小于镁与乙酸溶液的反应速率,原因是什么?当把这一问题提出来以后,课题组讨论热烈,有教师认为: 正因为镁与乙酸反应更快,短时间内溶液温度显著升高,反应速率随之加快,短时间内消耗的H3O+的量较大,因此pH出现显著升高的现象,而镁与pH几乎一样的盐酸反应速率小,消耗H3O+的量很少pH基本不变,只有当盐酸被消耗完后,发生了镁与水的反应,pH才显著升高,大家认为金属镁与乙酸溶液反应微观过程还是非常合理的。但上述观点的证据不足,至少未能从定量实验角度予以证实,为了厘清镁与乙酸溶液反应的微观过程,课题组成员查阅了镁与水溶液反应的机理,简述如下。
2 镁与水溶液作用微观过程的探析
金属与水溶液释出H2本质上是一种原电池的电化学反应过程,因此研究金属与水溶液的作用可以借助原电池模型来分析和探讨。
2.1 基于原电池模型的阴极行为
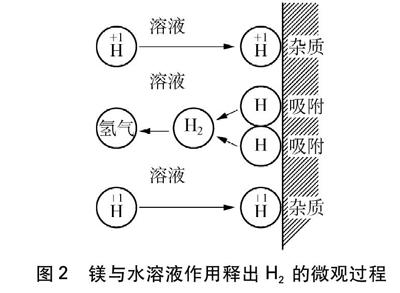
首先建立镁与水溶液中的正极行为(阴极行为)如图2所示[2]:
图2 镁与水溶液作用释出H2的微观过程
图2的意义: 盐酸的氢元素主要以H3O+、 H2O存在,从电性上看,H+更容易靠近正极而获得电子,而不带电的H2O就难以获得电子。由于H2O浓度远大于溶液中的H+,因此有理由相信——H2O也可以从正极得到电子。文献[3]认为钠分别与水、稀盐酸和稀NaOH溶液的反应速率并无显著差异,甚至出现钠与浓盐酸的反应速率反而小于钠与水的反应速率,这说明浓度不高的H+与浓度很高的H2O比较,其得电子速率无显著差异。醋酸溶液的氢主要以H3O+、 H2O、 CH3COOH等形式存在,同理可以推测浓度不高的H3O+与浓度很高的CH3COOH及H2O比较,其得电子速率并无显著差异,这样的情况下,决定镁与水溶液反应的反应速率并不在于阴极过程,而在于阳极行为。
2.2 基于原电池模型的阳极行为
周星等学者[4]认为Mg/H2O反应表现出明显的快速反应和慢速反应2阶段特征: ①在快速反应阶段: 镁粉与水的接触面积大,在反应速率一定的前提下,单位时间参与反应镁的质量大,反应程度快速增加;②在慢速反应阶段: 随着反应的进行,镁粉表面覆盖了一层Mg(OH)2,使镁粉与水的接触面积减小,阻碍了反应的进一步发生,反应速率减小,反应程度增加缓慢,直至反应停止。
综上,其阳极行为可用图3来表征:
图3 破坏镁表面保护膜的微观过程
图3意义: 金属镁在水中由于失去电子而转化为Mg2+并在金属表面快速形成Mg(OH)2保护膜,当Mg(OH)2保护膜达到一定厚度后,镁原子就会停止释放电子,导致上述化学过程停滞。溶液中若存在能破坏保护膜的粒子时,反应就可以持续发生。如在Mg/H2O反应体系加入盐酸,盐酸中的H3O+破坏Mg(OH)2保护膜,使镁不断溶解从而释出H2。
综上,镁与水溶液反应的快慢由两方面来决定: 一方面就是溶液中是否有活性氢以及这些+1价的氢得电子的难易程度;另一方面就是溶液中是否存在可以溶解Mg(OH)2保护膜的粒子以及破坏保护膜的难易程度。
显然pH相同的乙酸溶液和盐酸都存在容易得电子和破坏保护膜的H3O+,其中保护膜Mg(OH)2被H3O+破坏的化学过程如下:
Mg(OH)2(s)+2H+Mg2+(aq)+2H2O
其平衡常数K=Ksp[Mg(OH)2]/K2w
=1.8×10-11/10-28=1.8×1017
但是在乙酸溶液中,也存在乙酸分子中的活性氢且浓度比H3O+大得多,其中的羟基氢是否可以直接得到电子呢?经计算乙酸分子溶解Mg(OH)2的平衡常数同样很大:
Mg(OH)2(s)+2CH3COOH
Mg2+(aq)+2CH3COO-+2H2O, K=5.5×107
基于以上的思考发现: 只需研究H+浓度很低的纯乙酸能否溶解Mg(OH)2保护膜以及研究金属镁是否可以与纯乙酸发生反应释出H2即可,为此设计[实验2]。
[实验2]取50mL纯乙酸,放入1.56g未经打磨的镁条,发现开始阶段镁条表面有很少气泡(气体为H2),10多秒钟后,镁条表面的黑色的保护膜逐渐消失,产生的气泡快速增多以致镁条上浮到溶液表面,溶液温度显著升高;而把镁条换成除去保护膜的金属钠投入到纯乙酸中,发现钠表面有少量气泡,比较之前镁与纯乙酸反应慢得多。
乙酸分子不但能破坏镁表面的保护膜,而且也能得电子产生H2(显然是乙酸分子中羟基氢得电子);比较钠、镁分别与纯乙酸反应速率,前者反应速率反而小,这说明控制反应速率的关键不在于阴极过程,甚至与金属的活泼性关系不大,控制反应速率在于金属表面的金属离子进入溶剂的扩散速率有关(阳极行为)。
简单的实验似乎可以说明,乙酸溶液与镁作用时,乙酸分子直接参与了反应,乙酸分子不但参与了阳极过程(破坏保护膜),而且也参与了阴极过程(其中的羟基氢得电子转化为H2)。
3 比较镁与乙酸溶液、乙酸钠与乙酸混合溶液的化学过程
乙酸是一种弱酸,25℃下,0.1mol/L的乙酸溶液的电离度约为1%,也就是说,乙酸溶液主要的粒子并非是H3O+和CH3COO-离子,而是CH3COOH分子和水分子,通过[实验2]得知乙酸分子也可以与镁反应,因此若找到乙酸分子浓度几乎一样但pH有显著差异的两种溶液进行相关实验,就可以进一步说明乙酸溶液与镁反应主要是乙酸分子参与反应,而非主要是H3O+参与作用。
经过课题组充分讨论、研究,认为可以取两份相同浓度的乙酸溶液,其中一份加入一定量乙酸钠固体,然后分别加入镁条,测定溶液的pH变化和反应后溶液温度的变化是不错的选择,因为在乙酸溶液中加入乙酸钠固体后乙酸溶液的pH会增大,而乙酸分子浓度几乎不变,获得的混合溶液是一种缓冲溶液,为此设计[实验3]加以验证。
[实验3]用2.0mL纯乙酸和蒸馏水配制成70mL乙酸溶液注入一锥形瓶中;然后再用2.0mL纯乙酸和一定量的乙酸钠固体以及蒸馏水配制70mL溶液后,注入另一锥形瓶中,分别加入1.3g未经打磨的镁条,使用数字化传感技术测定上述2个反应体系的pH和温度随反应时间变化曲线(如图4所示)。
图4 [实验3]的pH和温度变化曲线
反应开始阶段乙酸溶液pH显著升高,而乙酸和乙酸钠混合溶液pH升高缓慢,这是因为乙酸和乙酸钠混合溶液是一种缓冲溶液所致;整个实验过程中2个反应体系溶液的温度变化几乎一致,显示2个反应体系的反应速率几乎一样。
为了进一步说明镁与乙酸溶液中的乙酸分子反应的事实,如改变乙酸分子浓度又将会怎样?为此在[实验3]的基础上,提高乙酸和乙酸钠混合溶液中乙酸的浓度,设计[实验4]用2.0mL纯乙酸和蒸馏水配制成80mL乙酸溶液后,注入一锥形瓶中;然后再用4.0mL純乙酸和一定量的乙酸钠固体以及蒸馏水配制80mL溶液后,注入另一锥形瓶中,分别加入1.3g未经打磨的镁条,使用数字化传感技术测定上述2个反应体系的pH和温度随反应时间变化曲线(如图5所示)。
图5 [实验4]的pH和温度变化曲线
观察分析实验数据: 浓度大1倍的乙酸和乙酸钠混合溶液与镁反应,溶液温度升高得更快更高,最高温度可达55℃左右,实验结果与本文得出的结论完全吻合——乙酸分子浓度越大,反应速率越大。
金属镁与乙酸溶液反应的微观过程,从上述系列实验上看的确是镁与乙酸分子之间作用的结果,那么,其他金属是否也一样?为此,用金属锌(粗锌)代替镁条重复上述实验,发现有类似的实验现象,只是由于反应速率相对金属镁而言比较小,反应后pH和温度变化不很显著。
4 实验验证镁与氯化铵溶液、盐酸反应微观过程
学者陈晨,马宏佳[5]提出: 镁与NH4Cl溶液反应首先是镁与溶液中的H3O+反应,随后与水反应,他们还指出,镁与NH4Cl溶液反应最后的沉淀并不溶于NH4Cl(取适量反应结束后的悬浊液于试管,加入NH4Cl固体,沉淀不溶解),说明“镁与NH4Cl溶液反应快是因为生成的Mg(OH)2溶解于NH4Cl溶液”的说法并不可靠。
但以上观点并不确切,后续实验表明,镁与NH4Cl溶液反应得到的沉淀物可以被浓度较高的NH4Cl溶液溶解,NH4Cl溶液溶解Mg(OH)2时会逸出氨气,由于氨气在常温下逸出较慢,需要更长时间消耗一定量的Mg(OH)2,因此短时间实验发现沉淀无法溶解而误以为NH4Cl溶液不能溶解Mg(OH)2。事实上镁与NH4Cl溶液反应开始阶段并无白色沉淀生成,而是在反应后阶段在溶液水解时逐渐形成,NH +4溶解Mg(OH)2保护膜的化学过程表征如下:
Mg(OH)2(s)+2NH +4
Mg2+(aq)+2NH3·H2O, K=0.06
上述化学过程,平衡常数只有0.06,但溶液中NH +4浓度较大,达到平衡后溶液中的Mg2+浓度并不小,若体系中c(NH +4)=1mol/L,计算Mg2+浓度可达0.4mol/L左右,同时由于在反应过程中不断有氨气逸出,NH +4可以使Mg(OH)2的沉淀平衡不断正向移动而溶解。在镁/NH4Cl溶液体系中,镁表面保护膜溶解、Mg(OH)2沉淀形成以及氨气逸出可以符号表征如下:
破坏保护膜——Mg(OH)2(s)+2NH +4Mg2+(aq)+2NH3·H2O
氨气的逸出——NH3·H2ONH3↑+H2O
形成Mg(OH)2或碱式氯化镁[Mg(OH)Cl]。
为了进一步说明镁与NH4Cl溶液中NH +4的反应的事实,设计了[实验5]。
[实验5]在2只盛有70mL蒸馏水的锥形瓶中分别加入一定量的NH4Cl固体和1mol/L的盐酸(溶液体积变化完全可忽略),采用pH和温度传感器分别测得NH4Cl溶液的pH为5.56,盐酸的pH为1.65,NH4Cl溶液的温度为16.5℃(NH4Cl固体溶于水吸热所致),盐酸溶液温度为19.3℃(室温)。随后同时加入过量的质量相同形状一样的未打磨的镁条于2只锥形瓶中,计算机软件及时记录pH和温度变化曲线如图6所示。
图6 [实验5]的pH和温度变化曲线
实验设计及现象说明:
(1) 实验之所以未配制pH相同的NH4Cl和盐酸溶液来完成实验,而是配制pH=1.65的盐酸,H3O+浓度远大于pH=6.56的NH4Cl溶液来完成实验,是为了说明——即便盐酸的H3O+浓度更大,但镁还是与pH更高的NH4Cl溶液反应更为剧烈,从而说明镁与NH4Cl溶液主要不是与H3O+反应,而是与溶液中的NH +4反应,当然,镁也同时与溶液中的H3O+反应,特别镁与NH4Cl溶液反应开始阶段,其pH升高显著。
(2) 实验开始时,NH4Cl溶液的温度更低,但反应开始一段时间后,体系溶液的温度更高,说明NH4Cl溶液与镁反应更快,其唯一的解释就是体系中浓度比H3O+浓度大得多的NH +4参与了反应,而不是与NH +4水解得到的H3O+反应。之所以控制NH4Cl溶液体系温度更低,是为了说明镁与温度更低的NH4Cl溶液反应也比镁与pH低得多的盐酸反应更快的事实。
(3) 在实验进行到6500s左右时,在镁和盐酸反应体系中加入更多的镁条,发现盐酸体系中pH显著升高,显示镁与盐酸完全反应后,与水发生作用得到Mg(OH)2,最后溶液的pH可达10.13,接近饱和Mg(OH)2溶液的pH。
(4) 由于上述两种溶液的氯离子浓度并不一样,未能严格控制实验变量,但之前的“空白实验”——鎂与氯化钾溶液的实验已然完成,实验结果显示镁与氯离子之间相互作用不影响上述实验结果。
从微观结构上看,NH +4与H3O+结构相似,两者都是中性分子与H+形成配位键得到的,其中H3O+的名称是水合氢离子,实际上,NH +4的名称完全可以是氨合氢离子,从电性角度上看两者也都带正电,容易靠近带负电的电子,从离子空间构型上看也是一样的,只是两者的氢元素的活性不同,当NH +4与H3O+浓度相同的时候,H3O+更容易与镁发生反应,H3O+破坏镁表面保护膜的程度也大,因此同浓度的盐酸和NH4Cl溶液与之反应,前者的反应速率也大得多;但同pH的盐酸和NH4Cl溶液与镁反应,后者反应速率大得多,因为此时NH +4浓度远大于H3O+浓度。在乙酸溶液中存在的CH3COOH +2也可以叫乙酸合氢离子,这可能也是镁与纯乙酸反应更剧烈的微观层面上的重要原因之一。
上述实验充分说明,镁与NH4Cl溶液反应主要是镁与NH +4的作用,之所以设计这一实验,是为了例佐证镁与乙酸溶液反应主要是与乙酸分子作用,而不是主要与H3O+反应,镁与水溶液作用不一定只与H3O+反应,也可以与乙酸分子、铵根离子或CH3COOH +2等直接发生反应。
5 结束语
综上,镁/乙酸溶液体系中,镁表面保护膜溶解、活性氢获得电子的过程可以用符号表征如下:
(1) 保护膜的破坏——Mg(OH)2(s)+2CH3COOHMg2+(aq)+2CH3COO-+2H2O或Mg(OH)2(s)+2H+Mg2+(aq)+2H2O。
(2) 活性氢获得电子——2CH3COOH+2e-2CH3COO-+H2↑或2H3O++2e-2H2O+H2↑。
镁与乙酸反应快慢,取决于乙酸分子和H3O+活性强弱和浓度大小,由于H3O+中的氢更活泼,因此当乙酸分子与H3O+浓度相当时,镁主要和H3O+直接作用;当c(CH3COOH)c(H3O+)时,破坏镁表面保护膜的就不仅仅是H3O+而主要是CH3COOH分子,得电子的粒子也不主要是H3O+而是CH3COOH分子。那种认为镁和乙酸溶液反应,促进乙酸的电离平衡CH3COOH+H2OCH3COO-+H3O+往电离方向移动的观点值得商榷,这是因为镁与一般浓度下的乙酸溶液反应时,反应体系中浓度减少的主要是乙酸分子,而非H3O+。
参考文献:
[1]施志斌. 探究pH相同的盐酸、醋酸与活泼金属的初始反应速率[J]. 化学教学, 2015, (3): 45~48.
[2]李永常. 试论氢超电势[J]. 天津化工, 2003, 17(2): 3.
[3]吴文中. 钠与酸溶液反应的差异性分析[J]. 中学化学教学参考, 2016, (C1): 5~8.
[4]周星, 张炜, 郭洋, 姜本正. 低温镁/水反应特征及反应动力学研究[J]. 固体火箭技术, 2011, (2): 71~74.
[5]陈晨, 马宏佳. 镁和氯化铵溶液反应的探究[J]. 化学教与学, 2017, (4): 87~89.
