泸型酒发酵酒醅中乳酸菌群落的来源、演替规律及功能预测
2019-01-03栗连会陆震鸣张晓娟王松涛沈才洪史劲松许正宏
栗连会 , 肖 辰 , 陆震鸣 , 张晓娟 ,王松涛, 沈才洪, 史劲松, 许正宏*,5
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;3.江南大学 药学院,江苏 无锡 214122;4.国家固态酿造工程技术研究中心,四川泸州646000;5.中国科学院 天津工业生物技术研究所,天津300308)
泸型酒是占中国白酒年产量70%以上的重要酒种[1],产品具有“窖香浓郁,绵软甘冽,香味谐调,尾净余长”的风味特征。泸型酒的生产采用大曲为糖化发酵剂,并通过固态发酵工艺产生丰富的白酒风味物质,包括酵母、霉菌、乳酸菌、芽孢杆菌、己酸菌、丁酸菌、硫酸盐还原菌和古菌在内的多种微生物类群[2-7]参与了风味物质的合成。
研究表明,乳酸菌在泸型酒酿造大曲、酒醅、窖泥等生产环境中广泛存在,是重要的微生物类群[8-9]。候小歌[10]等人从大曲中分离到乳杆菌属、链球菌属、片球菌属和微球菌属共4个属8种乳酸菌,刘丽萌[11]等人从酒醅中分离得到9种片球菌,其中包括酒窖片球菌和耐乙醇片球菌两个新种。张文学[12]等人通过 PCR-DGGE技术发现Lactobacillus acetotolerans在发酵一周后成为酒醅中的优势微生物,并保持至发酵结束。吴莉莉[13]等人对酱香型和清香型白酒发酵过程中乳酸菌菌群结构进行了比较,发现其菌群组成呈现出明显差异。然而,对于泸型酒酿造过程中酒醅乳酸菌的来源、演替规律及潜在功能目前尚缺少系统研究。
作者采用16S rRNA基因高通量测序技术,分析和比较了大曲、酒醅与窖泥中乳酸菌群落组成差异,以期明确酒醅中乳酸菌的主要来源;然后解析了乳酸菌群落在发酵酒醅中的演替规律,并利用PICRUSt(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)分析对乳酸菌在发酵过程中的潜在功能进行了预测,为深入探索乳酸菌在白酒酿造过程中的作用与影响提供研究基础。
1 材料与方法
1.1 样品
酒醅、窖泥、大曲样品:取自四川泸州老窖酿造基地的同一个生产窖池。其中酒醅样品为发酵过程中第 0、1、2、3、7、11、20、30、40 天所取。 每天取 3 个平行样充分混合,取样后迅速置于-80℃保藏。
1.2 试剂与仪器
PowerSoil DNA提取试剂盒:美国MO BIO公司;引物:由上海生工生物工程有限公司合成;Genome Sequencer FLX Titanium system:瑞士Roche公司;NanoDrop 3000:美国 Thermo Fisher Scientific公司;其它分析纯试剂:购自国药集团。
1.3 DNA提取
采用PowerSoil DNA提取试剂盒提取样品总DNA,然后用NanoDrop测定其浓度和纯度,保证每个样品的DNA量大于5 μg,纯度满足A260/A280值在1.8~2.0之间。
1.4 细菌16S rRNA基因扩增和高通量测序
高通量测序采用针对细菌16S rRNA基因V1-V3 高变区域(Escherichia colipositions 5-534)的通用引物 P1 (5’-NNNNNNN-TGGAGAGTTTGATCC TGGCTCAG-3’)和 P2(5’-NNNNNNN-TACCGCGG CTGCTGGCAC-3’)[14],在每对引物的 5’末端添加了18个不同的碱基序列以区分不同样品扩增得到的序列。PCR扩增采用GoTaq Hot Start Polymerase mix(Promega,USA),具体反应程序如下:95 ℃预变性 2 min;94℃变性 30 s,56℃退火 25 s,72℃延伸25 s,共25个循环;72℃延伸5 min。PCR产物经过纯化回收并定量后,使用GS-FLX Titanium系统进行测序,产生平均读长为400 bp的序列。
1.5 数据处理与分析
原始序列根据不同的引物标签划分样品,并去除以下不合格的序列[14]:长度小于150 bp;平均测序质量的分数小于35分;含有不明确的碱基对;含有8个以上单聚体或者不含引物的序列,同时采用UCHIME去除嵌合体[15],得到有效的序列文件。
采 用 UCLUST 软 件 (http://www.drive5.com/uclust/)对所有序列的可操作单元(operational taxonomic unit,OTU)划分,阈值设定为97%。利用Mothur软件的classify.seqs命令,设定阈值为80%[16],采用Greengenes数据库得到OTU的分类学信息。
1.6 PICRUSt功能预测
参考 KEGG数据库,采用 PICRUSt(http://picrust.github.com/)工具对导入的OTU分类信息文件进行在线功能预测。
2 结果与分析
2.1 泸型酒发酵过程中乳酸菌相对丰度变化趋势
如图1所示,在泸型酒发酵过程中,乳酸菌在总细菌中所占的相对丰度呈现先急剧下降、然后逐渐上升的趋势。在发酵的第0天(即入窖当天),乳酸菌的相对丰度大于50%(51.7%),是酒醅中最主要的微生物类群。封窖1 d后乳酸菌的相对丰度急剧下降至11.2%,说明大量乳酸菌不能适应急剧改变的酒醅环境而消亡。在发酵过程的1~7 d,酒醅中的乳酸菌快速繁殖,其相对丰度急剧上升;发酵7 d之后乳酸菌的相对丰度呈现缓慢上升,在发酵结束时达到78.8%,为发酵酒醅中的优势微生物。
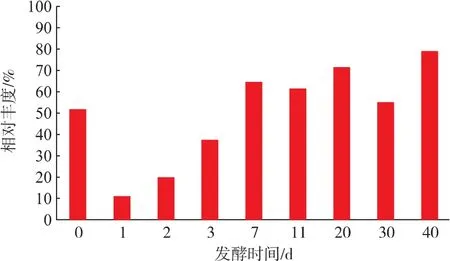
图1 泸型酒发酵过程中乳酸菌相对丰度变化Fig.1 Changes of relative abundance of LAB during the fermentation process of Luzhou-flavor liquor
2.2 大曲、酒醅和窖泥中乳酸菌群落结构比较分析
白酒生产过程中大量的乳酸菌可能来源于生产过程的各个环节,并进入酒醅参与发酵。其中,大曲和泥窖分别作为发酵剂和酿造容器,在窖池内与酒醅直接接触并发生微生物、物质和能量的交换,可能为酒醅提供丰富的微生物来源。因此,我们通过对成熟大曲、酒醅和窖泥的乳酸菌群落中乳酸菌群落结构的比较分析,讨论酒醅中不同乳酸菌的可能来源。
高通量测序结果显示在大曲、酒醅和窖泥中分别检测到19、49和3种乳酸菌,见图2。通过比较分析,我们发现有16种乳酸菌在大曲和酒醅中同时存在,其中有8种为酒醅中优势乳酸菌(相对丰度>0.1% ), 分 别 是Lactobacillus brevis,Lactobacillus crustorum,Lactobacillus curvatus,Lactobacillus pentosus,Lactococcuslactis,Leuconostoccitreum,Weissella confusa和Weissella cibaria。同时,窖泥中的3种乳酸菌均在酒醅中检测到,其中Lactobacillus acetotolerans在酒醅中是优势乳酸菌。酒醅中另有30种乳酸菌未能在大曲和窖泥中检测到,可能来源于空气等酿造环境,有待进一步研究。

图2 大曲、酒醅与窖泥中的乳酸菌群落比较分析Fig.2 Comparison of LAB community among Daqu,fermented grains and pit mud
2.3 发酵过程酒醅中乳酸菌群落演替
如图3所示,乳酸菌群落结构在发酵的第一周变化明显,之后趋于稳定。在入窖当天(第0天),Weissella confusa是优势乳酸菌,在乳酸菌群落中相对丰度达到88.0%,但在发酵开始之后其丰度急剧下降,直至在发酵结束时检测不到。Lactobacillus fermentum在第0天时其丰度大于1%,随后逐渐下降至无法检测。与此相反,Lactobacillus acetotolerans的相对丰度在入窖时小于1%,之后开始迅速繁殖,并在发酵2 d后成为酒醅中的优势乳酸菌 (相对丰度>98%)。另有8种乳酸菌的相对丰度在发酵的第1天达到最大值,其分别为Lactobacillus brevis(2.7% ),Lactobacilluscrustorum(14.7% ),Lactobacillus curvatus(2.7%),Lactobacillus pentosus(4.2% ),Lactococcus garvieae(7.1% ),Leuconostoc citreum(7.1%),Pediococcus pentosaceus(4.2%)和Weissella cibaria(7.6%);另有3种乳酸菌在发酵的第2天达到其最大丰度,其分别为Lactobacillus acidipiscis(2.2% ),Lactobacillusparacollinoides(1.8%),Lactococcus lactis(2.2%)。 在泸型酒发酵过程中,这些乳酸菌物种不同的变化趋势可能与其来源、生长代谢与环境耐受能力的多样性相关。其中,封窖之后迅速形成的厌氧发酵环境可能是导致Weissella confusa快速消亡的原因;Lactobacillus acetotolerans可能由于其较强的耐酸、耐乙醇能力在发酵开始之后迅速成为优势乳酸菌[12]。

图3 泸型酒发酵过程中优势乳酸菌种水平演替规律Fig.3 Dynamics of abundant LAB species during the fermentation process of Luzhou flavor liquor
2.4 乳酸菌群落功能预测
乳酸菌作为酒醅中的优势微生物类群,解析其在发酵过程中的潜在功能对于解析白酒酿造机理具有重要的意义。作者重点分析了乳酸菌群落在15个碳水化合物代谢途径上的分布和演替规律。
如图4所示,乳酸菌在酒醅发酵过程中参与最多的是糖酵解途径,此外还涉及其它多种糖类的代谢,包括氨糖与核糖代谢、淀粉和蔗糖代谢、果糖和甘露糖代谢和半乳糖代谢,然而其很少参与抗坏血酸代谢,五碳支链酸代谢与磷酸肌醇代谢。同时,风味物质中与丙酸、丁酸代谢相关的基因在预测的总基因数中也占有一定比例。从演替规律上看,大部分代谢途径的预测基因数量呈现先下降后上升的趋势,这与乳酸菌在总细菌中的相对丰度变化趋势基本一致,说明其代谢功能与其丰度变化密切相关。而五碳支链酸代谢途径预测基因数量则呈现出一直下降的趋势,直至完全没有。
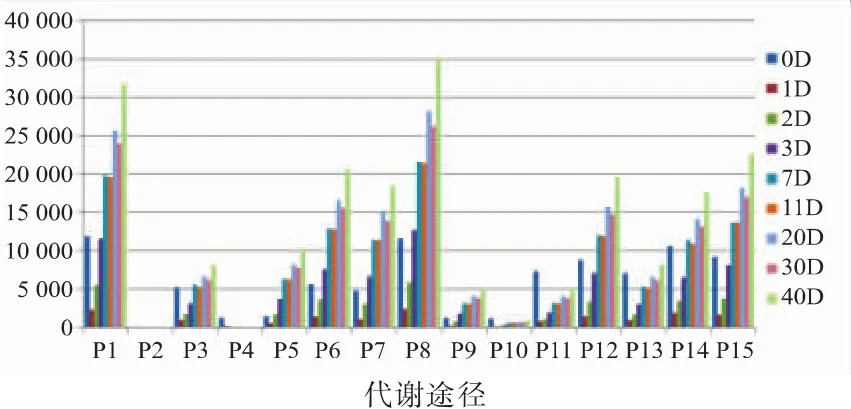
图4 乳酸菌群落在碳水化合物代谢途径的功能预测Fig.4 Functional prediction ofLAB communityincarbohydrate metabolism pathway
3 结 语
通过高通量测序技术发现乳酸菌在总细菌中的相对丰度随着发酵时间的推移逐渐上升,至发酵结束时成为优势微生物。这可能是由于窖池内厌氧、高浓度的有机酸和乙醇等特殊环境不适合大部分微生物的生存,而乳酸菌属于兼性厌氧菌,且具有能够耐受较低的pH等特性而使其成为优势微生物[17]。
通过比较泸型酒生产过程中的大曲、酒醅和窖泥的乳酸菌群落结构,我们发现酒醅中的部分优势乳酸菌可以在大曲和窖泥中检测到。大曲细菌群落以乳酸菌和芽孢杆菌为主体[18],其作为糖化发酵剂以10%~20%的比例加入酒醅发酵,可以直接带入大量乳酸菌。在之前的研究中,郑佳等人[19]发现Lactobacillus acetotolerans是窖泥中的优势细菌,且窖池微生物可以通过酒醅与窖泥的接触面相互迁移。因此,我们推断酒醅中的部分优势乳酸菌来源于大曲,而优势乳酸菌Lactobacillus acetotolerans来源于窖泥。此外,酒醅中的其它乳酸菌可能来源于原辅料、空气、水甚至操作人员等生产过程涉及的多种渠道。
通过对发酵酒醅中优势乳酸菌的演替规律分析,我们发现乳酸菌群落结构在发酵第一周剧烈变动,其物种多样性随着发酵时间的推移显著降低。在发酵初期,Weissella confusa占主导地位,然而其很快被Lactobacillus acetotolerans所取代并一直保持至发酵结束,这与张文学等人的研究结果基本一致[12]。
此外,作者还采用PRICUSt技术对酒醅中乳酸菌群落进行了碳水化合物代谢相关途径的功能预测,结果显示,乳酸菌参与多种糖类物质的代谢,其中最主要的是糖酵解途径,而在风味物质代谢中主要涉及丁酸、丙酸代谢。通过糖酵解途径葡萄糖被降解为丙酮酸,并在厌氧条件下被还原为乳酸和乙醇,而乳酸正是乳酸菌最主要的代谢产物,这也在一定程度上解释了乳酸菌更多的参与糖酵解途径的原因。同时,多种乳酸菌也可以通过磷酸戊糖途径进行异型乳酸发酵,但其乳酸合成效率仅为糖酵解途径的一半。丁酸和丙酸是泸型酒中的重要风味物质,被认为主要由梭状芽孢杆菌属、丙酸杆菌代谢产生[2]。本研究通过功能预测发现乳酸菌也有参与丁酸、丙酸代谢的潜力,而这些物质均是合成泸型酒主体风味物质己酸乙酯的前体物,其是否具有进一步合成己酸乙酯的能力还需要进一步验证。
综上所述,本研究通过比较泸型酒生产过程中大曲、酒醅和窖泥中的乳酸菌群落结构,初步了解了酒醅中部分乳酸菌的来源;同时解析了酒醅乳酸菌群落演替规律,并对乳酸菌群落功能进行了预测,为深入理解乳酸菌在泸型酒酿造中的作用提供了研究基础。
