纤维床反应器在琥珀酸放线杆菌菌种选育中的应用
2019-01-03陈鹏程
陈鹏程 , 苏 欣 , 郑 璞 *
(1.江南大学 工业微生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 生物工程学院,江苏 无锡214122)
琥珀酸是一些厌氧和兼性厌氧微生物代谢途径的代谢中间体。人们已经发现多种微生物可以发酵生产琥珀酸,但是只有少数菌种对琥珀酸产量及转化率较高。目前研究得较多的产琥珀酸的微生物有:Actinobacillus succinogenes(产琥珀酸放线杆菌)[1]、Anaerobiospirillum succiniciproducens(产琥珀酸厌氧螺菌)[1]、Mannheinia succiniciproducens(曼海姆产琥珀酸菌)[1-2]和基因工程Escherichia coli(大肠杆菌)[1,3-4]。此外,有些霉菌和乳酸菌也能产琥珀酸[5]。在种类繁多的产琥珀酸微生物中,从瘤胃中分离的Actinobacillus succinogenes在厌氧环境中可以利用果糖、葡萄糖、麦芽糖、蔗糖等广泛的碳源进行发酵,且具有产酸能力强的特点,因而受到广泛关注[6-8]。由于琥珀酸广泛的应用范围使得市场对其一直有较大的需求量,而生物发酵法生产污染小且符合绿色生产的理念,因此,有效利用微生物生产琥珀酸具有重要研究意义。
作者所在实验室前期筛选得到一株高产琥珀酸的菌株Actinobacillus succinogenesF3-ZK,最高产酸量为95.6 g/L,糖酸转化率为71%。但因前期培养菌体花费高且菌体无法回收利用,并且和大多数有机酸发酵过程一样,琥珀酸的积累会对菌体的生物活性和代谢途径产生抑制作用,从而影响菌株生长性能和产酸过程,降低发酵法生产的经济效益。作者所在实验室前期采用游离菌体对琥珀酸放线杆菌进行适应性进化,由于菌体生长速度慢,培养基中菌浓不高,适应性进化过程极易染菌。研究发现,纤维床的运用能够提高琥珀酸的生产效率,且具有良好的运行稳定性,进一步观察到菌体在纤维表面形成生物膜,推测生物膜的菌体富集作用提高了菌体的耐受性[9]。为了提高Actinobacillus succinogenes富集量,降低适应性进化过程中的染菌可能性,作者首次使用黏胶微米纤维膜进行Actinobacillus succinogenes的吸附固定,借助其比表面积大的优势提高菌体负载率,并筛选合适种类的载体材料构建纤维床反应器,通过适应性进化策略提高Actinobacillus succinogenes对产物琥珀酸钠的耐受性
1 材料与方法
1.1 材料
1.1.1 菌种与纤维膜载体 琥珀酸放线杆菌Actinobacillus succinogenesF3-ZK:作者所在实验室自主筛选诱变得到,保藏于中国典型培养物保藏中心(CCTCCNO:M2012036);黏胶纤维膜载体:浙江省纺织测试研究院提供。
1.1.2 培养基 一级种子液培养基(g/L):胰蛋白胨大豆肉汤培养基 (TSB)32.3,酵母膏5;115℃、20 min高压蒸汽灭菌。
二级种子液培养基(g/L):酵母膏10,无水葡萄糖 10,NaH2PO4·2H2O 10,K2HPO4·3H2O 20;115 ℃、20 min高压蒸汽灭菌。
发酵培养基(g/L):玉米浆 25,无水葡萄 50,蛋氨 酸 0.1,NaH2PO4·2H2O 2.5,K2HPO4·3H2O 2.5,MgCl2·6H2O 0.2,CaCl20.2, 一水谷氨酸钠 1,Na2S 0.1,糖蜜5;用3 mol/L的NaOH溶液调pH至6.0~6.5,121℃、20 min高压蒸汽灭菌。
TSB 平板(g/L):TSB 32.3,酵母膏 5,琼脂粉 16;115℃、20 min高压蒸汽灭菌。
紫外诱变筛选平板(g/L):TSB 32.3,酵母膏 5,琼脂粉16,丁二酸钠 60~80;115℃、20 min高压蒸汽灭菌。
1.1.3 试剂 TSB:购自宜兴永信生物有限公司;酵母膏:购自安琪酵母股份有限公司;其他试剂:购自国药集团药业股份有限公司。
1.2 方法
1.2.1 菌种培养方法 一级种子培养:从-40℃的冰箱中取出保有Actinobacillus succinogenes的甘油管,以4%的接种体积分数接入装有25 mL一级种子培养基的100 mL三角烧瓶中 ,用1 mol/L的NaHCO3溶液(用孔径为0.22 μm的薄膜过滤除菌)调节pH至6.0~6.5,在37℃、充满CO2气体的条件下静置培养12 h。
二级种子培养:将一级种子液种子以4%的接种体积分数接入装有25 mL二级种子培养基的100 mL三角烧瓶中,用1 mol/L的NaHCO3调节pH至6.0~6.5,在37℃、充满CO2气体的条件下静置培养6 h。
1.2.2 载体用量的确定 将黏胶纤维膜剪成表面积与培养液体积比分别为 0.5∶1、1∶1、1.5∶1、2.0∶1、2.5∶1(cm2∶cm3) 大小,灭菌后用放入已培养 5.5 h 的二级种子培养液中吸附0.5 h。随后取出放入装有25 mL发酵培养液的100 mL三角烧瓶中,加入1 g MgCO3调节pH 至6.0~6.5,在37℃、充满 CO2气体的条件下发酵48 h。发酵结束后用可见光分光光度计在660 nm波长下测培养液OD值,并测量发酵液pH值;用HPLC法检测琥珀酸质量浓度和残糖质量浓度以验证载体吸附菌体发酵性能。
1.2.3 适应性进化条件的确定 配置丁二酸钠质量浓度分别为 0、20、40、50、60、65、70、80 g/L 的一级种子培养基,吸取甘油管中保存的活化菌种1 mL于装有25 mL一级种子培养液的100 mL三角烧瓶中,加入1 mol/L的NaHCO3溶液 (用孔径为0.22 μm的薄膜过滤除菌)调节pH至6.0~6.5,在37℃、充满CO2气体的条件下,静置培养12 h,培养结束后用可见光分光光度计在660 nm波长下测培养液OD值,并测量培养液pH值,确定菌种生长情况。确定适应性进化最适丁二酸钠质量浓度后再接入相应盐浓度的一级种子培养基中培养,培养12 h后每3小时测一次OD值,验证菌种生长稳定性。
1.2.4 耐盐性适应性进化 确定适应性进化最适宜的盐浓度后配置相应浓度的一级种子培养基。取1 mL甘油管中保存菌种接种到装有25 mL最适盐浓度的一级种子培养液的100 mL三角烧瓶中,加入1 mol/L的NaHCO3溶液(用孔径为0.22 μm的薄膜过滤除菌)调节pH至6.0~6.5,在37℃、充满CO2气体的条件下静置培养11.5 h后,用黏胶纤维膜吸附0.5 h,随后转接至下一个含盐的一级种子培养基中传代。传代指的是将固定有琥珀酸放线杆菌的载体转接至下一个含有琥珀酸钠的一级种子培养基中培养,传代培养时间固定为12 h,培养结束后再取出载体材料转接至下一培养基中继续传代。每次转接完成之后用可见光分光光度计在660 nm波长下测上一培养液OD值,测量培养液pH值,确定菌种生长情况。此后重复该操作连续传代,每组两个平行样。
1.2.5 紫外诱变方法 取1 mL甘油管中保存的菌种接种到装有25 mL一级种子培养液的100 mL三角烧瓶中,加入1 mol/L的NaHCO3溶液(用孔径为0.22 μm的薄膜过滤除菌)调节pH至6.0~6.5,在37℃、充满CO2气体的条件下静置培养6 h,此时菌株处于对数生长期。吸取对数期菌液5 mL于直径9 cm培养皿中,放入搅拌子,用15 W、波长为254 nm的紫外灯在距离培养皿 30 cm处照射20 s[32]之后再接入装有25 mL一级种子培养液100 mL三角烧瓶中,加入1 mol/L的NaHCO3溶液 (用孔径为0.22 μm的薄膜过滤除菌)调节pH至6.0~6.5,在37℃、充满CO2气体的条件下静置后培养12 h,此过程注意避光操作。
吸取0.5 mL后培养液于装有4.5 mL生理盐水的 10 mL EP 管中, 再依次稀释到 10-5、10-6、10-7,取100 μL涂布于筛选平板上,在37℃、充满CO2气体的条件下静置培养3~5 d。
1.2.6 菌株发酵性能验证 摇瓶发酵:取1 mL甘油管中保存的菌种培养至二级种子,再取二级种子液种子以4%的接种体积分数接入装有25 mL发酵培养液的100 mL三角烧瓶中,加入1 g MgCO3调节pH至6.0~6.5,在37℃、充满CO2气体的条件下,静置培养48 h。发酵结束后用可见光分光光度计在660 nm波长下测培养液OD值,并测量发酵液pH值;用HPLC法检测琥珀酸质量浓度和残糖质量浓度以验证菌种发酵性能。
发酵罐发酵:取甘油管中保存的菌种培养至二级种子,再将二级种子液种子以4%的接种体积分数接入装有1.5 L初糖质量浓度为50 g/L发酵培养基的3 L发酵罐中,37℃、搅拌转速120 r/min、用1 mol/L的NaHCO3溶液控制pH值在6.0~6.5发酵。发酵过程中每隔3~4小时取样测定葡萄糖、OD660值,当葡萄糖质量浓度低于10 g/L时一次性加入高质量浓度的葡萄糖使得发酵液中葡萄糖质量浓度达到30 g/L左右,待残糖质量浓度再一次降低为10 g/L以下时,从菌体生长情况及产酸情况考虑是否继续采取补料操作。发酵结束后,将发酵液排出,清洗发酵罐。
1.2.7 测试方法 培养液中游离菌体量以OD660值表示,具体是吸取1 mL菌液于比色管中,加入适量浓盐酸溶解其中碳酸镁等不溶物,以去离子水稀释适当倍数后用可见光分光光度计在660 nm波长下测量发酵液OD值。菌体OD660值与菌体干重的兑换公式为:1 OD660=0.51 g/L菌体量。
用HPLC法测定发酵液中葡萄糖、琥珀酸、乳酸及乙酸的质量浓度。采用Waters高效液相色谱仪,色谱柱型号为Carbomix H-NP10,柱温55℃,Waters 2414示差折光检测器,检测温度35℃,流动相为 3.3 mmol/L H2SO4,流速 0.5 mL/min,进样量 10 μL,单个样品运行时间20 min。
2 结果与讨论
2.1 适应性进化载体用量确定
用不同用量的粘胶载体吸附二级种子进行发酵,结果见表1。可以看出,当载体表面积与发酵液体积比为 1.0∶1 cm2∶cm3和 1.5∶1 cm2∶cm3时, 琥珀酸产量和产率相差不大,考虑到节省载体用量以增强菌体富集的效果,确定载体用量为载体表面积与发酵液体积比为 1.0∶1 cm2∶cm3。
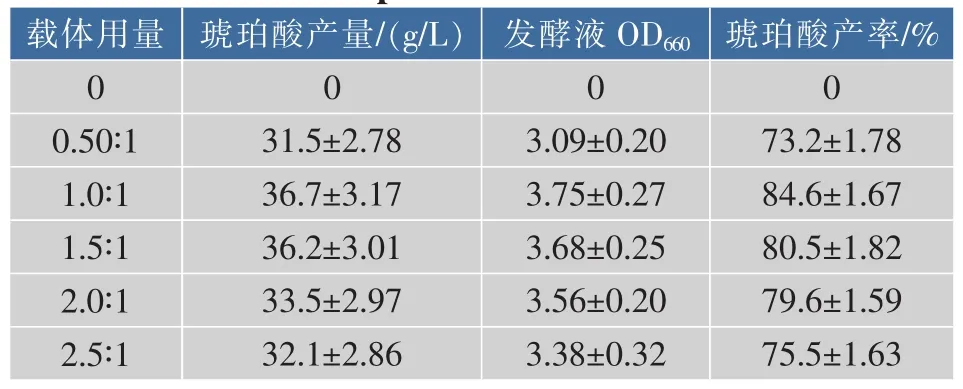
表1 不同载体用量(载体表面积与发酵液体积比,cm2∶cm3)对琥珀酸生产的影响Table 1 Effects of supports usage(ratio of support surface area to fermentation medium volume,cm2∶cm3)on succinic acid production
2.2 适应性进化初始盐质量浓度的选择
分别用含不同琥珀酸钠质量浓度的培养基培养Actinobacillus succinogenes,其生长情况见表2。当琥珀酸钠质量浓度升高到60 g/L时,菌株生长受到明显抑制,故考虑选择40 g/L或50 g/L作为菌株耐盐适应性的初始质量浓度。用分别含琥珀酸钠40、50 g/L的一级种子培养基培养Actinobacillus succinogenes,培养12 h之后每隔3小时测一次OD660值,验证菌株生长稳定性,结果见表3。可以看出,菌株在两个质量浓度下都能稳定生长,为了有效地提高菌株的耐盐性,故选择琥珀酸钠质量浓度50 g/L作为适应性进化的初始浓度。
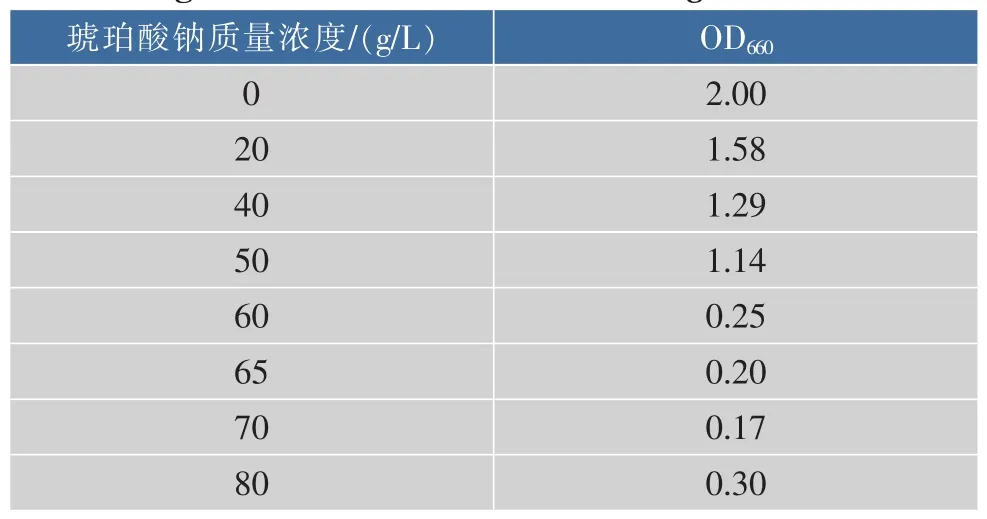
表2 不同琥珀酸钠质量浓度对菌株生长的影响Table 2 Effect of sodium succinate concentrations on the growth of Actinobacillus succinogenes
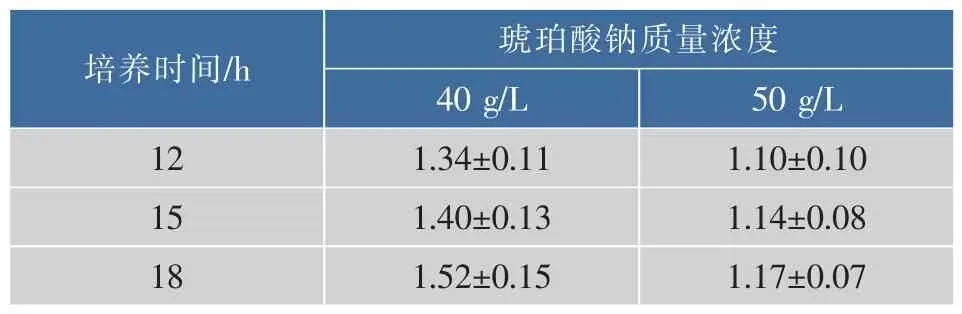
表3 高盐质量浓度下菌株生长稳定性验证Table 3 Growth stability of Actinobacillus succinogenes under a high salt concentration
2.3 菌株耐盐性适应性进化
2.3.1 第一轮和第二轮适应性进化 第一轮适应性进化在含琥珀酸钠质量浓度为50 g/L的一级种子培养基中进行了14代传代,菌株OD660值变化情况见图1(a)。可以看出,菌株在该盐质量浓度下进化过程中,由于高盐质量浓度的抑制作用,菌体生长量连续下降,到第14代时,菌体OD660值降到0.60左右,生长受到显著抑制,故结束第一轮适应性进化。取适应性进化的菌液在TSB平板上划线培养后,挑取长势良好的单菌落接种到装有不含盐的一级种子培养液中,连续培养几次复壮菌株并保藏于甘油管中备用。取复壮后菌株发酵,琥珀酸产量为(32.7±2.50)g/L,相比于初始菌株没有明显变化。
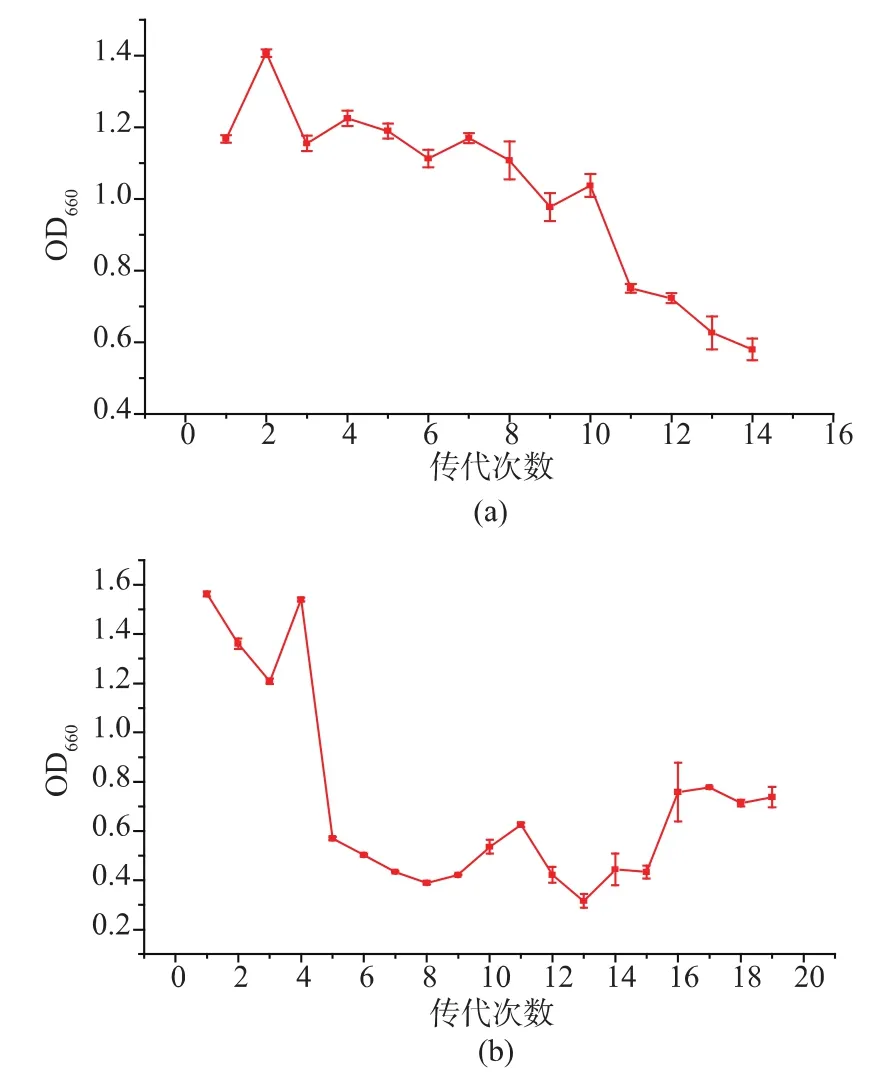
图1 第一轮和第二轮适应性进化(50 g/L琥珀酸钠)过程中菌液OD660值变化情况Fig.1 Changes of OD660during the first and second round of adaptive evolution(50 g/L of sodium succinate)
使用粘胶纤维固定第一轮适应性进化后保藏的菌株,转接入含琥珀酸钠质量浓度为50 g/L的一级种子培养基中开始进行第二轮适应性进化,共传代19代,菌株OD660值变化情况见图1(b)。可以看出,菌体生长量先降低,最后达到稳定并开始渐渐回升,这说明菌体的耐盐性可能有所提高。取适应性进化的菌液在TSB平板上划线,在37℃、充满CO2气体的条件下,静置培养24 h。从长好的平板上挑取长势良好的单菌落接种到不加盐的一级种子培养液中,连续培养几次复壮菌株并保藏于甘油管中备用。取复壮后菌株发酵,琥珀酸产量为33.2±3.35 g/L,相比于初始菌株琥珀酸产量提高了7.1%。2.3.2 紫外诱变 为了提高适应性进化效率,对第二轮适应性进化后菌株进行紫外诱变。分别取稀释合适倍数的后培养液涂布于含琥珀酸钠质量浓度为 60、70、80 g/L的TSB平板上,在 37℃、充满 CO2气体的条件下静置培养3~5 d。培养结束后,60 g/L的TSB平板上长出单菌落,而70 g/L和80 g/L的TSB平板上没有任何菌落长出,故选择含琥珀酸钠质量浓度为60 g/L的TSB平板作为筛选平板。菌株经紫外线照射20 s后的致死率为78.4%。因此,紫外照射时间确定为20 s。取诱变后菌株发酵验证,共筛选出7株正突变株,编号为UV-1、UV-11、UV-16、UV-25、UV-31、UV-33、UV-39, 其中琥珀酸产量最高的是UV-1,其产量为34.6±3.62 g/L。随后用UV-1作为第三轮适应性进化的出发菌株继续进行适应性进化。
2.3.3 第三轮、第四轮适应性进化 取诱变后菌株在含琥珀酸钠质量浓度为60 g/L的一级种子培养基中进行适应性进化,菌株OD660值变化情况见图2(a)。可以看出,菌株生长量先下降后回升再下降。分析原因可能是由于菌体富集生长形成生物膜,提高了菌体对环境刺激的耐受性,菌株生长量逐渐回升,但由于生物膜的保护作用有限故后又下降。取适应性进化的菌液在TSB平板上划线培养后,挑取长势良好的单菌落接种到装有不加盐的一级种子培养液中,连续培养几次,复壮菌株并保藏于甘油管中备用。取复壮后菌株发酵,琥珀酸产量为35.5±3.80 g/L,相比于初始菌株琥珀酸产量提高了14.5%。
使用粘胶纤维固定第三轮适应性进化后保藏的菌株,转接入含琥珀酸钠质量浓度为60 g/L的一级种子培养基中开始进行第四轮适应性进化,共传代19代,菌株OD660值变化情况见图2(b)。可以看出菌株生长量逐渐上升,比第三轮适应性进化菌株最终OD660值明显提升,说明菌株的耐盐性可能进一步提升。取适应性进化的菌液在TSB平板上划线培养后,挑取长势良好的单菌落接种到装有不加盐的一级种子培养液中,连续培养几次复壮菌株并保藏于甘油管中备用。发酵验证表明,复壮后的菌株发酵产琥珀酸(36.9±2.78)g/L,相比于初始菌株提高了19.0%。
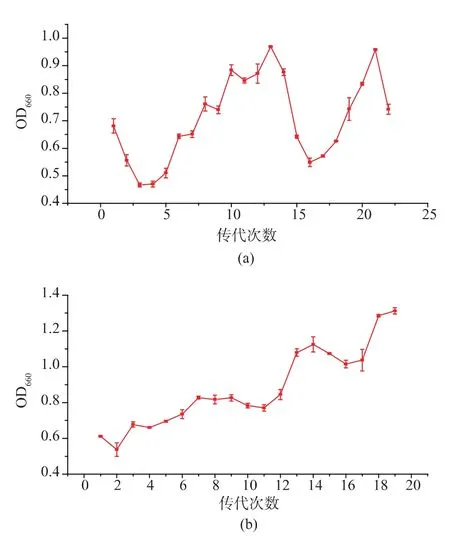
图2 第三轮和第四轮适应性进化(60 g/L琥珀酸钠)过程中菌株OD660值变化情况Fig.2 Changes of strain’s OD660 during the third and fourth round of adaptive evolution (60 g/L of sodium succinate)
2.3.4 第五轮适应性进化 使用粘胶纤维固定第四轮适应性进化后保藏的菌株,转接入含琥珀酸钠质量浓度为65 g/L的一级种子培养基中开始进行第三轮适应性进化,共传代15代,菌株OD660值变化情况见图3。可以看出,虽然菌体生长量较在含丁二酸钠60 g/L时低,但生长量总的趋势是呈上升状的,菌株的耐盐性得到进一步提高。取适应性进化的菌液在TSB平板上划线培养后,挑取长势良好的单菌落接种到装有不加盐的一级种子培养液中,连续培养几次复壮菌株并保藏于甘油管中备用。
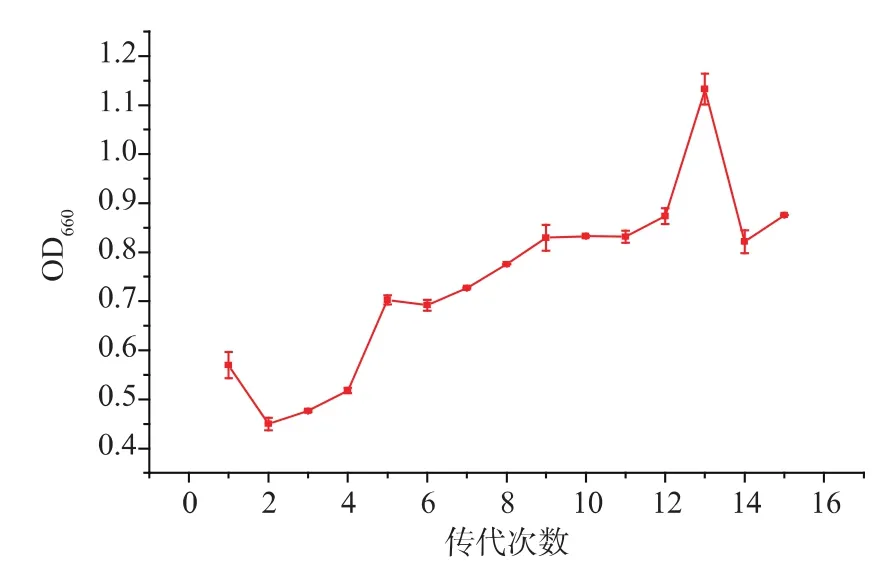
图3 第五轮适应性进化 (65 g/L琥珀酸钠)过程中菌株OD660值变化情况Fig.3 Changes of strain’s OD660during the fifth round of adaptive evolution(65 g/L of sodium succinate)
2.3.5 载体上附着菌体生长情况 为了证实生物膜的形成,选取第三轮适应性进化过程为研究对象,通过扫描电镜观察适应性进化过程中固定在纤维表面的Actinobacillus succinogenes,结果见图4。从图4(a)可知,本轮适应性进化刚开始时,菌体在载体上的覆盖量不大;随后菌体在载体上增殖并保持良好的短杆状形貌,且菌体易于附着于纤维交叉处,而微米纤维膜较大的比表面积以及良好的孔洞贯通性能赋予了菌体更多附着生长的位点;到适应性进化后期,载体表面覆盖一层致密的生物膜,Actinobacillus succinogenes实现大量富集。

图4 琥珀酸放线杆菌在载体表面形貌扫描电镜图Fig. 4 Scanning electron microscope images of Actinobacillus succinogenes during adaptive evolution
2.4 初始菌株与适应性进化菌株性能比较
2.4.1 生长情况 比较初始菌株与适应性进化菌株在不同条件下二级种子生长情况,结果见表4。可以看出,经过五轮的适应性进化之后,菌株的耐盐性能得到显著提高。初始菌株在60 g/L盐质量浓度下几乎不生长,而经过适应性进化后菌株在含盐培养基中生长量逐渐提高,第五轮适应性进化后菌液OD660值能生长到初始菌株不加盐生长时的1/3左右。
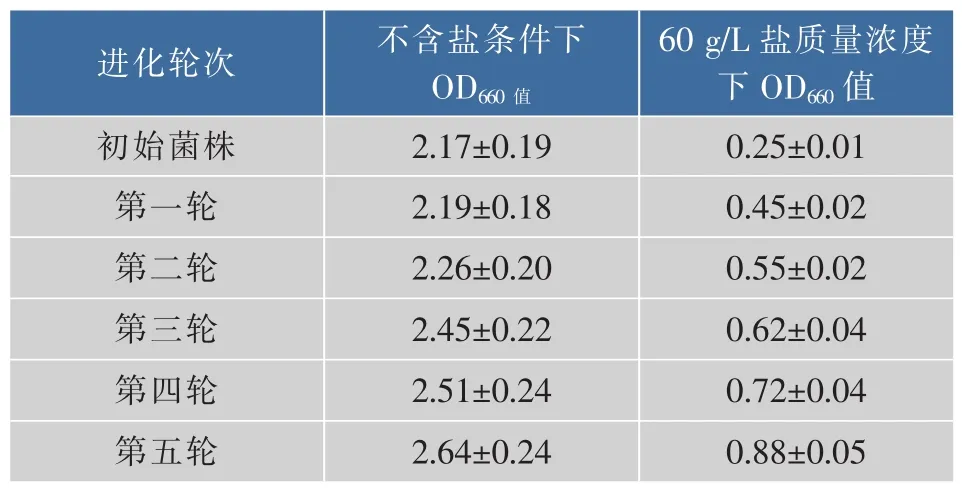
表4 初始菌株、适应性进化菌株不同条件下二级种生长情况Table 4 Secondary seed growth of the original and the evoluted strains under different conditions
2.4.2 摇瓶发酵 发酵结果见图5。可以看出,在同等发酵条件下,适应性进化菌株琥珀酸产量和转化率明显比初始菌株高,进化菌株发酵得到38.4±3.14 g/L的琥珀酸,相比初始菌株产量约提高了23.8%,且适应性进化菌株耐盐性得到了明显提高。
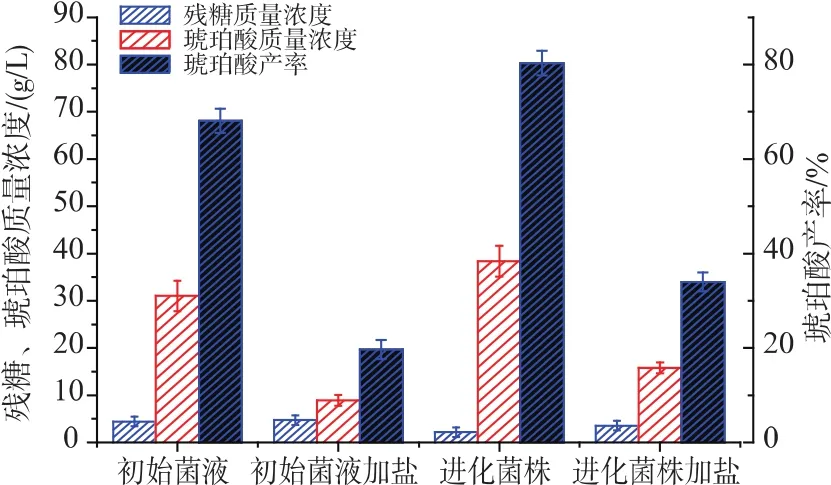
图5 摇瓶发酵验证结果Fig.5 Results of flask fermentation
2.4.3 发酵罐发酵 用3 L发酵罐分别验证初始以及适应性进化后获得的Actinobacillus succinogenes对琥珀酸的生产情况。采用补料分批发酵策略,当葡萄糖质量浓度低于10 g/L时,一次性加入高质量浓度的葡萄糖使得发酵液中葡萄糖质量浓度达到30 g/L左右,待残糖质量浓度再一次降低为10 g/L以下时,采取相似补料操作,共补料3次。初始菌株发酵结果见图 6(a),进化菌株发酵结果见图 6(b)。原始菌株补料分批发酵74 h,产琥珀酸82.6 g/L,生产强度 1.12 g/(L·h),糖酸转化率为 68.9%;进化后获得的菌株分批发酵62 h,产琥珀酸86.3 g/L,生产强度1.39 g/(L·h),糖酸转化率 78.7%。 相比于原始菌株,进化后获得的菌株糖酸转化率提高14.2%,琥珀酸生产强度提高24.1%。
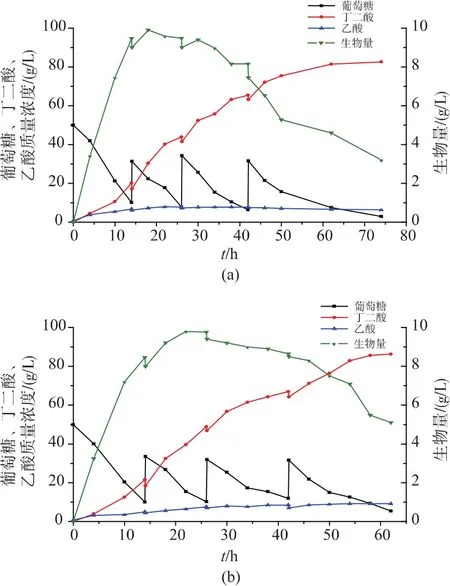
图6 初始菌株和适应性进化菌株在3 L发酵罐补料发酵产琥珀酸Fig.6 Succinic acid production with the original strain and the evoluted strain in a 3 L fermenter
3 结语
作者以粘胶作为载体构建纤维床反应器进行耐盐性琥珀酸放线杆菌的选育,其特色在于通过微生物的富集作用,为菌种选育提供了一种普适性的新方法。作者构建基于固定化琥珀酸放线杆菌的小型纤维床反应器,并将琥珀酸放线杆菌在含50 g/L琥珀酸钠的培养基中连续传代。进过两轮适应性进化之后,为提高适应性进化效率,对第二轮适应性进化所得菌株进行紫外诱变,筛选出琥珀酸产量最高的正突变株UV-1,其产量为34.6 g/L。随后用UV-1继续进行第三轮适应性进化,并提高琥珀酸钠质量浓度到60 g/L和65 g/L。最终选育出的菌株耐盐性能得到明显提高,能在含60 g/L琥珀酸钠的培养基中生长。利用进化菌株菌液摇瓶发酵的琥珀酸产量为38.4±3.14 g/L,比初始菌株提高了23.8%。在3 L发酵罐分别对进化前后的菌株进行补料分批发酵产琥珀酸的验证,相比于原始菌株,进化后获得的菌株糖酸转化率提高14.2%,琥珀酸生产强度提高24.1%。后期拟通过基因测序对突变基因进行比对,进一步挖掘适应性进化前后菌株分子生物学方面的有用信息。
