葡萄糖氧化酶基因在解脂耶氏酵母中的表达及发酵优化
2019-01-03刘晓筱堵国成
刘晓筱 , 张 娟 *, 陈 坚 , 堵国成
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
葡 萄 糖 氧 化 酶 (β -D-glucose:oxygen 1-oxidoreductase;EC 1.1.2.3.4,GOD)是一种黄素糖蛋白[1],其催化反应专一性较强,对β-D-葡萄糖有高度的专一性。葡萄糖氧化酶分子为二聚体,含有两个亚基,相对分子质量约为130 000~170 000[2],每个亚基可结合一个FAD分子,因此每个酶分子有两个FAD结合位点。GOD是一种需氧脱氢酶,以氧为电子受体,能专一地将β-D葡萄糖氧化为葡萄糖酸,氧被还原生成过氧化氢(H2O2)[3]。从GOD催化葡萄糖氧化反应的机理可以看出,辅酶FAD从β-D葡萄糖夺走两个H原子形成还原态辅酶FADH2[4],同时β-D葡萄糖被氧化生成δ-葡萄糖酸内酯,随后δ-葡萄糖酸内酯水解生成δ-葡萄糖酸,还原态的GOD被氧化成氧化态的GOD并生成H2O2[5-6],见图1。

图1 GOD催化反应β-D葡萄糖机理示意图Fig.1 Catalytic reactions of β-D glucose mediated by GOD
葡萄糖氧化酶是酶技术领域中最主要的工具酶之一,因其可以与氧和葡萄糖发生催化反应,而被广泛应用于食品[7-9]、饲料、医药等众多相关领域[10-11],在面制品、啤酒生产、牛奶生产以及食品除氮抗氧化等领域有着极其重要的作用和巨大的市场需求[12]。
葡萄糖氧化酶的工业大规模发酵生产主要采用黑曲霉[13]和青霉菌株[14],但黑曲霉和青霉在发酵过程中产生的大量杂蛋白质对后期的分离纯化工作造成很大的困难,且大大增加了生产成本。在传统技术领域,葡萄糖氧化酶的生产菌株一直通过物理方法如紫外线、γ射线和化学方法如亚硝基胍等诱变方法进行筛选。2000年以后,通过基因工程和分子生物学技术,不同来源的GOD基因已成功在同源、异源宿主细胞中得到克隆、测序和表达[15-16]。然而,这些重组菌在生产过程中抗生素或诱导剂的添加,给GOD在食品领域的应用带来了安全隐患。总体而言,已构建重组菌生产的GOD尚不能满足食品加工领域对安全性的要求。因此,构建食品级的表达体系是迫切需要的。
Y.lipolytica在1942年首次被分离得到,是研究最为广泛的非常规酵母之一,可应用于生产有机酸、酶(蛋白酶、脂肪酶、酯酶及磷酸酶)、单细胞蛋白及单细胞油脂等。Y.lipolytica曾经作为关于生理学、遗传学、二态性、基因控制、蛋白质表达及脂质积累研究的模式系统[17]。Y.lipolytica可利用葡萄糖、乙醇、乙酸及疏水性基质(如烷类、脂肪酸类及油)等作为碳源,且可分泌有机酸及蛋白质等代谢产物。20世纪末,人们将其开发成一种具有异源蛋白表达潜力的新型优良酵母表达系统。近年来,Y.lipolytica作为异源蛋白表达宿主的研究进展很快[18]。Y.lipolytica自身具备对常用抗生素的抗性,应用中一般选择营养型标记,如LEU2、URA3,这样避免了抗生素基因带来的安全性问题[19]。目前,Y.lipolytica被认为是非致病性的,FDA将其划定为Generally Regarded As Safe(GRAS),可以用于食品和药物生产领域。
作者将Aspergillus niger BBE11721葡萄糖氧化酶基因在解脂耶氏酵母中进行表达,宿主为符合食品安全要求的营养缺陷型Yarrowia lipolytica菌株,构建了一株高效分泌GOD的重组菌Yarrowia lipolytica 1-28。该重组菌发酵过程无需添加抗生素,无甲醇诱导,食品安全性较高。通过单因素及正交实验对Yarrowia lipolytica 1-28生产GOD的发酵培养基在摇瓶水平进行了优化,并在3 L发酵罐上进行了初步的发酵条件探索,为后续工业化的开发研究奠定了基础。
1 材料与方法
1.1 菌种
E.coliJM109用于构建和增值重组质粒;质粒pPIC9K/GOD用于Aspergillus niger葡萄糖氧化酶基因扩增的模板;Y.lipolyticaPo1h (Ura-,△AEP,△AXP,Suc+)为表达宿主;质粒pINA1297用于构建重组载体。以上均由江南大学生物工程学院生物系统与生物加工工程研究室提供。
1.2 培养基
LB 培养基(g/L):氯化钠 10,蛋白胨 10,酵母粉 5。
YPD 培养基(g/L):葡萄糖 20,蛋白胨 20,酵母粉10。
YNB 培养基(g/L):葡萄糖 20,YNB1.7,硫酸铵 5。
PPB 培养基(g/L):蔗糖 20,酵母提取物 1.32,氯化铵1.32,磷酸二氢钾0.32,无水硫酸镁0.132,维生素B13.34×10-4;溶于pH 6.0的柠檬酸盐缓冲液中[20]。
固体培养基在此基础上添加2 g/dL琼脂粉。
1.3 培养方法
Y.lipolytica种子培养条件:从-80℃保藏的工程菌甘油管点至YPD固体培养基,28℃培养过夜,用接种针挑取单菌落接种于YPD液体培养基中,于28℃培养18~24 h,转速为200 r/min。
Y.lipolytica发酵培养条件:采用PPB培养基,接种体积分数为10%,于28℃培养,转速为200 r/min,培养至发酵结束。
3 L发酵罐培养条件:罐装液量1.0 L(优化后PPB培养基),接种体积分数10%,搅拌转速600 r/min,通气量2.0 vvm。当溶氧第一次反弹且大于60%时开始流加50 g/dL甘油,并调整转速600~800 r/min以维持溶氧不高于30%。
1.4 DNA操作
1.4.1 质粒DNA提取 使用从上海生物工程公司购买的质粒提取试剂盒完成质粒提取,实验步骤参照说明书进行。
1.4.2 限制性酶切反应 限制性酶切反应使用从TaKaRa公司购买的限制性内切酶完成,实验步骤参照说明书进行。
1.4.3 DNA片段回收 DNA片段的回收使用从TaKaRa公司购买的胶回收试剂盒完成,实验步骤参照说明书进行。
1.4.4 DNA定点突变方法 DNA定点突变引物设计及操作使用从TaKaRa公司购买的突变试剂盒完成,实验步骤参照说明书进行。
1.4.5 酵母基因组提取 酵母基因组的提取使用从北京天根公司购买的酵母基因组提取试剂盒,实验步骤参照说明书进行。
1.4.6 大肠杆菌感受态细胞制备及转化方法 大肠杆菌感受态细胞的制备采用TaKaRa公司两步法试剂盒制备。
1.4.7Y.lipolytica感受态细胞的制备及转化 采用醋酸锂转化法[21]进行Y.lipolytic感受态细胞的制备与转化。
1.5 Aspergillus niger GOD基因的克隆与分析
以含有Aspergillus nigerGOD基因的重组质粒pPIC9K/GOD为模板,根据NCBI数据库中GOD基因序列设计含SfiⅠ和BamHⅠ酶切位点的两端引物,采用50 μL反应体系进行PCR反应,参数为:95℃预变性5 min;95℃变性30 S,52℃退火30 S,72℃延伸2 min,34个循环;72℃延伸10 min。引物序列如下:
上游引物 P1:5′-TACGGCCGTTCTGGCCAATG GCATTGAAGCCAGCCTC-3′(下划线为SfiⅠ酶切位点)
下游引物 P2:5′-CGCGGATCCTTCACTGCATG GAAGCATAATCTTCC-3′(下划线为BamHⅠ酶切位点)
按照TaKaRa公司胶回收试剂盒中的实验步骤进行回收PCR产物。
1.6 表达载体pINA1297/GOD的构建与转化
将用引物P1和P2进行PCR得到的产物与pINA1297用SfiⅠ和BamHⅠ进行双酶切,用柱回收试剂盒回收目的基因,胶回收试剂盒回收载体片段,然后两者经T4连接酶连接过夜,连接液转化到E.coliJM109。用含100 μg/mL氨苄霉素的LB平板筛选阳性转化子,提取质粒,经上海生工测序正确,得到重组载体 pINA1297/GOD。将重组载体转化Y.lipolyticaPo1h,提取酵母DNA,PCR扩增鉴定阳性转化子。
1.7 分析方法
1.7.1 菌体生物量的测定 测定菌液在分光光度计600 nm波长处的吸光度值,即OD600。1.7.2 GOD酶活力测定 参照文献[22]。
1.7.3 残余甘油浓度测定 Nash比色法测定甘油质量浓度[23]。
2 结果与分析
2.1 重组菌株的构建
将转化后菌液涂布筛选平板YNBcasa,挑取长出的菌落,采用菌落PCR鉴定其是否为重组子,成功筛选出阳性单菌落,见图2。

图2 菌落PCR验证Fig.2 Picture of colony PCR
2.2 GOD基因在Y.lipolytica Po1h中的分泌表达
阳性转化子在YPD平板上活化培养一定阶段,接种到种子液体培养基YPD中,24 h后转接至发酵培养基PPB中,28℃培养120 h,测定GOD酶活。
转化子发酵测酶活得到一株产酶能力较强的菌株Yarrowia lipolytica1-28,培养120 h后酶活达到6.4 U/mL,是野生型黑曲霉分泌所得酶活的2.8倍。利用SDS-PAGE分析重组GOD在Y.lipolytica中的表达情况,结果见图3。重组解脂耶氏酵母产生的GOD与黑曲霉GOD蛋白质的理论相对分子质量65 600[24]接近。
2.3 碳源对菌体生长和GOD酶活的影响
按照碳源质量分数相等的原则,将初始PPB培养基中的蔗糖分别替换为甘油、葡萄糖、山梨醇、乳糖、果糖和麦芽糖6种碳源以探究不同碳源种类对重组菌发酵的影响。如图4所示,碳源替换为甘油、果糖和葡萄糖时,对重组菌的生长影响不大;而以麦芽糖、乳糖和山梨醇为碳源时,菌体量显著降低。当以甘油为碳源时,GOD产量显著提高,达到8.2 U/mL,比对照提高了30%。而以其他原料为碳源时,酶活均降低。因此,选择甘油作为碳源生产GOD。

图3 重组菌Y.lipolytica 1-28表达GOD的SDS-PAGE电泳图Fig.3 SDS-PAGE analysis of GOD in Y.lipolytica 1-28
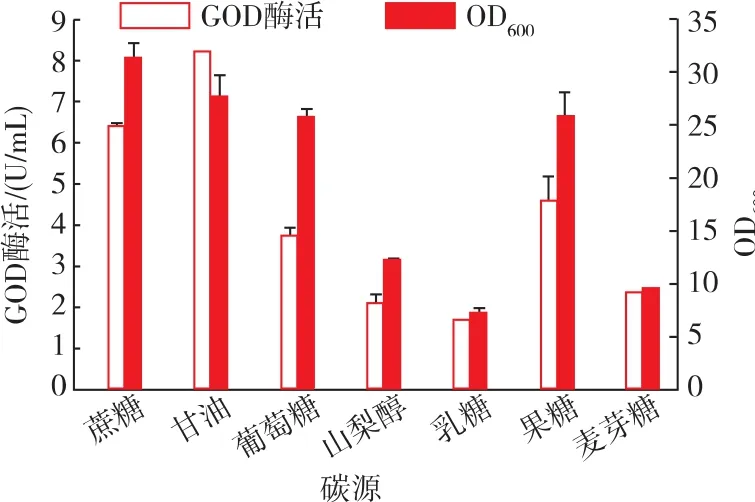
图4 不同碳源对菌体生长和GOD酶活的影响Fig.4 Effects of different carbon sources on cell growth and GOD production
进一步探究甘油浓度对重组菌发酵的影响。如图5所示,甘油质量浓度在10~40 g/L,甘油质量浓度的提高对菌体的生长有促进作用;当甘油质量浓度在10~30 g/L之间时,GOD产量随菌体量的提高而增加,可能是由于甘油量的增加促进了菌体的生长,从而影响产酶;结果表明,初始甘油质量浓度30 g/L对产酶的影响最好,GOD酶活最高达到10.9 U/mL;当甘油质量浓度高于30 g/L时,随着甘油质量浓度的增加,GOD酶活下降,这可能是由于过多的甘油对菌体产酶产生了抑制作用。结合菌体生长与产酶性能,确定甘油的初始质量浓度为30 g/L。
2.4 氮源对菌体生长和GOD酶活的影响
在上述实验的基础上进一步优化培养基中的氮源,将初始PPB培养基中的酵母提取物和氯化铵按照氮源质量分数相等的原则替换为其它氮源。如图6所示,菌体细胞对尿素的利用率较高,而对硝酸钾的利用率最低,OD600值仅为10,对酵母提取物、蛋白胨、氯化铵的利用效果差异不大。结果表明,选择酵母提取物作为单一氮源,产酶效果最佳,酶活达到10.3 U/mL,而蛋白胨及两种复合氮源对GOD的产量影响不大,尿素、硝酸钾和氯化铵均使产酶量降低。针对菌株产GOD能力,选择酵母提取物作为氮源。

图5 甘油质量浓度对菌体生长和GOD酶活的影响Fig.5 Effects of concentration of glycerol on cell growth and GOD production
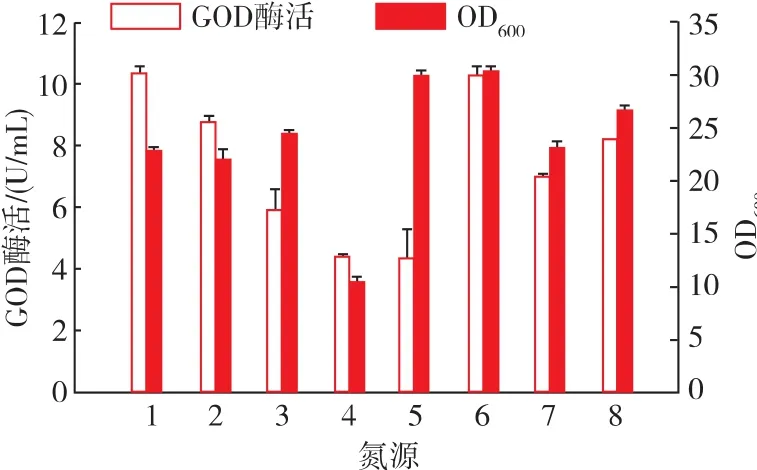
图6 不同氮源对菌体生长和GOD酶活的影响Fig.6 Effects of different nitrogen sources on cell growth and GOD production
2.5 无机盐对菌体生长和GOD酶活的影响
在上述实验的基础上,将培养基中的无水硫酸镁分别替换为七水硫酸锌、硫酸锰、七水硫酸亚铁、无水氯化钙以及四水合钼酸铵。如图7所示,相较于无水硫酸镁,其它无机盐对酵母的生长和产酶并没有提高,均呈现下降趋势。
2.6 pH对菌体生长和GOD酶活的影响
进一步探究培养基初始pH值对重组酵母菌株发酵的影响。将培养基的初始pH值分别控制为5.0、6.0、6.5、7.0、7.5、8.0、9.0, 进行重组菌株发酵培养,实验结果见图8。初始pH值为6.0时,重组菌菌体量最高,OD600值达到15,酶活也达到最高,为10.1 U/mL。因此,选择发酵培养基的初始pH值为6.0。

图7 不同无机盐对菌体生长和GOD酶活的影响Fig.7 Effects of different mineral salt growth on cell growth and GOD production
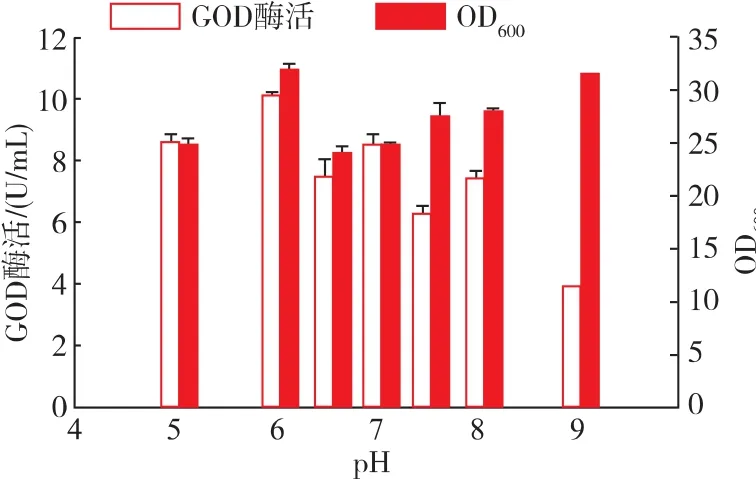
图8 不同初始pH对菌体生长和GOD酶活的影响Fig.8 Effects of pH on cell growth and GOD production
2.7 发酵培养基的正交设计优化
结合单因素实验结果,选择甘油、酵母提取物、氯化铵及硫酸镁进行四因素三水平的正交实验设计,以确定重组菌株的最佳发酵条件。因素与水平设计表见表1,实验结果见表2。
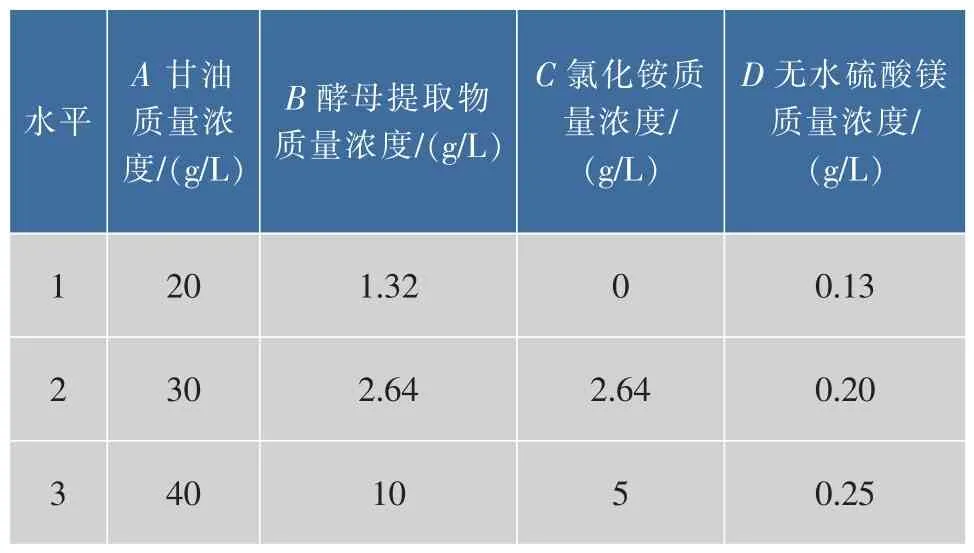
表1 正交实验因素和水平Table 1 Factors and levels of the orthogonal test

表2 正交实验结果与分析Table 2 Analysis of the orthogonal experimental results
根据实验结果分析,对葡萄糖氧化酶酶活影响的主次顺序为:酵母提取物>无水硫酸镁>甘油>氯化铵,最佳组合:甘油20 g/L、酵母膏2.64 g/L、氯化铵2.64 g/L、无水硫酸镁0.13 g/L。
2.8 摇瓶发酵条件优化前后GOD酶活对比
通过以上实验,初步优化得到重组菌株产GOD的发酵培养基为:甘油20 g/L,酵母膏2.64 g/L,氯化铵2.64 g/L,无水硫酸镁0.13 g/L,磷酸二氢钾0.32 g/L,维生素 B13.34×10-4g/L,初始 pH 值 6.0,发酵温度28℃。优化前后重组菌的发酵情况见图9。优化后GOD产量明显提高,酶活达到11.0 U/mL,较优化前GOD产量提高了72%。

2.9 3 L罐上GOD的发酵生产
前述研究了重组菌株Yarrowia lipolytica 1-28在摇瓶水平上的发酵条件优化,在此基础上,对3 L发酵罐上Yarrowia lipolytica 1-28生产GOD的发酵过程进行了初步研究。将重组菌Y.Lipolytica 1-28以10%的接种体积分数接种至3 L发酵罐中,当DO反弹且大于60%时开始流加甘油以表达重组蛋白。由于甘油流加时间过长或流速过快时,产酶均受到抑制,因此选择短时流加甘油,甘油流速为7.5 g/h,总共流加甘油量为20 g/L。3 L发酵罐流加甘油发酵生产的过程见图10。在整个发酵过程中,菌体量显示稳步增加,后达到平稳状态,最终达到35 g/L。发酵前期随着菌体量的增长,溶液pH先下降至pH 3.1,随后反弹,甘油停止流加后,pH很快上升直至8.5左右。发酵过程持续200 h,在172 h处酶活最高,达18.9 U/mL。

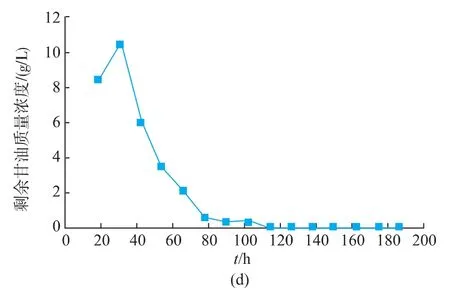
2.10 改进pH控制策略
pH控制方式对产物的积累起着重要的作用[25]。综合发酵情况可以看出,在pH自然变化的情况下,发酵液的pH先维持较低水平,发酵后期pH升高到较高水平,前后pH变化范围较大。且在pH上升至5.0左右时,GOD开始快速积累。为了充分发挥解脂耶氏酵母的发酵性能,分别控制发酵液pH为4.0、5.0、6.0,在3 L罐上进行研究。
如图11所示,控制pH对Y.Lipolytica 1-28产GOD产生较大影响,GOD酶活得到显著的提高。当控制pH分别为4.0和5.0时,GOD的酶活差异不大,其最高酶活分别为57.9 U/mL和61.0 U/mL。而当pH控制为6.0时,GOD最高酶活相对较低,为40.9 U/mL。
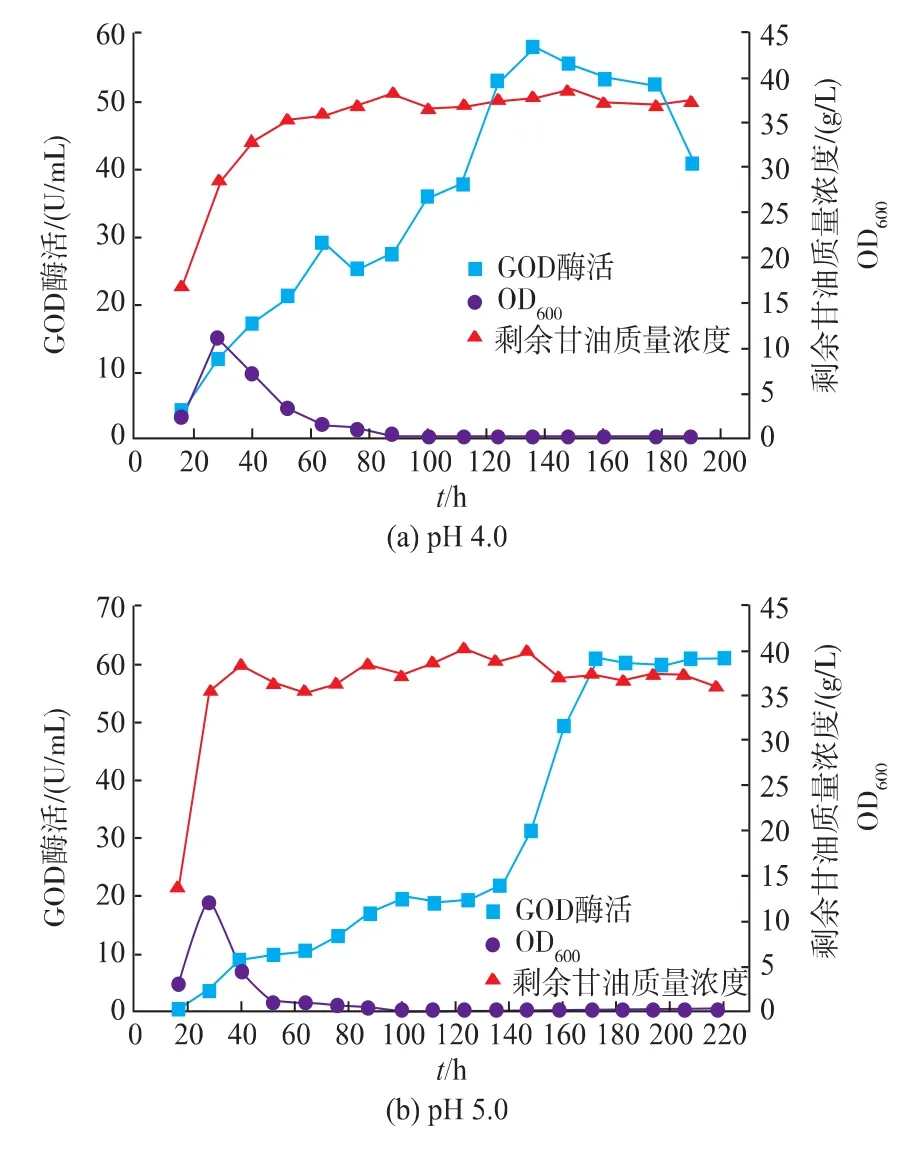
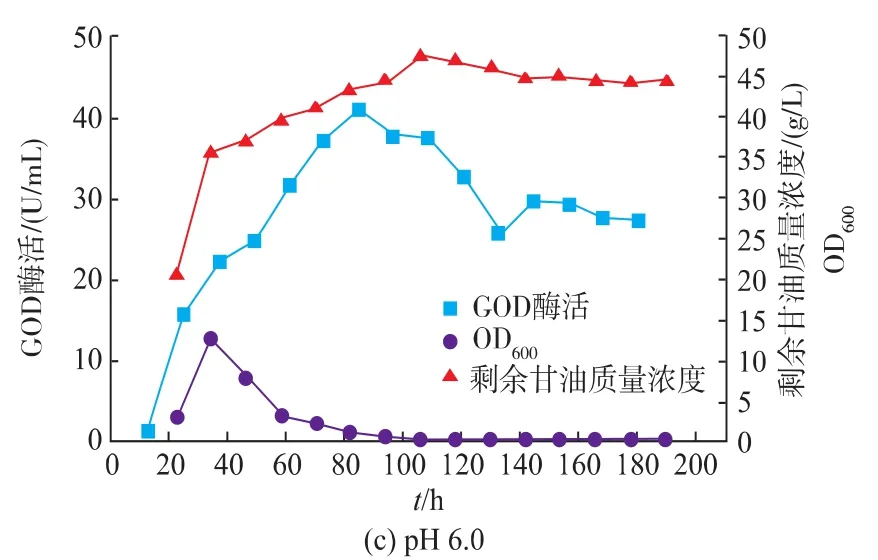
图11 pH对Y.Lipolytica 1-28在3 L罐上发酵的影响Fig.11 Fermentation result of Y.Lipolytica 1-28 at a 3L bioreactor with pH control
2.11 甘油补料对3 L罐发酵产酶的影响
在3 L发酵罐上,用4 M NaOH和2 M H2SO4控制pH恒定为5.0,分别考察了不补料和甘油补料20 g/L(见章节 3.10)、30、40、50 g/L 的产酶情况。 结果如图12所示。
在不补料情况下,调控发酵液pH为5.0,GOD的最高酶活为21.2 U/mL。在甘油补料30 g/L,发酵190 h,发酵液酶活达到最高为81.6 U/mL,与3.10中甘油补料为20 g/L相比,提高33.8%。甘油补料40 g/L和50 g/L时,甘油过剩对产酶产生了抑制作用,且产酶期延长,其GOD最高酶活分别为30.6 U/mL和25.9 U/mL。
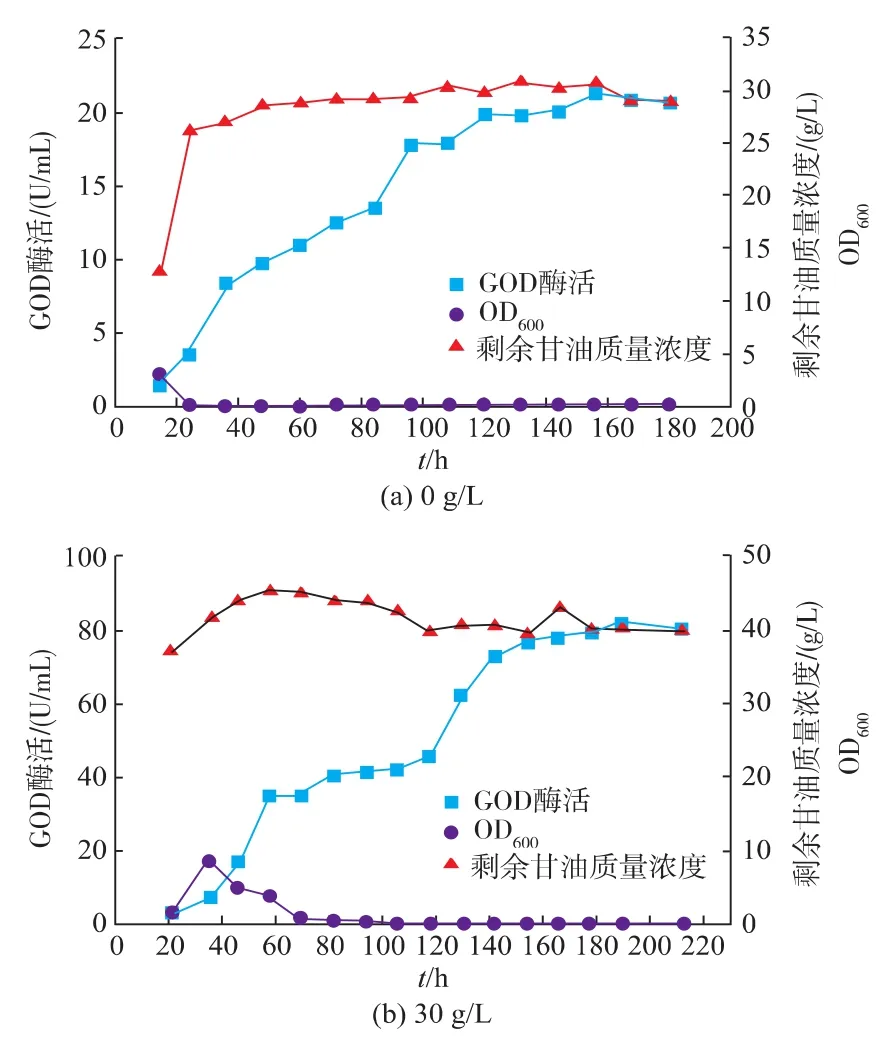

图12 甘油补料对Y.Lipolytica 1-28在3 L罐上发酵的影响Fig.12 Time-course of fed-batch fermentation by Glycerol feeding
3 结 语
作者构建了分泌表达黑曲霉来源葡萄糖氧化酶的解脂耶氏酵母重组菌株,通过单因素实验与正交实验,得到优化后发酵培养基组成如下:甘油20 g/L,酵母膏 2.64 g/L,氯化铵 2.64 g/L,无水硫酸镁0.13 g/L,磷酸二氢钾 0.32 g/L,维生素 B1 3.34×10-4g/L,初始pH值6.0,28℃发酵。采用优化培养基及发酵条件培养重组菌株,GOD发酵酶活达到11.0 U/mL,较优化前GOD产量提高了72%。在3 L发酵罐上,采用在摇瓶水平上的最优营养条件,进一步进行了pH控制和甘油流加策略的研究。在调控pH为5.0恒定,短时流加甘油量为30 g/L时,GOD酶活可达到81.6 U/mL。综上所述,通过pH控制策略和流加发酵策略的优化对重组解脂耶氏酵母产GOD有显著的提高,为食品安全级菌株高产葡萄糖氧化酶的工业生产奠定了基础。
