2-氧-α-D-葡萄糖基-L-抗坏血酸酶法合成工艺优化
2019-01-03黄立萍郝建华孙晶晶刘均忠
黄立萍 郝建华 王 伟 孙晶晶 刘均忠
(1. 中国水产科学研究院黄海水产研究所农业农村部极地渔业开发重点实验室,山东 青岛 266071;2. 上海海洋大学食品学院,上海 201306;3. 江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005)
摘要:以L-抗坏血酸和β-环糊精为底物,利用海洋微生物Y112所产的环糊精葡萄糖基转移酶(CGTase)催化合成2-氧-α-D-葡萄糖基-L-抗坏血酸(AA-2G)。在单因素试验的基础上应用Plackett-Burman试验设计筛选出3个对AA-2G产量有显著影响的因素(pH、底物浓度、加酶量),然后应用Box-Behnken方法进行三因素三水平的试验设计优化AA-2G酶法合成工艺。结果表明,最佳工艺条件为:加酶量90.78 U/g·β-环糊精,pH 9.07,底物浓度56.81 g/L,底物配比1∶1(体积比),转化时间24 h,温度45 ℃。该条件下,AA-2G的产量为10.62 g/L。
关键词:L-抗坏血酸;2-氧-α-D-葡萄糖基-L-抗坏血酸;环糊精葡萄糖基转移酶;海洋微生物
基金项目:国家重点研发计划(编号:2018YFC0311106);青岛海洋科学与技术试点国家实验室-鳌山科技计划(编号:2016ASKJ14);青岛市市南区科技发展计划(编号:2018-4-002-ZH)
作者简介:黄立萍,女,上海海洋大学在读硕士研究生。
通信作者:郝建华(1976—),男,黄海水产研究所研究员,博士。
E-mail:haojh@ysfri.ac.cn
收稿日期:2018-02-09
DOI:10.13652/j.issn.1003-5788.2018.11.037
Abstract: 2-O-α-D-glucopyranosylL-ascorbic acid(AA-2G) was transformed by marine microorganism cyclodextrin glucanotrans-ferase (CGTase) usingL-ascorbic acid andβ-cyclodextrin(β-CD) as substrate. The qualitative and quantitative analyses of AA-2G were undertaken by LC-MS and HPLC. On the basis of single factor experiment Plackett-Burman design was carried out to determine three main effective factors (pH, substrate concentration, enzyme concentration). Then Box-Behnken design using three factors and three levels was applied to optimize synthesis conditions of AA-2G. The results indicated that the optimum conditions were pH 9.07, enzyme concentration 90.78 U/g·β-CD, substrate concentration 56.81 g/L, the ratio of substrate 1∶1(volume ratio), reacting for 24 h, at 45 ℃. Under this condition the yield of AA-2G was 10.62 g/L.
Keywords:L-ascorbic acid; 2-O-α-D-glucopyranosylL-ascorbic acid; cyclodextrin glucanotransferase; marine microorganism
L-抗坏血酸(L-ascorbic acid,L-AA)又名VC,是一种人体不可缺少的营养素,人体自身无法合成VC,必须从食物中获得。VC在多种生理活动中均起到重要作用,如胶原蛋白合成、改善脂肪代谢、提高免疫力等[1]。VC可广泛应用于食品、化妆品、医疗等行业[2-4],然而VC分子结构中具有特殊的连烯二醇结构,容易被氧化失去生理活性,限制了它在各领域中的应用[5]。因此,人们一直致力于开发稳定性好的VC衍生物。
2-氧-α-D-葡萄糖基-L-抗坏血酸(AA-2G)是一种VC糖苷类衍生物,被认为是VC的最佳替代品,具有稳定性好、安全性高、生理活性与VC最接近等优势。由于AA-2G进入人体后可被缓慢分解成VC与D-葡萄糖,能持续提供VC[6],因此可添加到食品中作为抗氧化剂、VC补充剂等。此外还可应用于医疗保健、化妆品、畜牧、水产养殖等领域[7]。
AA-2G主要通过酶法合成,即利用环糊精葡萄糖基转移酶(CGTase)的转糖基作用,将葡萄糖基以α-1,4糖苷键接于L-抗坏血酸的C2上,取代原有的羟基。近年来中国对AA-2G的合成已有很多研究报道,高爱伟等[8]利用CGTase、麦芽糊精和VC合成AA-2G,在最优条件下产量为3.13 g/L;Eibaid等[9]利用CGTase转化合成AA-2G,最高产量为7.05 g/L;单丽媛[10]用游离CGTase合成AA-2G,经条件优化后产量为6.02 g/L。但均未达到工业化生产水平,一方面是由于底物的转化率较低,另一方面是单位酶活低,导致生产成本高。
海洋中有着极为丰富的微生物资源,随着海洋资源的进一步开发,与海洋微生物酶相关的研究逐渐增多,海洋微生物已成为开发新型酶制剂的重要来源。目前来自深海和极地的极端微生物作为产酶资源也成为研究热点,低温酶、碱性酶和耐盐酶等结构和功能新颖的极端酶以其独特的催化作用大大拓宽了微生物酶的应用范围。但是,目前报道的从海洋环境中分离的产CGTase的菌株只有本课题组所筛选到的Y112菌株[11],该菌株所产的酶稳定性好,单位酶活较高,在转化淀粉制备α-环糊精方面有一定的优势[12],未见其他海洋来源的产CGTase菌株。因此本研究继续探讨其在海洋生物酶法合成AA-2G方面的应用潜力,以VC和β-环糊精(β-CD)为底物,采用单因素试验和响应面分析法对合成条件进行优化,以期提高AA-2G的产量,为今后的合成工艺研究提供理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
AA-2G标准品:色谱纯,美国Sigma公司;
VC标准品:色谱纯,国药集团化学试剂有限公司;
海洋微生物环糊精葡萄糖苷转移酶酶粉:电泳纯,酶活力80 U/g,本研究室发酵制备;
β-环糊精、VC:分析纯,国药集团化学试剂有限公司;
磷酸;色谱纯,天津科密欧化学试剂有限公司;
甲醇:色谱纯,德国默克医药生物科技公司;
甲酸:色谱纯,上海阿拉丁生化科技股份有限公司。
1.1.2 主要仪器设备
全温摇床:Modle 481型,美国赛默飞世尔科技公司;
台式高速离心机:H1650-W型,长沙湘仪离心机仪器有限公司;
电子天平:HANGPING FA1004型,上海精密科学仪器有限公司;
高效液相色谱仪:Ultimate 3000型,美国戴安公司;
高分辨质谱仪:maXis Q-TOF型,美国布鲁克·道尔顿公司;
色谱柱:Symmetry C18型,5 μm (2.1 mm×150 mm),美国沃特世科技有限公司;
高效液相色谱仪:2695型,美国沃特世科技有限公司;
检测器:2996型,美国沃特世科技有限公司;
色谱柱:SB-Aq型,5 μm(250 mm×4.6 mm),美国安捷伦科技有限公司。
1.2 方法
1.2.1 环糊精葡萄糖基转移酶酶活测定方法
(1) 试验组:用0.2 mol/L的NaOH-甘氨酸缓冲液(pH 8.5)配制4 g/100 mL可溶性淀粉液做为底物,取0.9 mL 底物于试管中,50 ℃水浴预热5 min,然后加入适当稀释倍数的酶液0.1 mL混合均匀,50 ℃水浴准确反应10 min,再加入1 mL盐酸溶液(1 mol/L)终止反应,最后加入4 mL甲基橙溶液(8 mg/L)混匀,室温静置20 min。
(2) 对照组:取底物0.9 mL于试管中,50 ℃水浴预热5 min。随试验组一起50 ℃水浴反应10 min,加入1 mL盐酸溶液混合均匀后,再加入与试验组相同的酶液,其他处理与试验组相同。最后用紫外分光光度计在507 nm下测定试验组与对照组的吸光度。1个酶活力单位定义为上述条件下1 min 生成1 μmolα-环糊精所需要的酶量[13]。
1.2.2 AA-2G的鉴定 通过LC-MS 检测转化产物中是否含有AA-2G,检测条件:柱温45 ℃,流速0.3 mL/min,流动相为95%的甲酸(浓度为2%)和5%的乙腈,离子方式ESI+,锥孔电压4.5 kV,碰撞能量8 eV,质量范围50~1 500m/z。
1.2.3 AA-2G含量测定 根据文献[14],修改如下,HPLC条件为:检测波长254 nm,流动相20 mmol/L稀磷酸,流速0.8 mL/min,柱温35 ℃,进样量10 μL。用超纯水配制浓度为:250,500,1 000,1 500,2 000,3 000 mg/L的AA-2G标准液,通过HPLC分析,以AA-2G浓度为横坐标,峰面积为纵坐标,利用软件Empower pro制作AA-2G的标准曲线。经HPLC分析得出反应液中AA-2G峰面积后,在软件Empower pro中处理可直接得出AA-2G浓度。
1.2.4 单因素试验设计 酶法转化合成AA-2G条件中主要包括转化时间、温度、pH、底物浓度、底物配比、加酶量6个关键因素。设计单因素试验考察这6个因素对酶法合成AA-2G产量的影响,所有试验均重复3次。初始转化条件:反应总体系为2 mL,配制浓度均为100 g/L的β-环糊精溶液和VC溶液,各取1 mL加入反应容器中作为底物(终浓度均为50 g/L),以及0.2 g Na2SO3作为抗氧化剂,调节pH至9,按照100 U/g·β-环糊精的比例加入CGTase,在35 ℃,150 r/min反应24 h。
(1) 转化时间:按照初始转化条件,其他条件不变,转化时间分别设为6,12,18,24,36,42,48 h进行反应。
(2) 温度:按照初始转化条件,其他条件不变,反应温度分别设为15,25,30,35,40,45,50,55 ℃进行反应。
(3) pH值:按照初始转化条件,其他条件不变,调节pH值分别至4,5,6,7,8,9,10,11进行反应。
(4) 底物浓度:按照初始转化条件,其他条件不变,β-环糊精溶液和VC溶液的终浓度相同,均分别设置为10,20,30,40,50 g/L。
(5) 底物配比:按照初始转化条件,其他条件不变,分别设置β-环糊精溶液与VC溶液的比例(体积比)为1∶4,2∶3,1∶1,3∶2,4∶1作为底物进行反应。
(6) 加酶量:按照初始转化条件,分别按照0,50,100,150,200,250,300 U/g·β-环糊精的比例加入CGTase进行反应。
1.2.5 Plackett-Burman试验设计 在单因素试验的基础上,通过Plackett-Burman试验对转化时间、温度、pH、底物浓度、底物配比、加酶量6个因素进行筛选,从中选出对酶法合成AA-2G具有显著影响的因素,采Design-Expert.8.0.6软件进行试验设计及结果分析,每组试验均重复3次。
1.2.6 Box-Behnken试验设计 根据Plackett-Burman筛选出的3个显著影响因素,每个因素取3个水平,进行三因素三水平的试验,所有试验均重复3次,以获得酶法转化合成AA-2G的最佳工艺条件。
2 结果与讨论
2.1 LC-MS鉴定转化液中AA-2G
为了确认反应液中是否有AA-2G生成,对AA-2G标准品和反应液进行质谱鉴定。AA-2G的分子量为338.27。AA-2G标准品[图1(a)]m/z=339(M+H+)=m/z361(M+Na+),反应液[图1(b)]m/z= 361.07 (M+Na+),推断其分子量为338.07,与标准样品MS图一致,由此可说明反应液中含有 AA-2G。

图1 AA-2G标准品及反应液MS图
2.2 HPLC检测反应液中AA-2G含量
通过HPLC检测分析AA-2G标准品、VC标准品和反应液,结果表明,VC标准品的保留时间是5.08 min[图2(b)],AA-2G标准品保留时间是5.6 min[图2(a)],与反应液在5.6 min 处出现的峰保留时间[图2(c)]一致。通过HPLC检测梯度浓度AA-2G标准液,以AA-2G浓度为横坐标,峰面积为纵坐标,利用软件Empower pro制作AA-2G标准曲线,方程为Y=7.09E+003X+1.33E+006(R2=0.98),经HPLC分析得出反应液样品中AA-2G峰面积后,在软件Empower pro中处理可直接得出其AA-2G浓度。
2.3 酶法转化合成AA-2G的单因素试验
2.3.1 转化时间对酶法合成AA-2G的影响 由图3可知,随着转化时间的延长,AA-2G的产量大幅度增加,当时间达到24 h时,AA-2G的产量最高,超过24 h后,AA-2G产量开始减少,可能是随反应时间的延长有其他VC衍生物生成。所以选择24 h进行后续酶法转化合成AA-2G条件优化进行研究。

图2 AA-2G标准品、VC标准品及反应液HPLC图
Figure 2 HPLC analysis of AA-2G standard sample and VCstandard sample and biotransformation product

图3 转化时间对合成AA-2G的影响
2.3.2 温度对酶法合成AA-2G的影响 由图4可知,随着反应温度的升高,酶法转化合成AA-2G的产量也在不断增加,45 ℃时达到最大,随着温度的继续升高,AA-2G的产量反而逐渐下降,可能是β-环糊精溶解度较小,温度太低造成β-环糊精析出,而温度过高会导致部分酶活损失。所以选择45 ℃进行后续酶法转化合成AA-2G条件优化研究。
2.3.3 pH对酶法合成A A-2G的影响 由图5可知,当pH达到9时,酶法转化合成AA-2G的产量最高,为8.03 g/L;
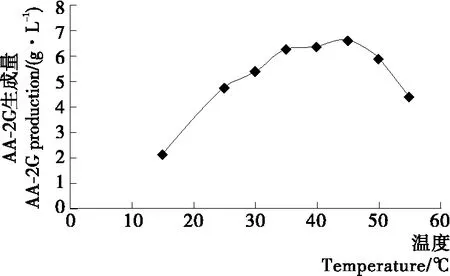
图4 温度对合成AA-2G的影响

图5 pH对合成AA-2G的影响
当pH再升高时,AA-2G的产量反而下降,可能是本实验室制备的CGTase最适pH为碱性,pH太低造成酶失活,而pH过高使VC氧化速度加快,因此合成AA-2G的产量下降。所以选择pH 9进行后续酶法转化合成AA-2G条件优化研究。
2.3.4 底物浓度对酶法合成AA-2G的影响 由图6可知,随着底物浓度的不断增加,AA-2G的产量也随之增加。当底物浓度达到50 g/L时,AA-2G的产量达到最高(6.6 g/L)。当底物浓度超过50 g/L时,AA-2G的产量反而略有下降,可能是高浓度底物降低了水的有效浓度,降低了分子扩散性,从而降低了酶促反应速度。所以选择底物浓度为50 g/L进行后续酶法转化合成AA-2G条件优化研究。
2.3.5 底物配比对酶法合成AA-2G的影响 由图7可知,当β-环糊精溶液的比例逐渐增大时,AA-2G产量缓慢增加,当β-环糊精溶液与VC溶液体积比达到1∶1时,AA-2G的产量最大,可能由于β-环糊精是糖基供体的提供者,其所占比例过大使得小分子糖类副产物生成量太多,与 VC竞争CGTase的受体位点从而抑制了AA-2G生成[14],所占比例过小则糖基供体不足,都不利于AA-2G的合成,所以选择β-环糊精溶液与VC溶液的体积比为1∶1进行后续酶法转化合成AA-2G条件优化研究。

图6 底物浓度对合成AA-2G的影响

图7 底物配比对合成AA-2G的影响
2.3.6 加酶量对酶法合成AA-2G的影响 由图8可知,在一定范围内随着酶浓度的增高,AA-2G的产量随之增加。当酶浓度达到100 U/g·β-环糊精时,AA-2G的产量最高,达到7.6 g/L。酶浓度继续升高,AA-2G的产量反而逐渐降低,可能是加酶量过大导致反应过程中过多小分子糖类副产物产生,制约了AA-2G的产量。所以选择酶浓度为100 U/g·β-环糊精进行后续酶法转化合成AA-2G条件优化研究。
2.4 Plackett-Burman试验
在单因素试验的基础上,通过Plackett-Burman试验对6个因素进行筛选,每个因素取2水平,PB试验因素水平见表1,试验设计及结果见表2。
用Design-Expert 8.0.6数据分析软件对Plackett-Burman试验结果进行处理,得到PB试验结果分析见表3,pH、底物浓度、加酶量3个因素的P值<0.05,是显著因素,因此确定这3个因素为AA-2G产量的主要影响因子。
2.5 Box-Behnken试验
Box-Behnken试验因素水平见表4,试验设计及结果见表5。

表1 Plackett-Burman试验因素水平
用Design-Expert V8.0.6数据分析软件对数据进行回归分析,分析结果见表6,P值<0.000 1,说明该模型是显著的,失拟项P=0.127 3>0.05,表明该模型的失拟项不显著。方程的R2=0.976 9,说明模型拟合度较好,能较好地预测AA-2G产量变化。二次多项式回归方程:
Y=10.25-0.99A-0.41B+2.06C-0.90AB+0.74AC+1.60BC-2.18A2-2.02B2-3.01C2。
(1)
2.6 响应面图分析
用Design-Expert V8.0.6数据分析软件进行分析,各因素的交互作用对酶法转化AA-2G产量的影响见图9~11。

表2 Plackett-Burman试验设计及结果
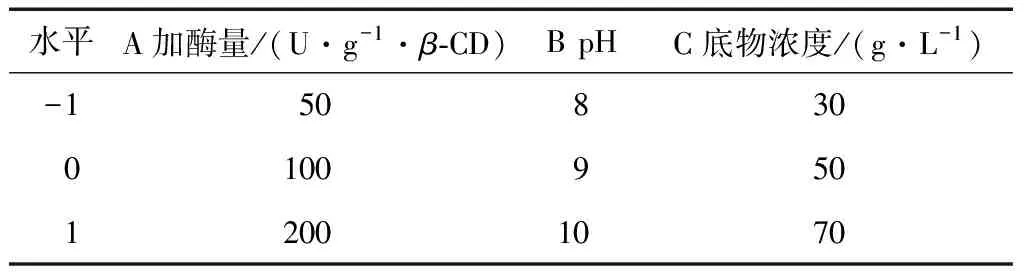
表4 Box-Behnken试验因素水平
由图9可知,响应面变化明显,随着pH的升高,AA-2G产量先缓慢增加后减小,随着加酶量的增大,AA-2G产量呈现先增加后降低的趋势。等高线图表明,等高线呈椭圆形,说明交互作用较强。由表6可知,其交互作用对AA-2G产量影响极显著。由图10可知,响应面变化明显,随着底物浓度和加酶量的增大,AA-2G产量先增加后减小。等高线图表明,沿底物浓度轴向的等高线变化密集,加酶量的轴向等高线变化比较稀疏,说明底物浓度对AA-2G产量的影响比加酶量大,等高线呈椭圆形,说明交互作用强,由表6可知,其交互作用对AA-2G产量影响显著。由图11可知,响应面变化明显,随着底物浓度和pH的增加AA-2G产量先升高再逐渐降低。等高线图表明,沿底物浓度轴向的等高线变化密集,pH的轴向等高线变化相对稀疏,说明底物浓度对AA-2G产量的影响比pH大,等高线呈椭圆形,说明交互作用强,由表6可知,其交互作用对AA-2G产量影响极显著。

表5 Box-Behnken试验设计及结果
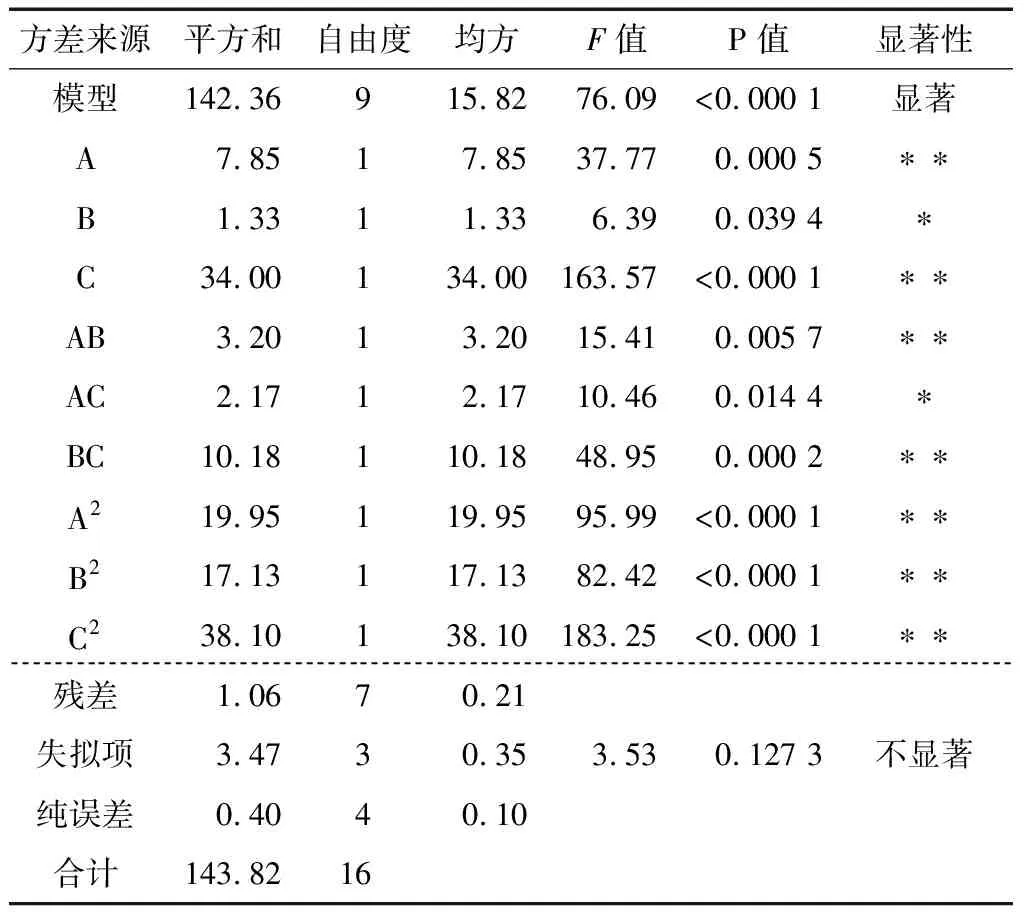
表6 响应面模型方差分析表†
† **表示极显著(P<0.01);*表示显著(0.01 对回归方程进行分析,得到理论最优条件组合:加酶量90.78 U/g·β-环糊精,pH 9.07,底物浓度为56.81 g/L,底物配比1∶1(体积比),转化时间24 h,温度45 ℃,该条件下AA-2G达到最高产量为10.67 g/L。在此条件下进行验证实验,3次实验AA-2G平均产量为10.62 g/L,与模型预测值基本吻合,说明该试验选用的模型是合理的。 图9 加酶量与pH对AA-2G产量的交互作用 图10 加酶量和底物浓度对AA-2G产量的交互作用 图11 pH和底物浓度对AA-2G产量的交互作用 本研究采用单因素试验设计及响应面分析法对CGTase酶法合成AA-2G的条件进行优化,得到了最优工艺条件为加酶量90.78 U/g·β-环糊精,pH 9.07,底物浓度56.81 g/L,底物配比1∶1(体积比),转化时间24 h,温度45 ℃,在此条件下AA-2G产量为10.62 g/L。相较于之前的研究[15],AA-2G产量达到较高水平。CGTase酶被认为是合成AA-2G的最佳酶源,但该酶价格昂贵,本实验室利用海洋微生物Y112发酵制备的CGTase酶粉单位酶活较高,有利于降低生产成本。然而游离酶存在难以回收利用的缺点,后续将对固定化CGTase合成AA-2G进行研究,进一步提高AA-2G产量及固定化CGTase的利用次数。2.7 验证实验



3 结论
