芍药苷抑制佐剂性关节炎大鼠FLS异常增殖①
2019-01-03缪成贵周丽丽熊友谊陈兵兵
缪成贵 周丽丽 熊友谊 魏 伟 陈兵兵 常 俊
(安徽科技学院生命与健康科学学院,凤阳 233100)
类风湿关节炎(Rheumatoid arthritis,RA)是一种慢性、持续性的自身免疫性疾病,发病特征集中在手、足小关节等处,呈对称性、侵袭性关节滑膜炎症,并发展为软骨侵蚀、骨的不可逆性损坏[1]。RA伴有关节外器官受累及血清类风湿因子阳性,严重者导致关节畸形及功能丧失[2]。RA发病机制目前仍不清楚,研究表明关节滑膜中成纤维样滑膜细胞(Fibroblast-like synoviocytes,FLS)的异常增殖在RA发病机制中起关键作用[3]。完全弗氏佐剂制备的佐剂性关节炎(Adjuvant arthritis,AA)大鼠病理特点与人RA非常相似,是常用的RA病理机制研究和药物治疗研究的动物模型[4]。芍药苷(Paeoniflorin,PF)来源于中药材毛莨科植物芍药根、牡丹根、紫牡丹根,作为中药材芍药中的主要有效成分,具有镇痛镇静、扩张血管、抗炎抗溃疡、解热解痉等药理作用[5]。本文以AA大鼠作为RA研究的动物模型,以FLS异常增殖作为研究切入点,从分子水平深入研究PF影响AA大鼠病理的机制,为RA防治提供新思路新方法。
1 材料与方法
1.1材料
1.1.1仪器设备 倒置荧光显微镜:日本OLYMPUS公司;实时定量PCR仪:美国ABI公司;超纯水系统:美国密理博Milli-Q Reference;酶标仪:美国BioTek公司;台式冷冻离心机:德国Eppendorf公司;-80℃超低温冰柜:日本三洋公司;细胞培养箱:美国热电公司;超净工作台:上海智城ZHJH-C1214C;紫外可见分光光度计:上海精密科学仪器公司;电子天平BP211D:德国Sartarius。
1.1.2药品试剂 PF:上海源叶生物科技有限公司,纯度≥98%,规格20 mg/支,CAS 23180-57-6;QuantiFast®SYBR®Green PCR试剂盒:德国Qiagen公司产品;Thermo Scientific RevertAid First Strand cDNA Synthesis试剂盒:美国Fermentas公司产品;Opti-MEM:美国Invitrogen公司;新生胎牛血清(Fetal bovine serum,FBS):美国Hyclone公司产品;ELISA:上海源叶生物科技有限公司;MTT、焦碳酸二乙酯(DEPC):美国Sigma公司产品。
1.2实验方法
1.2.1AA大鼠制备及大鼠足爪肿胀评分 SD雄性大鼠,体重180~200 g,安徽医科大学实验动物中心提供(合格证号:皖医动准01号)。适应性饲养7 d后,除正常组外,其余各组采用大鼠右后足跖皮内注射0.1 ml完全弗氏佐剂致炎的方法制备AA大鼠。对于PF灌胃给药,购入的实验大鼠适应性饲养后随机分为6组:正常组、AA组、PF 5 mg/kg、PF 10 mg/kg、PF 20 mg/kg组、PBS组(空白对照),每组10只。对于PF细胞给药,分为6组:正常组、AA组、PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml组、PBS组(空白对照)。大鼠足爪肿胀评分对象包括五只指关节或趾关节,一只腕关节或踝关节,共24个评分对象,每个评分对象出现结节和红肿计1分,无结节和红肿计0分,每只大鼠的足爪肿胀评分最大值是24。
1.2.2FLS原代培养 AA大鼠制备后第28天股动脉放血处死大鼠,无菌条件下取滑膜组织,去除脂肪、纤维等,取出大鼠双侧膝关节滑膜,无Ca2+、Mg2+D-Hanks液漂洗3次后剪成约1~2 mm3小块。用无菌玻璃吸管转移滑膜组织小块均匀排列在培养瓶中的底壁上,加2 ml含胎牛血清的DMEM细胞培养基,翻转培养瓶使瓶底朝上,置37℃、5%CO2培养箱内培养7 h,使其贴壁。取出培养瓶,加入预温的含胎牛血清的DMEM 1 ml培养基,再置37℃、5%CO2培养箱中继续培养3 d。3 d后更换培养基,待滑膜FLS长出组织块较多后,弃除组织块,继续培养。待细胞铺满细胞培养瓶瓶底达90%时,加胰蛋白酶0.5 ml消化细胞进行传代培养,实验用细胞为传代3~5次的FLS。
1.2.3MTT检测PF对AA大鼠FLS增殖的影响 取对数生长期FLS,胰酶消化制备1×105ml-1细胞悬液,接种于96孔培养板,每孔加入100 μl,铺板后细胞密度1 000~10 000个/孔。细胞培养箱内37℃、5%CO2培养6~8 h后,向FLS中加入PF 100、200、400 μg/ml,继续培养24 h。空白对照向FLS培养液中加入等量PBS。每孔加入20 μl MTT液(5 mg/ml,即0.5%MTT溶液),继续培养4 h。终止培养,加样器吸去孔内培养液,每孔加入150 μl二甲基亚砜,置摇床低速振荡10 min,酶标仪490 nm检测吸光度。
1.2.4Real time qPCR检测Bax、Caspase 3、Bcl-2、Fibronectin表达 分离培养各组大鼠FLS,细胞培养箱内5%CO2,37℃培养至3代后,加药PF 100、200、400 μg/ml 进入FLS培养液,继续培养48 h。空白对照向FLS培养液加入等量PBS。采用Trizol法(Qiagen)常规提取细胞总RNA,参照逆转录试剂盒(Fermentas)提供的方法逆转录得到各组细胞的cDNA,参照Qiagen公司试剂盒提供的Real time qPCR检测方法检测加药各组FLS中Bax、Caspase 3、Bcl-2、Fibronectin基因表达。mTOR基因扩增反应条件为:94℃、15 s,60℃、30 s,72℃、30 s。共40个循环。定量PCR引物序列见表1。
表1RealtimeqPCR引物序列
Tab.1SequenceofrealtimeqPCRprimer

PrimerSense(5′ to 3′)Anti-sense(5′ to 3′)BaxTTGCTACAGGGTTTCATCCATGTTGTTGTCCAGTTCATCGCaspase 3ACGGGACTTGGAAAGCATCTAAGGAAGCCTGGAGCACAGBcl-2GGTGGACAACATCGCTCTGCAGCCAGGAGAAATCAAACAFibronectinGACACTATGCGGGTCACTTGCCCAGGCAGGAGATTTGTTAβ-actinCCCATCTATGAGGGTTACGC TTTAATGTCACGCACGATTTC
1.2.5ELISA检测IL-8表达 分离培养各组大鼠FLS,细胞培养箱内培养FLS至3代后,加药PF 100、200、400 μg/ml进入FLS培养液,继续培养48 h,空白对照向FLS培养液加入等量PBS。采用上海源叶生物科技有限公司提供的ELISA检测试剂盒检测IL-8表达,根据试剂盒提供的检测步骤设置标准品孔和样品孔。标准品孔加入不同浓度试剂盒提供的标准品50 μl,样品孔加待测样品10 μl,再加样品稀释液40 μl,空白孔作为对照不加试剂。标准品孔和样品孔中每孔再加入辣根过氧化物酶(HRP)标记抗体100 μl,37℃条件下封闭孵育60 min。然后弃净孔中试剂,每孔加满洗涤液静置1 min,再弃净洗涤液,重复此操作5次。然后每孔中加检测底物A、B各50 μl,37℃避光孵育15 min,每孔最后加终止液50 μl,15 min内采用 450 nm波长测定各孔的OD值。
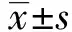
2 结果
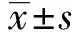
2.2PF抑制AA大鼠FLS Fibronectin基因表达 PF加药后48 h,采用Real time qPCR检测Fibronectin在正常组、AA组、PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml组、PBS组大鼠FLS中的表达。结果显示,与正常组相比,Fibronectin在AA组大鼠FLS中相对表达量由1升高至3.285 5,差异有统计学意义(P<0.05),与AA组相比,Fibronectin在PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml三组中表达显著降低,分别由3.285 5降低至2.365 8、2.307 7、2.297 6,差异有统计学意义(P<0.05)。见图1。
2.3PF抑制AA大鼠FLS IL-8表达 PF加药后48 h,ELISA检测IL-8在正常组、AA组、PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml组、PBS组大鼠FLS中的表达。结果显示,与正常组相比,AA组IL-8的ELISA检测值由0.264 8升高至0.713 3,差异有统计学意义(P<0.05)。与AA组相比,PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml各组中的IL-8的ELISA检测值分别由0.713 3降低至0.528 9、0.507 6、0.501 1,差异有统计学意义(P<0.05)。见图2。以上结果提示PF具有抑制AA大鼠病理的作用。
表2大鼠足爪肿胀评分
Tab.2Ratpawswellingscores

GroupsDay 16Day 20Day 24Day 28Day 32Normal group0.5±0.410.4±0.430.5±0.460.4±0.470.7±0.48AA group4.1±0.781)4.3±0.761)5.4±0.611)5.9±0.771)5.8±0.561)PF 5 mg/kg2.9±0.682)3.2±0.792)3.9±0.712)4.5±0.752)4.5±0.582)PF 10 mg/kg2.6±0.652)2.8±0.732)3.5±0.712)4.3±0.632)4.3±0.742)PF 20 mg/kg2.6±0.512)2.7±0.532)3.4±0.612)4.0±0.592)4.3±0.712)
Note:Compared with normal group,1)P<0.05;compared with AA group,2)P<0.05,n=10.
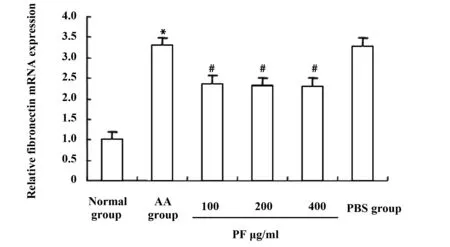
图1 PF抑制AA大鼠FLS Fibronectin基因表达Fig.1 PF inhibits expression of Fibronectin in AA FLSNote: Compared with normal group,*.P<0.05;compared with AA group,#.P<0.05,n=10.
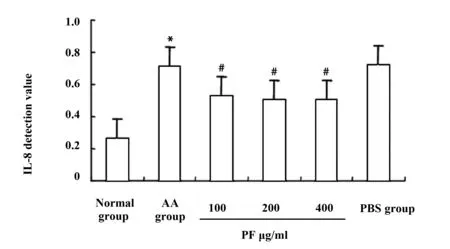
图2 PF抑制AA大鼠FLS IL-8表达Fig.2 PF inhibits expression of IL-8 in AA FLSNote: Compared with normal group,*.P<0.05;compared with AA group,#.P<0.05,n=10.
2.4PF抑制AA大鼠FLS增殖 PF加药后48 h,采用MTT检测正常组、AA组、PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml组、PBS组大鼠FLS增殖活力。结果显示,与正常组相比,AA组大鼠FLS的MTT检测值由0.095 6升高至0.410 8,差异有统计学意义(P<0.05),与AA组相比,PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml三个组的MTT检测值显著降低,分别由0.410 8降低至0.308 8、0.291 7、0.290 9,差异有统计学意义(P<0.05)。见图3。提示PF具有抑制AA大鼠FLS增殖的作用。
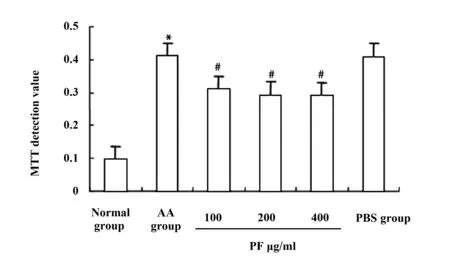
图3 MTT检测PF对AA大鼠FLS增殖的影响Fig.3 MTT was used to detect effect of PF on FLS proliferationNote: Compared with normal group,*.P<0.05;compared with AA group,#.P<0.05,n=10.
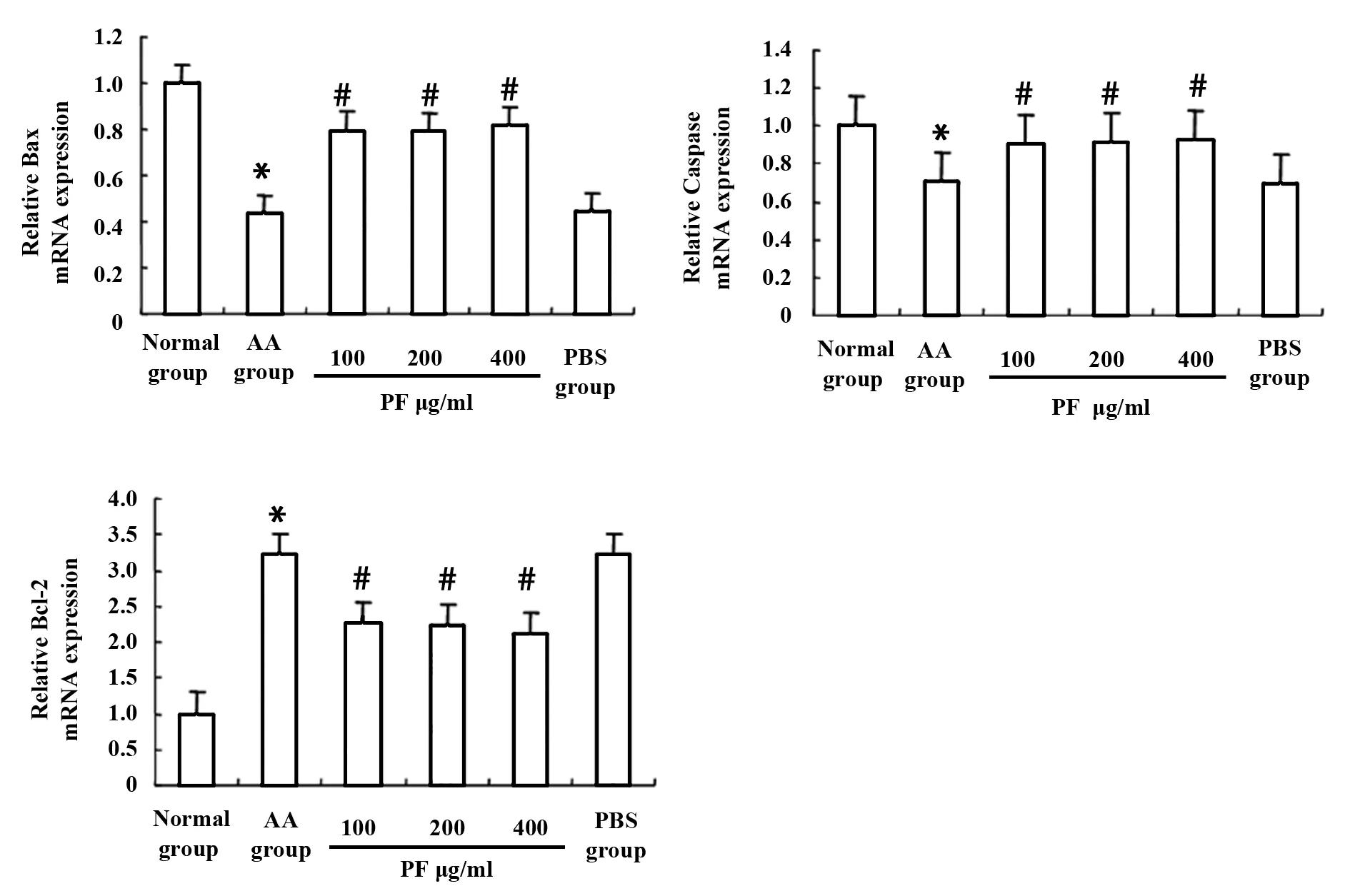
图4 Real time qPCR检测PF对AA大鼠Bax、Caspase 3、Bcl-2表达的影响Fig.4 Real time qPCR was used to detect expression of Bax,Caspase 3,Bcl-2 in AA ratsNote: Compared with normal group,*.P<0.05;compared with AA group,#.P<0.05,n=10.
2.5PF促进AA大鼠FLS凋亡 PF加药后48 h,采用Real time qPCR检测Bax、Caspase 3、Bcl-2在正常组、AA组、PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml组、PBS组大鼠FLS中的表达。结果显示,与正常组相比,Bax、Caspase 3在AA组大鼠FLS中相对表达量分别由1降低至0.4365、0.7036,Bcl-2在AA组大鼠FLS中相对表达量由1升高至3.216 6,差异有统计学意义(P<0.05),与AA组相比,Bax在PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml三组中表达显著升高,分别由0.436 5升高至0.795 2、0.7911、0.814 7,差异有统计学意义(P<0.05);Caspase 3在PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml三组中表达也显著升高,分别由0.703 6升高至0.902 6、0.909 7、0.922 1,差异有统计学意义(P<0.05);Bcl-2在PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml三组中表达显著降低,分别由3.216 6降低至2.248 5、2.233 9、2.105 7,差异有统计学意义(P<0.05)。见图4。以上结果提示PF对AA大鼠FLS凋亡具有促进作用,可能是通过促进AA大鼠FLS凋亡、抑制增殖达到治疗AA大鼠的作用。
3 讨论
尽管目前的研究较深入地阐述了RA的病理机制,但是RA发病机制仍然未能完全阐明,特别是持续的滑膜炎症和异常的滑膜增殖[6]。研究表明各种内源性和外源性抗原在不同程度上引发RA发生发展。内源抗原可能源自关节损伤导致的组织损伤,或者是细胞凋亡释放的自身固有而未被自身免疫系统识别的成分[7]。目前认为FLS的异常增殖活化在RA病理机制中起关键作用[8]。例如增生的FLS释放IL-6、IL-8、IL-15、基质细胞因子SDF-1等细胞因子和趋化因子[9]。FLS能够合成纤维连接蛋白、细胞黏附分子等细胞外基质蛋白,这些蛋白分子招募和驻留白细胞,进一步加重了病情。FLS同时促进B淋巴细胞分化,分泌基质金属蛋白酶MMP-3、基质降解酶,增强软骨的侵蚀和降解,最终导致骨的损坏和关节功能的破坏[10]。近年研究表明FLS参与了RA软骨侵蚀过程关键调控因子的合成释放,表达于FLS和T细胞上的NFκB配体RANKL与表达于单核细胞上的共用受体RANK相互作用起始了破骨细胞的分化和骨的重吸收,因此,FLS调控了具有侵蚀软骨的血管翳的形成。FLS具有干细胞的增生特性,滑膜增生可能源于关节损伤导致的滑膜细胞代偿性再生[11]。AA大鼠病理特点与人RA相似,是常用的RA研究动物模型。同时,鉴于FLS在RA发病机制中的关键作用,本试验分离培养AA大鼠FLS,以AA大鼠FLS为研究对象,检测相关分子的表达差异,探索PF对RA病理机制的影响。芍药苷来源于毛莨科植物芍药根、牡丹根等,主要包括羟基芍药甙、芍药花甙、芍药内酯甙、苯甲酰芍药甙等,具有镇痛镇静、抗炎抗溃疡、扩张血管、解热解痉、利尿等作用。本试验研究发现,与正常组相比,AA组大鼠的足爪肿胀评分明显升高,与AA组相比,各治疗组的足爪肿胀评分都显著降低,说明PF对AA大鼠有一定的治疗作用。在各组FLS培养液中加入PF 48 h后,采用Real time qPCR检测Fibronectin在正常组、AA组、PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml组、PBS组大鼠FLS中的表达。结果显示,与正常组相比,Fibronectin在AA组大鼠FLS中相对表达量显著升高,与AA组相比,Fibronectin在PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml三组中表达显著降低。ELISA检测IL-8在正常组、AA组、PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml、PBS组大鼠FLS中的表达。结果发现,与正常组相比,AA组IL-8的ELISA检测值显著升高,与AA组相比,PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml各组中的IL-8的ELISA检测值显著降低,差异有统计学意义(P<0.05),提示PF可能具有抑制AA大鼠病理机制的作用。
采用MTT检测正常组、AA组、PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml组、PBS组大鼠FLS增殖活力。结果显示,与正常组相比,AA组大鼠FLS的MTT检测值显著升高,与AA组相比,PF 100 μg/ml、PF 200 μg/ml、PF 400 μg/ml三组的MTT检测值显著降低,差异有统计学意义,说明PF具有抑制AA大鼠FLS增殖的作用。促凋亡基因Bax和细胞凋亡因子Caspase 3基因的激活表达促进细胞的凋亡,抗凋亡基因Bcl-2激活表达抑制细胞的凋亡,起到促进细胞增殖的作用[12]。在培养的各组FLS中加入PF 48 h后,采用Real time qPCR检测PF加药对AA大鼠FLS中Bax、Caspase 3和Bcl-2表达的影响。结果表明,PF具有显著上调Bax、Caspase 3表达,抑制Bcl-2表达的作用。PF可能是通过抑制FLS增殖、促进FLS凋亡的机制起到抑制AA大鼠病理发展的作用。本试验以FLS增殖凋亡为研究切入点,进一步阐明PF对RA动物模型病理影响的分子机制,为芍药苷药理药效研究提供了新的实验基础,为RA疾病防治提供新思路新方法。
