血管迷走性晕厥合并频发室性早搏患者的自主神经调控与射频导管消融治疗
2019-01-03孙巍郑黎晖乔宇侯炳波吴灵敏郭金锐姚焰
孙巍,郑黎晖,乔宇,侯炳波,吴灵敏,郭金锐,姚焰
作者单位: 100037 北京市,中国医学科学院 北京协和医学院 国家心血管病中心 阜外医院 心律失常中心
室性心律失常产生和维持机制尚未完全阐明,目前研究提示心脏自主神经系统调控可能是激发或促进室性心律失常发生的重要因素[1]。在病理情况下,心肌梗死后动物模型和临床试验均提示迷走张力减退同室性心律失常发作相关,而增强迷走张力或削弱交感张力的措施对心肌梗死后室性早搏(室早)/室性心动过速(室速)的发生具有保护作用[2,3]。但自主神经调控对特发性室性心律失常的影响仍有争议。部分研究报道观察到特发性室早/室速发作前存在交感兴奋性增高的表现[4-6],另一些研究则提示迷走兴奋性增高促进了室速甚至心室颤动的发作风险[7,8]。
血管迷走性晕厥和室早均为临床常见疾病,但目前血管迷走性晕厥患者合并症状性室性心律失常的研究报道很少[9]。血管迷走性晕厥是以迷走神经张力异常增高为特点的临床晕厥[10],其自主神经调控对室早的影响尚少见报道。因此,本研究将在血管迷走性晕厥患者中探讨自主神经调控异常对室早的影响,并评估射频导管消融治疗此类室性心律失常的特点。
1 资料与方法
研究人群: 连续入选2014-01至2015-03间因血管迷走性晕厥就诊于我科,且同时合并症状性频发室早患者20例。血管迷走性晕厥的诊断标准[11]:(1)晕厥发作有明确的精神或体位刺激诱因;(2)晕厥前驱症状包括面色苍白、恶心、呕吐、出汗等自主神经兴奋表现。频发室早定义为单次体表标准12导联心电图记录到≥1次室早和(或)动态心电图记录到室早≥30个/h[12]。排除标准如下:(1) 其他原因所致晕厥者,包括窦房阻滞、房室阻滞、肺动脉高压、主动脉缩窄、癫痫、肥厚型心肌病、脑原性晕厥等;(2)合并2型糖尿病、神经系统疾患者;(3)既往有心脏介入治疗或外科手术病史者;(4)近6个月内无晕厥发作者。
所有患者均行直立倾斜试验(HUT),检查过程中出现晕厥或晕厥前驱症状伴心动过缓和(或)低血压为阳性结果,并分为心脏抑制型、血管抑制型和混合型血管迷走性晕厥[13]。
动态心电记录:基线时和射频导管消融治疗室早后1个月随访时分别通过12导联动态心电图描记设备(MIC-12H,Jinke Medical,北京)记录患者24小时心电数据,记录期间嘱咐患者保持日常活动,但避免剧烈活动以免电极脱落。采集的心电数据上传至MIC-12H分析平台,进行心率减速力(DC)、心率变异性(HRV)和室早分析。
心率减速力分析:经MIC-12H分析软件通过位相整序信号平均技术计算DC[14]。以DC数值作为心脏迷走神经张力的定量评估指标。分别计算全天心率减速力(ODC)、昼间心率减速力(DDC, 06:00-23:00)和夜间心率减速力(NDC, 23:00-06:00),以及24 h内每小时心率减速力(HDC)。
心率变异性分析:对基线动态心电图进行HRV频域分析,包括低频功率(LF, 0.04~0.15 Hz)、高频功率(HF, 0.15~0.40 Hz)和 LF/HF,HF用于反映迷走神经兴奋性,LF和LF/HF用于反映交感神经兴奋性,计算24 h内每小时LF、HF及 LF/HF。
室早分析:经MIC-12H分析软件自动计算室早数目并进行人工校正。室早负荷定义为单位时间内室早数目占总心搏数的比例。计算全天室早负荷和每小时室早负荷。根据每小时室早负荷和每小时DC是否存在统计学意义的相关性,20例患者可分为减速力相关室早组(D-PVC组,n=14);减速力无关室早组(I-PVC 组n=6)。
左心房自主神经节丛(GP)的标测和消融:所有20例患者均接受左心房GP消融术。常规穿刺静脉并置入冠状静脉窦及右心室电极。穿房间隔将4 mm消融电极导管(IBI,雅培公司,美国)送入左心房。在接触式标测系统(EnSite-NavX,雅培公司,美国)指导下三维解剖重建左心房。采用解剖法定位GP,定位方法同参考文献[15],于常见的5个GP分布区域进行消融放电定位。消融10 s内出现一过性的心室停搏、房室阻滞或窦性心率下降≥50%定义为迷走反应阳性和GP的有效刺激位点[15]。采用温控射频消融,温度上限设置60℃,功率上限设置60 W,每次放电至少60 s。消融终点为所有GP的迷走反应消失。术中备用右心室起搏,以防止迷走反应所致的心室停搏。
室早的标测和消融:术中有4例患者无自发室早出现,经异丙肾上腺素缓慢静滴亦未诱发室早,故未行室早的电生理检查和射频消融治疗。其余16例患者均在同次手术行射频导管消融治疗频发室早,在三维电解剖标测系统(Ensite NavX, 雅培公司,美国)指导下通过激动顺序标测和起搏标测技术识别室早起源点。靶点判定标准为局部最早激动点和(或)起搏室早体表12导联中至少11个导联形态同临床室早相同。射频导管消融设置为温控模式,温度上限为60℃,功率上限为40 W,局部消融90 s。即刻成功的定义为消融结束后观察30 min内无自发室早,且静滴异丙肾上腺素亦未诱发任何室性心律失常。
随访:患者出院后1个月时于门诊随访,行体表12导联心电图和24 h心电数据采集再次评估DC和室早负荷。之后分别于出院后3个月、6个月、12个月时进行电话或门诊随访,每次随访记录患者近期动态心电图复查结果,室早复发定义为24 h动态心电图记录到室早数目>1 000个[16]。
统 计 学 处 理:使 用 SPSS 19.0(SPSS Inc,Chicago, Illinois,美国)统计软件处理资料,正态分布的计量资料以均数±标准差表达。计量资料以百分比表示。经Pearson线性相关分析每小时室早负荷和每小时心率减速力、LF、HF、LF/HF及平均心率的相关性。射频消融治疗前后心率减速力及室早负荷变化通过配对t检验分析。射频消融治疗室早的疗效使用Kaplan-Meier生存曲线分析。双侧P<0.05为差异有统计学意义。
2 结果
血管迷走性晕厥合并症状性频发室早患者的临床特征(表1): 所有患者HUT结果为阳性,其中心脏抑制型4例,血管抑制型5例,混合型11例。入选患者近6个月平均晕厥次数为(4.2±2.8)次。D-PVC组和I-PVC组患者在年龄、性别、体重指数、左心房直径、左心室直径、左心室射血分数等指标间差异无统计学意义。20例入选患者平均ODC、DDC 和 NDC 分别为(10.48 ± 3.18) ms、(9.86±3.08)ms和(12.88±4.47) ms,D-PVC组和I-PVC组患者心率减速力指标检测差异无统计学意义。
表1 血管迷走性晕厥合并症状性频发室早患者的临床特征(±s)

表1 血管迷走性晕厥合并症状性频发室早患者的临床特征(±s)
注: D-PVC:减速力相关性室早;I-PVC:减速力无关性室早;LA: 左心房前后径; LV: 左心室直径; LVEF:左心室射血分数;ODC: 全天心率减速力;DDC:昼间心率减速力;NDC: 夜间心率减速力。*:入组前6个月内血管迷走性晕厥发作次数。-:无。1mmHg=0.133kPa
项目 所有患者(n=20)D-PVC组(n=14)I-PVC组(n=6) P值一般情况年龄 (岁) 41.6±16.5 43.0±17.6 38.5±14.4 0.590女性 12/20 9/14 3/6 0.455体重指数 (kg/m2) 23.4±4.5 23.2±3.9 24.0±5.9 0.726收缩压 (mmHg) 120±11 122±10 117±11 0.298舒张压 (mmHg) 74±7 75±8 72±7 0.309血管迷走性晕厥晕厥次数(次)* 4.2±2.8 4.2±2.3 4.1±4.0 0.973直立倾斜试验阳性(例) 20/20 14/14 6/6 -混合型 11/20 7/14 4/6 0.642心脏抑制型 4/20 3/14 1/6 0.657血管抑制型 5/20 4/14 1/6 0.550超声心动图检查LA (mm) 30.5±3.8 30.3±3.5 31.0 ±4.9 0.714 LV (mm) 45.2±3.9 45.0±4.1 45.7±3.8 0.740 LVEF (%) 65.9±4.7 66.0±5.6 45.7±3.8 0.888心率减速力检测ODC (ms) 10.48±3.18 10.82±3.17 9.69±3.33 0.483 DDC (ms) 9.86±3.08 9.92±3.12 9.73±3.29 0.906 NDC (ms) 12.88±4.47 14.12±4.23 9.99±3.90 0.056
两组患者基线室早负荷同迷走神经张力的相关性分析(表2,图1):D-PVC 组患者每小时室早负荷和DC呈正相关(P<0.05),且两者24 h波动呈相似趋势;I-PVC组患者每小时室早负荷同DC不相关(P>0.05)。进一步分析显示,D-PVC组患者每小时室早负荷同平均心率呈负相关(P<0.05),且部分患者中反应迷走兴奋性的HF指标同每小时室早负荷呈正相关(P<0.05),而反应交感兴奋性的指标LF/HF同每小时室早负荷呈负相关(P<0.05)。而在I-PVC组患者中,每小时室早负荷同平均心率和HRV指标均不相关(P均>0.05)。

图1 两组每小时室早负荷和每小时心率减速力的波动周期及Pearson线性分析散点图
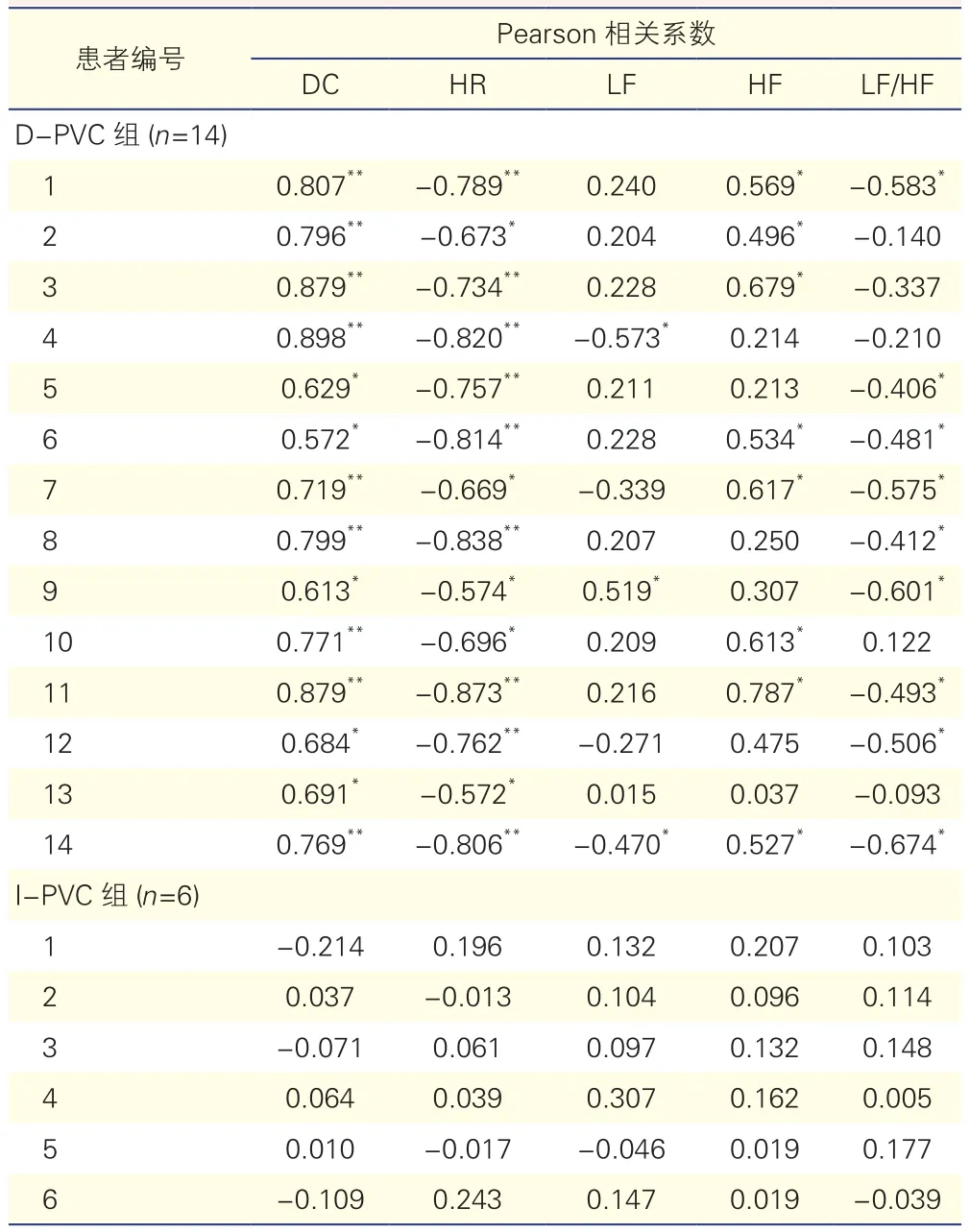
表2 D-PVC组和I-PVC组患者每小时室早负荷同每小时心率减速力、平均心率及心率变异性指标的相关性分析
血管迷走性晕厥合并症状性频发室早患者左心房GP消融:20例患者均接受左心房GP消融,共标测并消融39个呈阳性反应的GP。其中19例左上GP呈阳性反应,4例左侧GP呈阳性反应,6例左下GP呈阳性反应,9例右上GP呈阳性反应,4例右下GP呈阳性反应。
血管迷走性晕厥合并症状性频发室早患者室早的标测与射频消融治疗结果(表3):16例行室早消融的患者均联合采用激动顺序标测和起搏标测标测到室早起源点。室早均起源于流出道,其中15例起源点位于右心室流出道,1例为左冠窦起源。两组间室早联律间期、室早QRS波宽度、腔内标测最早激动时间差异均无统计学意义。射频消融即刻成功率为100%,无介入相关并发症发生。
表3 血管迷走性晕厥合并症状性频发室早患者的电生理检查及射频消融治疗结果(±s)
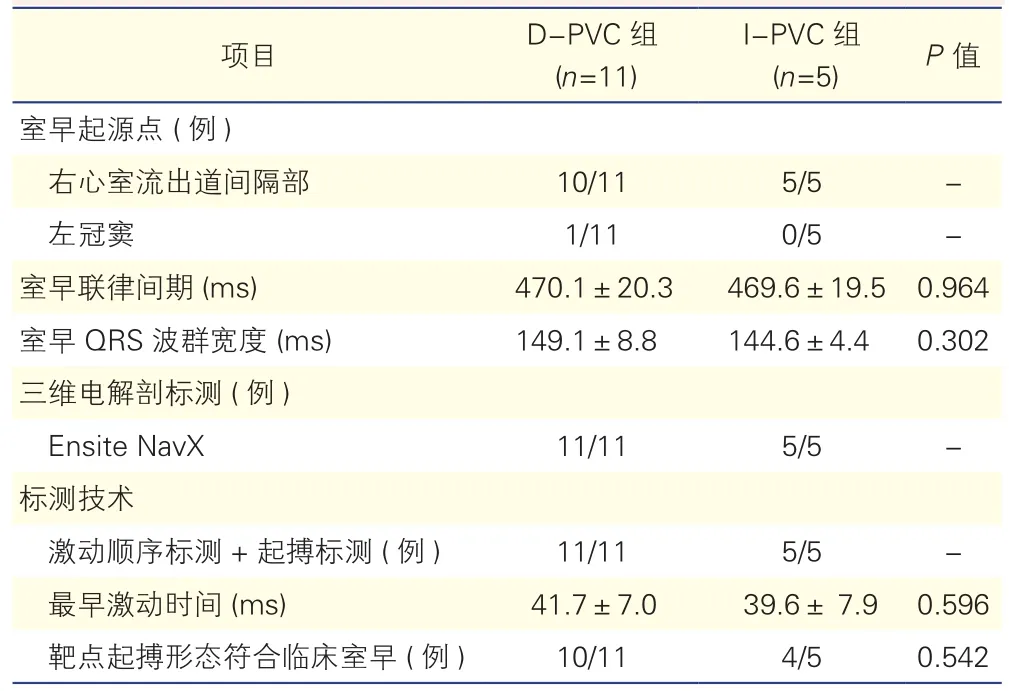
表3 血管迷走性晕厥合并症状性频发室早患者的电生理检查及射频消融治疗结果(±s)
注:D-PVC:减速力相关性室早;I-PVC:减速力无关性室早。-:无
项目 D-PVC组(n=11)I-PVC组(n=5) P 值室早起源点 (例)右心室流出道间隔部 10/11 5/5 -左冠窦 1/11 0/5 -室早联律间期 (ms) 470.1±20.3 469.6±19.5 0.964室早QRS波群宽度 (ms) 149.1±8.8 144.6±4.4 0.302三维电解剖标测 (例)Ensite NavX 11/11 5/5 -标测技术激动顺序标测+起搏标测 (例) 11/11 5/5 -最早激动时间 (ms) 41.7±7.0 39.6± 7.9 0.596靶点起搏形态符合临床室早 (例) 10/11 4/5 0.542
射频导管消融治疗前后DC和室早负荷的变化(表4):平均随访(8.6±4.5)个月时,1例患者晕厥复发,1例室早复发。同基线相比,16例同时接受左心房GP消融和室早消融的患者术后1个月ODC、DDC和NDC均显著降低(P<0.001),室早负荷由(217.21 ± 106.72)‰降至(8.74 ± 14.42)‰(P<0.001)。仅接受左心房GP消融且术后未应用抗心律失常药物的4例患者DC指标较基线降低(P<0.05~0.01),室早负荷由(244.68±125.62)‰降至(92.15±40.04)‰(P=0.040)。
表4 血管迷走性晕厥合并症状性频发室早患者射频导管消融治疗前后心率减速力和室早负荷的变化(±s)

表4 血管迷走性晕厥合并症状性频发室早患者射频导管消融治疗前后心率减速力和室早负荷的变化(±s)
注:GP:自主神经节丛;ODC:全天心率减速力; DDC:昼间心率减速力; NDC:夜间心率减速力
项目 左心房GP消融+室早消融(n=16) 仅左心房GP消融(n=4)基线 术后1个月 P 值 基线 术后1个月 P值ODC (ms) 10.41±3.27 3.58±2.80 <0.001 10.74±3.22 4.32±3.63 0.029 DDC (ms) 9.91±3.16 3.32±2.70 <0.001 9.70±3.23 3.73±3.01 0.048 NDC (ms) 12.54±4.77 4.16±3.24 <0.001 14.25±3.18 5.19±4.23 0.001室早负荷(‰) 217.21±106.72 8.74±14.42 <0.001 244.68±125.62 92.15±40.04 0.040
3 讨论
自主神经调控对室性心律失常发生、维持、终止的影响一直是未尽的讨论。大部分研究报道交感神经兴奋性增加是激发或加剧室性心律失常的重要因素[2-6]。Hasdemir等[17]报道多巴胺持续泵入时于肺动脉高频刺激可在健康志愿者诱发出右心室流出道起源特征的室早/室速。动物实验证实交感神经消融(降低交感张力)对室速/心室颤动的发生具有保护作用[18]。然而,同样有研究提示迷走张力增高可诱发或促进室性心律失常的发生[7,8,19]。尤其在特发性心室颤动患者中,夜间睡眠时迷走张力增加可导致J波显著抬高,进而显著增加特发性心室颤动的发病风险[7]。
本研究中症状性室早患者同时是罹患血管迷走性晕厥的特殊人群,血管迷走性晕厥是自主神经调节障碍所致的疾病,其特征为异常增高的迷走神经张力[10]。DC是Bauer等[20]提出的定量评估心脏迷走张力的指标,早期应用于急性心肌梗死后患者的危险分层。本研究中患者的DC测量值显著高于文献报道中健康志愿者DC测量值[21]。此外,本研究通过分析每小时DC和每小时室早负荷的相关性来探讨自主神经对室早发生的影响。在D-PVC组患者中,室早负荷同DC呈正相关,两者24小时的节律波动周期呈现一致性,迷走张力增加时单位时间内室早数目同时增加;在I-PVC组患者中,室性早搏的发生不受迷走张力变化的影响。本组20例患者中有4例患者(均为D-PVC组患者)在导管室因无室早出现仅进行了左心房去迷走神经消融,术后随访发现其DC较术前显著减低,同时在无抗心律失常药物治疗的情况下室早负荷也较术前减少。因此,在部分症状性室性心律失常合并血管迷走性晕厥的患者中,迷走神经兴奋性增加可能是推动室早发作的调节因素。自主神经调控对室性心律失常的影响可能同早期后除极(early afterdepolarization, EAD)引起的触发机制相关[22],迷走神经兴奋性增高时心率减慢,动作电位时长延长可易化EAD的产生,最终触发室性心律失常。
研究发现血管迷走性晕厥合并的症状性室早均起源于流出道,且大部分位于右心室流出道,在三维标测系统下结合激动顺序标测和起搏标测可以准确定位靶点,消融即刻成功率为100%,平均(8.6±4.5)个月的随访期内成功率为93.8%,与目前文献报道的特发性室早射频消融治疗成功率相近(82%~100%)[23,24]。
本研究首次报道了血管迷走性晕厥合并频发室早的临床现象,初步探索了此类患者中自主神经调控对症状性频发室早的影响及射频导管消融对室早的治疗价值。在近70%血管迷走性晕厥合并症状性频发室早患者中,迷走神经张力增高可在心律失常基质存在的基础上促进和加重室早的产生,因此β受体阻滞剂类抗心律失常药物(抑制交感兴奋性)可能并非合适的治疗措施,射频导管消融是有效且安全的选择。
