马血凝血酶原纯化方法的比较研究
2019-01-02米丽班霍加艾合买提阿迪拉吐尔孙塔依马合木提买买提明
米丽班·霍加艾合买提,阿迪拉·吐尔孙塔依,马合木提·买买提明
(1.新疆师范大学 化学化工学院,新疆 乌鲁木齐 830054;2.新疆师范大学 生命科学学院,新疆 乌鲁木齐 830054;3.新疆医科大学 药学院化学教研室,新疆 乌鲁木齐 830011)
凝血酶是机体凝血系统中的一种天然成分,是一种在血液凝固系统中起重要作用的丝氨酸蛋白水解酶。凝血酶原是一种糖蛋白,约占总糖含量的11%。凝血酶原被激活,并转化为凝血酶。临床用于毛细血管出血的局部止血和外科手术后组织愈合等,此外作为生化试剂广泛用于医学和生物学方面的研究[1]。临床上所用的凝血酶来源于马血、牛血或猪血。中国在马血资源方面有着得天独厚的优势[2]。目前,大部分马血直接被丢弃掉,一方面造成资源的巨大浪费,另一方面也给环境造成污染。因此对马血进行研究并加以利用,可以将马血“变废为宝”。
对于凝血酶的获取,一般都从人血和牛血中分离纯化居多,而从马血中获取凝血酶的研究甚少。但是,对马血进行研究并加以利用,马血凝血酶的研究也将逐渐增大,马凝血酶的研究也将会日渐增多。在新疆由于传统的饮食习惯和文化特色,每年消耗大量的马肉、马乳,因此创办了一批马肉、马乳加工企业,这些企业是马业产品发展的基础。近年来,随着生物技术的进步,马的生物、医疗制品业应运而生,促进新疆马业产品向高、精、尖方向发展,产生了较好的经济和社会效益,直接带动了农牧民增加收入,推动新疆马业向多元化、多领域、高层次方向发展。
文章探讨从马血中提取纯化凝血酶原的方法,通过比较不同的纯化方法,以期探索出一种既能提高产率和酶活力,操作又简单、价格低廉的纯化方法,在工艺和产量上达到突破,从而满足人们的需求,进一步促进医药工业、食品工业的发展。
1 材料与设备
1.1 材料与试剂
马血:品种为哈萨克马。
超滤膜材料:截留分子量为30KDa的再生纤维素(RC)膜。
填充剂材料:D301大孔弱碱性苯乙烯系阴离子交换树脂。
实验试剂:柠檬酸三钠、纤维蛋白原、凝血酶标准品、氯化钙、柠檬酸、盐酸、氢氧化钠、冰乙酸、碳酸氢铵、乙醇等。
1.2 仪器与设备
TD5A-WS台式低速离心机,长沙湘仪离心机仪器有限公司;AL204-IC电子天平,梅特勒托利多仪器有限公司;HH-54数显恒温水浴锅,金坛市医疗仪器厂;60cm×1.5cm玻璃柱,新疆宝信公司。
2 试验方法
2.1 马血浆的制备
3.8 %柠檬酸三钠与新鲜马血以7:1体积比混合搅拌均匀后,以3500r/min的转速离心20min,除去红细胞,收集血浆,装在400ml锥形瓶里,-10℃保存备用。
2.2 马凝血酶原的提取
取40ml在4℃解冻的血浆置于烧杯中,以9倍体积的冷却的纯净水稀释,充分搅拌,静置30 min后,用1%醋酸调节pH值至5.1。在5℃静置6h后,在离心机以3000r/min速度离心10min,弃去上清液,收集沉淀。将沉淀混合液溶于0.9%氯化钠和0.075%草酸钾溶液的混合液中,搅拌均匀,以3000r/min的速度离心10min后,取1/3样品于培养皿中,在零下20℃储存。剩下的2/3的样品保存在4℃备用。
2.3 超滤膜纯化凝血酶原
2.3.1 膜纯化的原理
使用压力和离心力使无机盐、糖类、水等通过超滤膜,而蛋白质分子则不能通过超滤膜,从而达到浓缩和纯化该蛋白的目的。
2.3.2 膜的选择
纯化蛋白质最重要的是膜的选择,并需要考虑纯化用的超滤膜的截留分子量和纯化蛋白质的分子量。
凝血酶原是一种蛋白质,分子量为68000Da,存在于血浆中,是血液凝固因子之一。因此,所选用的超滤膜的截留分子量应小于68000Da,为保险起见,本实验选用截留分子量为30000Da的膜来纯化凝血酶原液。
2.3.3 膜纯化的步骤
400ml烧杯放入300mL凝血酶原液,在压力为0.15MPa,温度为5℃,流速为35.67m/s的条件下用截留分子量为30KDa的RC膜,以2倍浓缩纯化凝血酶原液,收集膜上部分,分装在培养皿中,在零下20℃的条件下保存备用。
2.4 真空冷冻干燥
为了得到凝血酶原干粉,将未纯化的凝血酶原液与已纯化的凝血酶原液分别进行真空冷冻干燥24h,真空冷冻干燥能除去近95%的水分,而且蛋白质不会发生变性,也不会失去活性,还能够长期保存,后期使用时,加水后即可溶解,立即恢复原状。
2.5 阴离子交换法纯化凝血酶原
2.5.1 离子交换层析法的原理
离子交换层析中,基质是由带有电荷的树脂或纤维素组成。带有正电荷的称为阴离子交换树脂;而带有负电荷的称为阳离子树脂。离子交换层析同样可以用于蛋白质的分离纯化。由于蛋白质也有等电点,当蛋白质处于不同的pH条件下,其带电状况也不同。阴离子交换基质结合带有负电荷的蛋白质,所以这类蛋白质被留在柱子上,然后通过提高洗脱液中的盐浓度等措施,将吸附在柱子上的蛋白质洗脱下来。结合较弱的蛋白质首先被洗脱下来。反之阳离子交换基质结合带有正电荷的蛋白质,结合的蛋白可以通过逐步增加洗脱液中的盐浓度或提高洗脱液的pH值洗脱下来。
2.5.2 离子交换剂的选择
常用的离子交换剂有如下三种:离子交换纤维素、离子交换葡聚糖、离子交换树脂。在用离子交换树脂进行蛋白质分离时,pH是重要的因素。提高离子交换层析分辨率和有效成分得率的重要环节就是分离物质的pI选择合适的离子交换剂和洗脱强度。因此,本实验选用树脂作为交换剂。
2.5.3 树脂纯化凝血酶原的步骤
1.树脂的预处理[3,4]
(1)称取约为35g的树脂放置于大烧杯中,浸泡于高出树脂层10cm到20cm的70%乙醇24h;
(2)用乙醇洗至树脂流出液不浑浊,以避免残留树脂碎片等;
(3)用水洗至树脂无醇味;
(4)以5%HCl浸泡树脂2-4h,水洗至中性;
(5)以2%NaOH浸泡树脂2-4h,水洗至中性,备用。
2.装柱与平衡
(1)将层析柱垂直夹在铁架台上,关闭出口,向柱中加入1/3柱体积的蒸馏水;
(2)将处理好的树脂连续加入柱中,使其自然沉降。待树脂沉降约5cm后,打开出口,调节合适的流速,使树脂继续沉降,待沉积面上升至距顶端处约5cm时,关闭出水口;
(3)洗脱液为0.05mol/L碳酸氢铵(pH=8),以0.5mL/min的流速平衡层析柱,并始终保持树脂上端有一段液体,以免产生气泡影响层析效果。
3 上样与洗脱
实验成功或者失败的最关键的环节是样品上柱。如果样品稀释或者上柱不均,将会影响层析效果。上样时要尽量保持床面的稳定。首先打开柱的出口,待柱中洗脱液流至距柱床表面1-2mm时,关闭出口,然后用滴管将1mL样品缓缓地加至柱床表面,应避免树脂被冲起。最后打开出口并开始计算流出体积。
当样品渗入柱床中接近床表面1mm时关闭出口。按加样操作,用少量(约1mL)碳酸氢铵洗脱液冲洗管壁2次。最后在树脂上加入少量洗脱液,并使液体高出柱床表面3-5cm,出口洗脱液流速调节为0.5mol/min,依次用不同体积分数的NaCl与碳酸氢铵(20%、40%、60%、80%、100%)混合液进行洗脱。出口处用10mL量筒接样后移入小瓶中,4℃保存备用。
4 收集与鉴定
每10mL收集一瓶样液,并给每瓶编号。收集完毕后,将样液分组,激活测凝血酶活力。共收集样液55瓶,分为11组。第一次激活后测出23号与28号有活力。经扩大范围,第二次激活后测出23号至30号有活力,其中27号活力最高,其洗脱液NaCl的体积分数为60%。
4.1 凝血酶活力的测定
利用凝血酶催化纤维蛋白原凝固的原理测定其活性。酶活力的单位定义:在最适温度下,1分钟内能转化1微摩尔底物的酶量为一个国际单位(U)[5]。
4.1.1 凝血酶标准曲线的绘制
在72mL 0.9%NaCl溶液中,加入90mg纤维蛋白原,配制成纤维蛋白原溶液,并置于8支离心管中,在4℃下保存备用。
在4支试管中分别配制凝血酶原浓度为5.0 U/mL,6.4 U/mL,8.0 U/mL,10 U/mL的标准品溶液选用0.9%NaCl溶液[6]。
另取4支试管,各试管分别加入0.9mL精密量的纤维蛋白原溶液,置于37℃水浴中保温5min后,再分别取上述4种各标准溶液为0.1mL浓度的溶液,迅速加入上述各管中,摇匀,立即计时,置于37℃水浴中,观察纤维蛋白原的初凝时间,每种浓度测5次,求平均值[5],如表1所示。
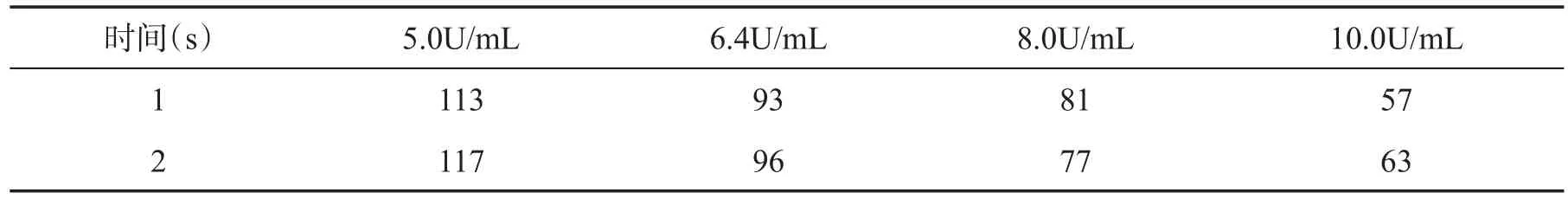
表1 纤维蛋白原凝结时间
7 1 6 4 6 6 6 4 3 4 5平均值1 2 1 1 1 0 1 0 6 1 1 3 9 5 1 0 3 1 0 1 9 8 8 4 8 9 9 3 8 5
根据凝血酶标准品与纤维蛋白原的凝结时间对应的结果,以标准品效价的对数为纵坐标,凝结时间的对数为横坐标[6],计算方程,如图1所示。
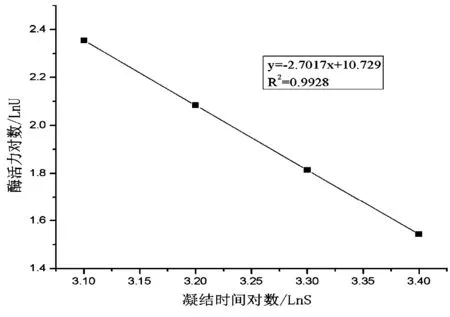
图1 凝血酶标准曲线
4.1.2 凝血酶原的激活
在试管中,加入体积为5ml的凝血酶原夜,加入浓度为0.1mol/L的CaCl2溶液,在温度为30℃的条件下激活2.5h。
4.1.3 凝血酶活力的测定
在试管中分别加入体积为0.9ml的纤维蛋白原液,在37℃水浴中保温5min,然后加入体积为0.1ml的凝血酶溶液,摇匀,立即置于37℃水浴中,观察纤维蛋白原的凝血时间。测3次求平均值,从标准曲线上查得酶活力。以此方法分别测出未分化凝血酶原液、超滤膜纯化凝血酶原液、树脂纯化凝血酶原液激活后的活力。
5 结果
5.1 等电点提取凝血酶原
按7∶1添加3.8%的柠檬酸三钠后的10L马血,经离心后得到5675mL血浆,提取率为56.75%,除去部分损耗血浆,真空冷冻干燥后得到凝血酶原干粉5g。
5.2 不同纯化方法的凝血酶活力

表2 不同纯化方法的凝血酶活力
由表2可以看出经超滤膜纯化后,凝血酶活力提高了130 U/mL,提高到未纯化粗酶的2.1倍,经大孔树脂纯化后,凝血酶活力提高了182 U/mL,提高到未纯化粗酶的2.5倍。
6 结论
凝血酶原的提取方法有多种,本实验选用等电点沉淀法提取。超滤膜纯化凝血酶原是将粗凝血酶原液中的各种无机盐、各种单糖等除去,达到浓缩和纯化凝血酶原液的目的。大孔树脂离子交换法的原理是用所带电荷种类和数量不同的蛋白质,能达到分离开凝血酶原液中的不同蛋白质的目的。采用这种分离纯化方法分离纯化蛋白质时也能够增加具有活力的蛋白质浓度,因此相比于超滤膜纯化酶的活力也有提高。因此,大孔树脂纯化效果明显优于超滤膜纯化效果。
凝血酶原液的粗酶活力为119 U/mL,超滤后酶活力为249 U/mL;大孔树脂纯化后酶活力为301 U/mL。结果表明大孔树脂的纯化效果优于超滤膜的纯化效果。如果将超滤膜纯化与大孔树脂阴离子交换层析法结合起来,就会得到活力较高的凝血酶产品。
