羊骨髓肽及其钙螯合物对成骨细胞增殖和活性的影响
2019-01-02金淑秀王钰慧霍乃蕊郑明学韩克光古少鹏田文霞
金淑秀,王钰慧,霍乃蕊*,郑明学,韩克光,古少鹏,田文霞,张 鼎
(1.山西农业大学 动物科技学院,太谷 030801; 2.山西农业大学 食品科学与工程学院,太谷 030801)
骨质疏松(osteoporosis,OP)是由于成骨细胞(osteoblast,OB)介导的骨形成与破骨细胞(osteoclast,OC)介导的骨吸收失衡,导致骨吸收大于骨形成而引起的以骨小梁稀疏、断裂、骨量减少、骨密度下降为特征的骨代谢疾病[1-2]。受集约化养殖、环境污染、动物生产、其他疾病发生等因素的影响,畜禽OP越来越受到人们的重视。
除骨形成作用外,OB还参与OC骨吸收活性的调节[2-4],在RANK/RANKL/OPG信号通路中,OB分泌的RANKL可识别OC前体细胞表面的RANK并与之结合,转导骨吸收信号以调节OC前体细胞的增殖和成熟。另外OB分泌产生的OPG可与RANK竞争性地结合RANKL,从而防止骨的过度吸收,可见OB的数量和活性将直接决定骨量及骨密度[4-6],提高OB的细胞数量和成骨活性在骨质疏松防治中尤为关键。
课题组前期研究表明,羊骨髓肽(marrow peptides,MP)及其钙螯合物(MP-Ca)对去卵巢大鼠均具有明显的骨质改善作用,且比雌激素更安全[7]。在抗骨质疏松新药筛选和药效学评价中,体外培养的成骨细胞是一种重要模型[2,8]。为进一步揭示MP、MP-Ca改善骨质的机制,本研究通过体外试验探究二者对成骨细胞增殖及活性影响,并将二者的效果进行比较,为研发更安全、更有效的OP防治药物提供理论依据。
1 材料与方法
1.1 试剂及仪器
Tensor 27型傅里叶变换红外光谱仪(Bruker光谱仪器公司)、MC721酶联免疫检测仪(上海箐华科技仪器有限公司)、Ⅱ型胶原酶(Sigma)、0.25%胰蛋白酶-EDTA消化液(HyClone)、100× 青霉素链霉素混合液(北京博奥拓达科技有限公司)、胎牛血清(浙江天杭生物科技有限公司)、17β-雌二醇(Sigma)、牛血清白蛋白(BSA Solarbio)、Trition-X100(Sigma)、Cell Counting Kit-8试剂盒(日本同仁)、碱性磷酸酶(ALP)测试盒及总蛋白定量测试盒(南京建成生物工程研究所)、Rat BGP ELISA Kit(上海桥杜生物科技有限公司)。羊骨髓肽(内蒙古锡盟肽好生物制品责任有限公司生产)中的蛋白质含量为96%(以干基计),DMEM/F12培养基(Gibco)中加入10%胎牛血清、1%青霉素链霉素混合液制得完全培养基。
1.2 羊骨髓肽钙螯合物(MP-Ca)的制备及鉴定
以羊骨髓肽(sheep bone marrow peptide,MP)和氯化钙为原料制备MP-Ca。螯合工艺为[8]:MP浓度89.28 mg·mL-1、肽钙质量比2∶1、pH8.1、40 ℃螯合30 min、8倍体积乙醇静置沉淀3 h(乙醇质量分数>95%),8 000 r·min-1离心10 min,沉淀再经真空冷冻干燥(-26 ℃预冻,工作压强90~100 Pa,升华温度45~55 ℃)制得MP-Ca,经测定MP-Ca中的钙含量为(9.05±0.36)%。用傅里叶红外光谱仪在4 000~400 cm-1波段内对样品粉末进行扫描以确定MP-Ca的形成。
1.3 新生大鼠颅骨成骨细胞的分离和纯化
无菌条件下,将出生24 h内的SD大鼠[山西医科大学动物实验中心提供SCXK(晋)2015-0001]脱颈处死,采集颅骨,PBS冲洗后剪碎,0.25%胰蛋白酶-EDTA消化液中消化25 min,收集消化液,组织中添加0.1% Ⅱ型胶原酶继续消化1 h,收集消化液,合并2次消化液,1 500 r·min-1离心5 min,弃上清,用DMEM/F12完全培养基重悬细胞,移至25 cm2的细胞培养瓶,培养箱中培养(37 ℃,5% CO2),培养物每隔0.5 h转至另一培养瓶中,重复2~3次,以除去大部分成纤维细胞而获得原代成骨细胞,待细胞完全贴壁融合后,以0.25%胰蛋白酶溶液消化,传代3次获得纯度高、稳定性好的成骨细胞[9-10]。
1.4 成骨细胞的鉴定
通过细胞形态学观察、茜素红染色及碱性磷酸酶(ALP)细胞化学染色对“1.3”纯化获得的成骨细胞进行鉴定[11-12]。
1.5 成骨细胞生长曲线的绘制及各受试物最佳作用浓度的确定
将生长良好的第三代成骨细胞以1×104个·孔-1的浓度接种于96孔细胞培养板上,每孔含完全培养基100 μL,37 ℃培养至贴壁后每天换液。用CCK-8法绘制生长曲线时,每天取5孔进行测定,连续7 d,测定时弃掉旧培养液,每孔加90 μL新鲜培养液和10 μL CCK-8溶液,避光孵育4 h后用酶标仪测定OD450 nm[13]。确定MP、MP-Ca对成骨细胞增殖的影响时,根据生长曲线,将到达平台期的时间确定为CCK-8法检测时间。确定各受试物的最佳作用浓度时,每孔的接种浓度均为1×104,培养24 h待细胞贴壁后,每天换液时在完全培养基中加入不同浓度的受试物进行培养,在之前确定的检测时间进行检测,OD450 nm最大值所对应的浓度即为每种受试物的最佳作用浓度。
1.6 MP、MP-Ca对成骨细胞增殖的影响
向96孔板内已经贴壁的成骨细胞中加入100 μL 完全培养基(对照组)或含有最佳作用浓度受试物的完全培养基,绘制各组细胞的生长曲线,方法同“1.5”。
1.7 成骨细胞骨钙素(BGP)含量及碱性磷酸酶(ALP)活性测定
将成骨细胞以1×104浓度接种到24孔板上,每个处理组6个重复,贴壁后换用添加了最佳作用浓度MP或MP-Ca的完全培养液,每天换液,培养72 h后用0.1%Triton X-100裂解30~40 min,吸取4 μL细胞裂解液测定总蛋白浓度,其他裂解液1 000 r·min-1离心5 min,取30 μL上清液用于BGP含量和ALP活性的测定,按照ALP试剂盒和大鼠BGP ELISA试剂盒的操作步骤进行。ALP的活性通过总蛋白质浓度标准化,表示为King-Armstrong Unit·g-1。
1.8 统计方法
试验数据采用SPSS 21.0软件处理,结果以“平均值±标准误”表示,折线图、柱状图由SigmaPlot 10.0软件绘制。
2 结 果
2.1 羊骨髓肽钙螯合物(MP-Ca)的鉴定
如图1所示,MP和MP-Ca的红外光谱图波形一致但未完全重叠,吸收峰发生了明显的位移变化。
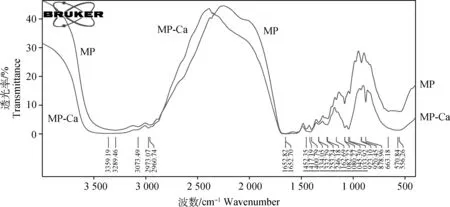
图1 羊骨髓肽(MP)与羊骨髓肽钙螯合物(MP-Ca) 红外光谱图Fig.1 The infrared spectrum of short peptide with MP and MP-Ca
对红外光谱图进一步分析,结果如表1所示,说明钙离子主要与骨髓肽游离氨基端的氨基(-NH2)、游离羧基端的羧基(-COOH)以及肽链内部的羰基(C=O)发生了结合,通过螯合,羊骨髓肽变成了羧酸盐和铵盐。
表1羊骨髓肽与钙离子螯合前后红外光谱分析
Table1Changesofinfraredspectrabeforeandaftercalciumchelatingofbovinebonemarrowoligopeptide

红外吸收峰Infrared absorption peaksMP波数/cm-1Wave number of MPMP-Ca波数/cm-1Wave number of MP-Ca变化Changes原因分析Reasons官能区13 289.463 359.19波数增加,谱带红移并变N-H伸缩振动即-NH2的Functional area宽,螯合成为铵盐伸缩振动(νN-H)23 073.49消失COO-对称振动32 960.742 973.07波数增大,发生蓝移C=O伸缩振动(νC=O)41 651.961 624.58波数减小COO-伸缩振动51 452.35消失COO-对称振动61 400.791 417.19波数增大COO-对称振动指纹区71 162.69消失COO-由伸缩振动变成了变形振动Fingerprint area81 082.43红移,谱带变宽9878.96新增加单键的伸缩振动,变形振动10663.18消失11555.26570.84红移,波数增加
2.2 成骨细胞的鉴定
分离的原代成骨细胞经HE染色后,可见细胞呈短梭形、三角形、多边形、鳞片状、铺路石状等成纤维细胞样形态,符合成骨细胞的特征[11-12],细胞轮廓清晰,细胞质丰富且呈淡红色,细胞核呈卵圆形,大而清晰(图2A)。第三代成骨细胞经碱性磷酸酶染色后,视野内可见大量阳性细胞,细胞膜及细胞质内有大量黑褐色颗粒(图2B);茜素红与钙离子螯合形成可紫红色或红色复合物,第三代成骨细胞经茜素红染色后在细胞表面形成红染的钙化结节(图2C)。
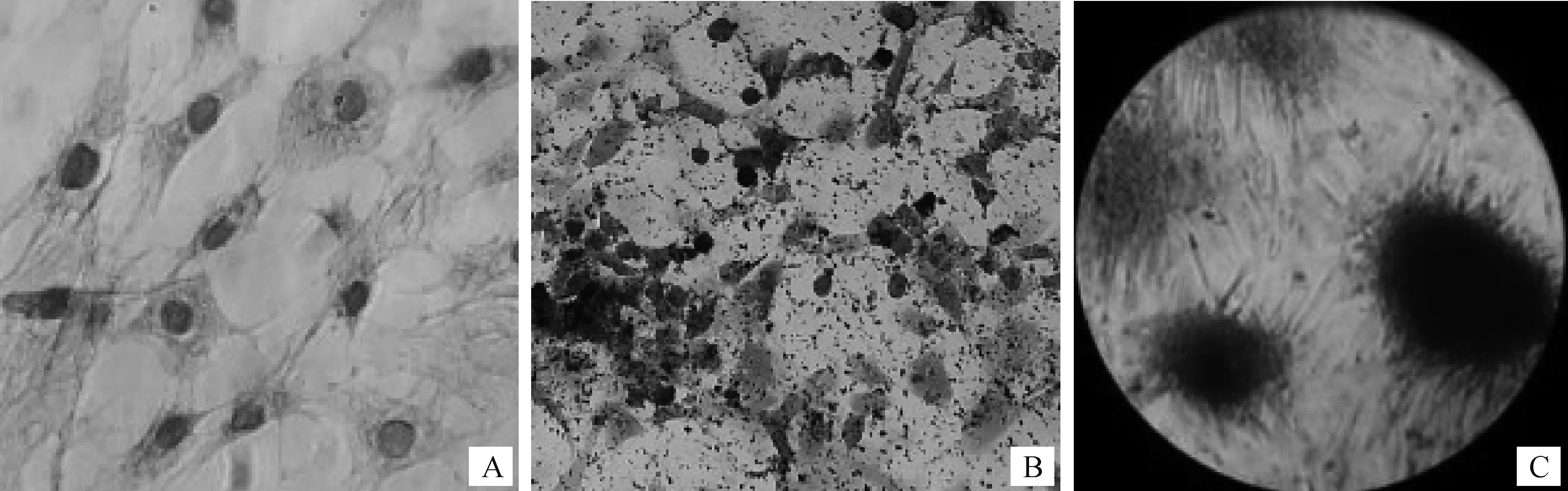
A.经HE染色的原代成骨细胞;B.经碱性磷酸酶(ALP)染色的第三代成骨细胞;C.经茜素红染色的第三代成骨细胞钙化结节A. HE-stained primary cultured osteoblasts; B. Osteoblasts stained by alkaline phosphatase; C. Calcified nodules on the surface of osteoblasts after Alizarin Red staining图2 从新生大鼠颅骨细胞中分离培养的成骨细胞(×100)Fig.2 Identificationof osteoblasts isolated from neonatal rat calvarial cell (×100)
2.3 MP、MP-Ca对成骨细胞增殖活性的影响
由生长曲线(图3A)可知,第三代成骨细胞贴壁后第1天内经过短暂的适应期,第2天便进入指数增殖期,5 d之后进入稳定期,此后细胞数目基本稳定。因此,确定受试物最佳作用浓度时选择OB贴壁后的第5天进行检测。由图3B、C可知完全培养液中添加不同浓度的受试物,第5天检测时,MP、MP-Ca均在103μg·mL-1浓度下OD450 nm值最高,细胞数量最多,故确定此浓度为MP、MP-Ca的最适作用浓度。同理,雌激素最适作用浓度为102μg·mL-1。图3D中的测定结果经方差分析,相同的接种密度,在最适浓度下,雌激素、MP-Ca和MP组的OD450 nm在整个检测期均高于空白组(P<0.05),且MP-Ca组的OD450 nm显著高于MP组(P<0.05),在第4天时,甚至高于雌激素组(P<0.05)。

A.成骨细胞生长曲线;B、C.不同受试物最适浓度的选择;D.不同受试物对成骨细胞增殖情况的影响A. The growth curve of cultured osteoblasts; B, C. Selection of optimal concentration for each treatment group; D. Effects of different treatment groups on the proliferation of osteoblasts图3 各处理组最适浓度的选择及其对成骨细胞增殖情况的影响Fig.3 Selection of optimal concentration for each treatment group and the effect of them on the growth curve of osteoblasts
以上结果说明MP-Ca和MP表现出雌激素样作用,均可促进成骨细胞的增殖,且与MP相比,MP-Ca促进作用更显著(P<0.05)。
2.4 MP、MP-Ca对成骨细胞成骨活性的影响
由图4可知,MP及MP-Ca处理成骨细胞后,细胞裂解液中的ALP活性及BGP含量尽管极显著低于雌激素组(P<0.01),但均极显著高于空白组(P<0.01);且MP-Ca处理组的ALP活性及BGP含量均极显著高于MP处理组(P<0.01)。
3 讨 论
受集约化养殖过程中饲养管理方式、日照、饲料配比、激素和抗生素应用、重金属污染等问题的影响,骨质疏松(osteoporosis,OP)对畜禽健康及动物福利的影响逐渐引起社会关注[6,14-15]。研究表明,OP发生时,机体的抗氧化水平下降,免疫功能下降,肝、肾、甲状腺等组织表现出病理变化[16-17]。过去20年来,抗骨吸收药物一直被作为治疗OP的首选,但由于骨吸收与骨形成紧密相关,在抑制骨吸收时,骨形成的减少也不可避免[18-22],因而促进骨形成的更安全有效的OP防治药物的研发日益受到人们的重视。
动物来源的多肽及其钙螯合物的生物利用度高、安全性好,被证实可促进骨骼生长发育、提高骨密度、恢复骨质疏松大鼠骨骼微观结构,具有OP防治作用,同时还具有促进免疫、抗氧化等功能,广受关注而不断被开发[23-26]。但其对骨质的改善作用的相关研究大都集中效果验证方面,集中在受试物对血液生化指标和骨骼指标的影响方面,对作用机制方面,例如对成骨细胞的增殖和成骨活性的影响报道极少。

大写字母和小写字母分别代表0.01水平和0.05水平差异显著,字母相异表示差异显著,相同表示差异不显著Capital letters and lower case letters present significant level α=0.05, and α=0.01. Different letters indicate statistic differences between the treatments, same letters mean no significant differences图4 各受试物对第三代成骨细胞碱性磷酸酶(ALP)活性及骨钙素(BGP)含量的影响Fig.4 Effect of tested agents on the activity of alkaline phosphatase and BGP content of third generation osteoblasts
作为生物体的主要组成部分,骨组织内始终进行着由成骨细胞介导的骨形成与由破骨细胞介导的骨吸收组成的骨转换过程。OB作为调控骨吸收的中心细胞[5],其增殖分化活动受到抑制是骨质疏松症的主要原因[7]。成骨细胞的数量与活性将直接决定最终的骨形成量[2]。
在骨代谢过程中会产生多种生化标志物,其中碱性磷酸酶(ALP)是参与骨代谢的重要蛋白质,既可代表成骨细胞的早期分化水平,又代表着骨形成。同样,骨钙素(BGP)在成骨细胞分化过程中产生,是骨矿化不可或缺的重要因子[27]。
经红外光谱鉴定,MP与CaCl2发生了螯合,形成了羊骨髓肽羧酸盐和铵盐[28],其螯合部位与其他肽钙螯合物相同[26,29]。MP-Ca和MP均可增强成骨细胞的增殖活性、成骨细胞裂解液中的ALP活性和BGP含量,增强成骨细胞的成骨活性,且同质量浓度MP-Ca的效果优于MP,所以MP-Ca中Ca2+的螯合掺入,不仅可降低MP的用量,还可使效果增强,具体作用机制还有待进一步研究。
4 结 论
体外研究表明,效果虽不及雌激素,MP和MP-Ca均可促进OB的增殖并增强其骨形成活性,且MP-Ca效果优于MP。
