活血化瘀止痛中成药治疗神经根型颈椎病的疗效分析:一项多中心、随机、双盲、安慰剂对照临床研究
2018-12-29陈峰胡建华邱贵兴常晓孙天胜杨惠林沈慧勇童培建柴益民张学利张伟滨杨志东姜宏0潘亚林朱天亮何承建
陈峰胡建华△ 邱贵兴*常晓孙天胜杨惠林沈慧勇童培建柴益民张学利张伟滨杨志东姜宏0潘亚林朱天亮何承建
(1.中国医学科学院北京协和医学院北京协和医院骨科,北京100730;2.中国人民解放军陆军总医院骨科,北京100700;3.苏州大学附属第一医院骨科,江苏苏州215006;4.中山大学孙逸仙纪念医院骨科,广州510120;5.浙江省中医院骨科,杭州310006;6.上海市第六人民医院骨科,上海201306;7.天津市人民医院骨科,天津300121;8.上海交通大学医学院附属瑞金医院骨科,上海200025;9.广州中医药大学第一附属医院骨科,广州510405;10.苏州市中医医院骨科,江苏苏州215008;11.安阳市人民医院骨科,河南安阳455002;12.重庆市人民医院骨科,重庆400013;13.湖北省中医院骨科,武汉430061)
随着人口老年化和生活方式的改变,颈椎病日渐高发,其中神经根型颈椎病约占60%~70%[1],该型颈椎病是由椎间盘退变、突出、节段性不稳定、骨质增生或骨赘形成等原因在椎管内或椎间孔处刺激和压迫颈神经根所致,可严重影响患者生活质量,影响工作能力,严重者可致残,给患者和社会造成沉重的经济负担。
神经根型颈椎病的治疗目前推荐首选非手术治疗[2],若经非手术治疗无效或病情严重的患者需要接受手术治疗。保守治疗主要包括改善不良工作体位与睡眠姿势、颈托制动、牵引、理疗、针灸、药物对症治疗等。药物主要涉及消炎镇痛、活血化瘀、减轻神经水肿和神经营养治疗,但尚无公认的一线首选药物。
在中国,活血化瘀止痛中成药治疗颈椎病的历史由来已久,其中颈舒颗粒被国内很多医院用于颈椎病的治疗,特别是神经根型颈椎病,据不完全统计每年使用量约在150万人次,认为其具有良好的疗效[3-8],但目前尚无RCTs规范化研究来论证其对神经根型颈椎病的确切疗效。本研究联合中国国内13家具有代表性的大中型医院,进行了多中心、随机、双盲、安慰剂对照研究,以证实该活血化瘀止痛中成药的有效性,同时分析其对于压迫性质(软性压迫、软硬混合、硬性压迫)的疗效区别。
1 资料与方法
1.1 研究设计
本研究经伦理委员会批准,自2015年8月至2017年7月,采用多中心、随机、双盲、安慰剂对照的试验设计,按照3∶1的样本比例纳入试验组(口服活血化瘀止痛中成药——颈舒颗粒)360例,对照组(口服安慰剂)120例。受试者按连续4周,每日3次,每次1袋的剂量口服试验药物或安慰剂,分别在服药后第2周和第4周接受访视,以评价试验药物的有效性和安全性。每位受试者均被告知研究目的和可能获益及风险,签署知情同意书。受试者从中国国内13家大中型医院进行招募(北京协和医院、中国人民解放军陆军总医院、苏州大学附属第一医院、中山大学孙逸仙纪念医院、浙江省中医院、上海市第六人民医院、天津市人民医院、上海交通大学医学院附属瑞金医院、广州中医药大学第一附属医院、苏州市中医医院、安阳市人民医院、重庆市人民医院、湖北省中医院)。
1.2 纳入与排除标准
纳入标准:①单纯神经根型颈椎病或以神经根型颈椎病为主的混合颈椎病;②VAS评分≥4分;③年龄18~65岁;④自愿签署知情同意书。排除标准:①患有脊髓型颈椎病者;②由颈椎外病变如胸廓出口综合征、肱骨外上髁炎、腕管综合征、肘管综合征、肩周炎、肱二头肌长头腱鞘炎等所致疼痛者;③神经根型颈椎病有手术适应证者(ⓐ经正规而系统的非手术治疗3~6个月以上无效或非手术治疗虽有效但反复发作且症状严重影响正常生活或工作者,ⓑ由于神经根病损导致所支配的肌肉进行性萎缩者,ⓒ有明显的神经根刺激症状、急性的剧烈疼痛严重影响睡眠与正常生活者);④合并心血管、脑血管、肝、肾、造血系统等严重原发性疾病者;⑤肝肾功能异常(ALT、AST值大于正常值上限3倍,肌酐超过正常值上限者);⑥精神疾病患者,或有酒精、药物滥用病史者;⑦过敏体质及对多种药物过敏者,或已知对本药物成份过敏者;⑧妊娠、准备妊娠(要求终止妊娠者除外)或哺乳期妇女;⑨治疗前1周内曾使用对神经根型颈椎病有治疗作用的药物者;⑩近3个月内参加过其他药物临床试验者;○11其他情况经研究组讨论认为不适宜参加临床试验者。
1.3 随机方法和干预措施
采用分层分区段随机方法:随机数字由统计学专业人员应用SAS软件分析系统产生、并与样本量对等的连续流水编号即药物编号,研究者按受试者入组先后顺序,依次给予相应的药物进行治疗,不得跳号选择药物。该药物编号在整个试验过程中保持不变。
试验药物及安慰剂由国药集团精方(安徽)药业股份有限公司统一生产,规格、批号、用法用量如下:试验组使用颈舒颗粒(含三七、当归、川芎、红花、天麻、肉桂、人工牛黄)口服,每次1袋,每日3次;规格为每袋6 g,批号为150801。对照组使用安慰剂(包装、服用方法、口感与试验组完全一致)口服,每次1袋,每日3次;规格为6 g/袋,批号为S150801。疗程:4周。
采用两级盲法设计,受试者、研究者、分析人员均遮盲。所有数据监察、录入、分析均由无利益冲突的第三方(上海瀛科隆医药开发有限公司)进行操作。
1.4 观察指标
疗效指标:所有患者治疗4周后,主要疗效观察指标为与基线相比,VAS评分改变值(总体疼痛、肩痛、颈痛、肩胛痛),为提高精度,评分范围为0~100分,0分为无痛,100分为最痛;同时,根据神经压迫物性质(软性、软硬混合、硬性)进行亚组分析其治疗疗效。
安全性指标:体格检查、生命体征检查、相关实验室检查(血、尿,肝、肾功能)、12导联心电图检查,报告试验中出现的不良事件。
1.5 统计学方法
采用SAS 9.3软件进行统计学分析。计量资料的统计描述包括例数、均数、标准差、中位数、最大值、最小值、统计量和P值;计数资料的统计描述包括频数分布、构成比、统计量和P值。根据不同的适用条件采用适当的统计分析方法作组内或组间比较。所有统计检验均给出检验统计量及相应P值,用确切概率法时直接给出P值;所有统计检验均采用双侧检验,以P<0.05为有统计学差异(特别说明的除外)。所有患者依次按照全分析集(full analysis set,FAS)、符合方案集(per protocol set,PPS)进行统计分析,安全性分析应用安全性分析集(safety analysis set,SAS)。
2 结果
2.1 一般资料
计划入组480例,试验组360例,对照组120例。实际完成386例,试验组299例,对照组87例。受试者分布流程见图1。总脱落病例33例,试验组23例(包括随机化后撤回知情同意1例),对照组10例;总剔除病例61例,试验组38例,对照组23例。试验组、对照组分别有359例和120例进入FAS集,有299例和91例进入PPS集,有358例和117例进入SAS集。
试验组和对照组在性别占比、年龄、体质指数、合并其他疾病及用药方面无统计学差异(表1)。
2.2 临床疗效
本研究的主要疗效指标为治疗4周时的VAS评分较基线的改变值及变化率。PPS分析结果显示(表2),对照组和试验组基线VAS评分分别为(49.3±7.0)分和(50.1±7.3)分,两组间比较无统计学差异(P>0.05),经过4周治疗,对照组和试验组的VAS评分较基线的下降值分别(12.9±13.5)分和(22.7±15.1)分,变化率分别为26.52%±27.66%和45.71%±30.10%,与基线比较,两组的组内前后差异以及变化率均有统计学意义(P<0.001)。比较两组的VAS评分较基线的下降值以及变化率,两组的VAS评分下降值和变化率的组间差异有统计学意义(P<0.001)。FAS分析结果类似(表3),对照组和试验组的基线VAS评分分别为(48.6±8.4)分和(50.0±7.5)分,两组间比较无统计学差异(P>0.05)。经过4周治疗,对照组和试验组的VAS评分较基线的下降值分别(15.9±16.1)分和(19.8±16.5)分,变化率分别为33.12%±33.06%和39.65%±33.21%,与基线比较,两组的组内前后差异以及变化率均有统计学意义(P<0.001)。两组间的VAS评分下降值和变化率的组间差异有统计学意义(P<0.05)。
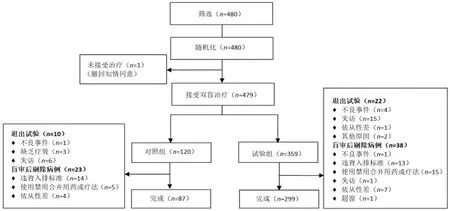
图1 受试者分布流程图
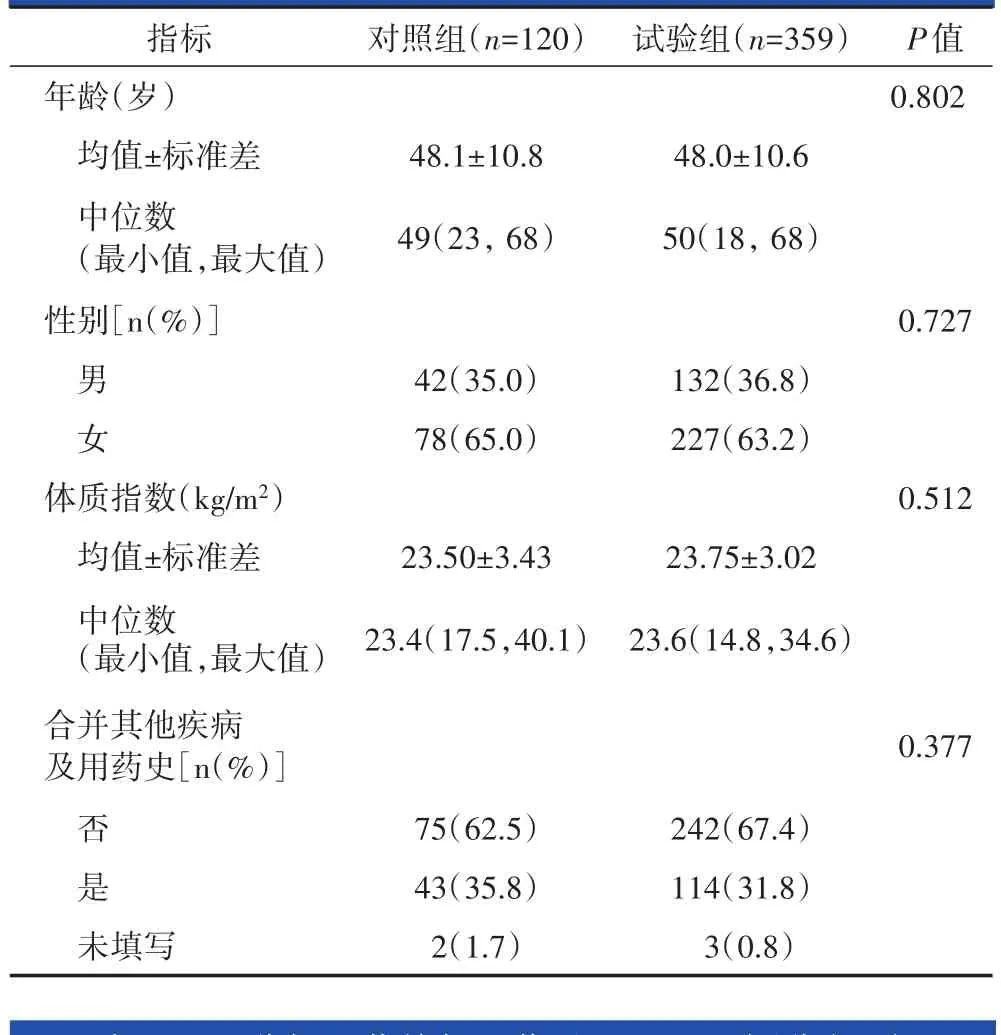
表1 患者一般资料情况表
表2 PPS分析用药前与用药后两组VAS评分( ±s)

表2 PPS分析用药前与用药后两组VAS评分( ±s)
项目基线治疗2周后治疗4周后前后差值比较(分)治疗2周后-基线治疗4周后-基线前后变化率比较(%)治疗2周后-基线治疗4周后-基线对照组(n=91)49.3±7.0 40.4±13.5 36.3±15.0试验组(n=299)50.1±7.3 36.2±14.3 27.3±15.7 P值0.451 8.9±11.4 12.9±13.5 13.9±13.2 22.7±15.1<0.001<0.001 18.57±23.53 26.52±27.66 27.87±26.83 45.71±30.10 0.002<0.001
表3 FAS分析用药前与用药后两组VAS评分( ±s)
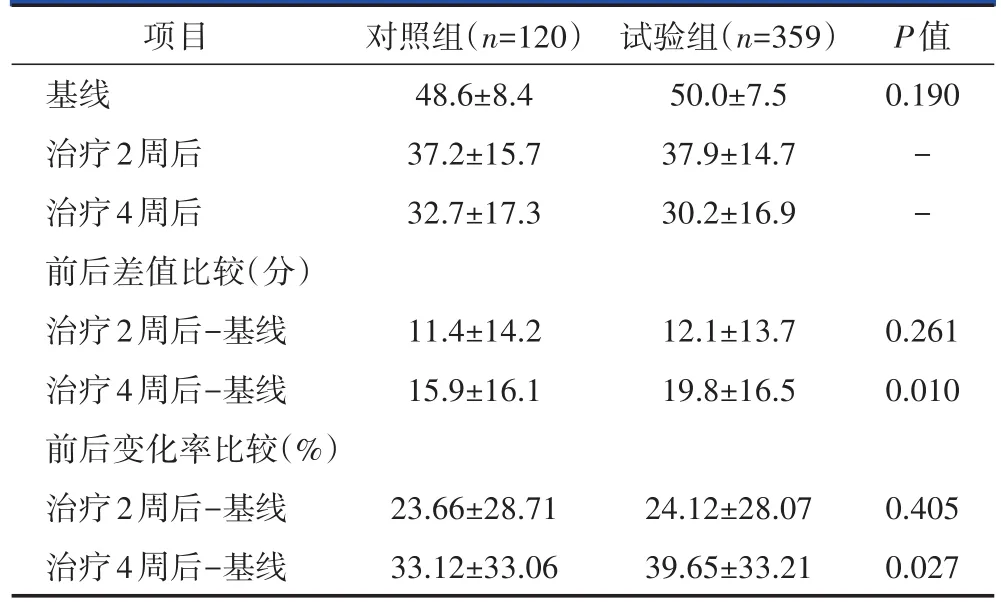
表3 FAS分析用药前与用药后两组VAS评分( ±s)
项目基线治疗2周后治疗4周后前后差值比较(分)治疗2周后-基线治疗4周后-基线前后变化率比较(%)治疗2周后-基线治疗4周后-基线对照组(n=120)48.6±8.4 37.2±15.7 32.7±17.3试验组(n=359)50.0±7.5 37.9±14.7 30.2±16.9 P值0.190--11.4±14.2 15.9±16.1 12.1±13.7 19.8±16.5 0.261 0.010 23.66±28.71 33.12±33.06 24.12±28.07 39.65±33.21 0.405 0.027
2.3 VAS评分亚组分析(软压迫、硬压迫、软硬混合压迫)
根据疾病的不同分型(软压迫、硬压迫、软硬混合压迫),对VAS评分进行亚组分析。FAS集中,对照组有107例软压迫、6例硬压迫、5例软硬混合压迫,试验组有314例软压迫、20例硬压迫、16例软硬混合压迫。PPS集中,对照组有81例软压迫、5例硬压迫、4例软硬混合压迫,试验组有264例软压迫、14例硬压迫、14例软硬混合压迫。
在软压迫、硬压迫以及软硬混合压迫的受试者中两组的基线VAS评分均无统计学差异(P>0.05)。对于软压迫的受试者,试验组VAS评分较基线的下降值以及变化率均大于对照组,组间比较有统计学差异(P<0.05,表4)。对于硬压迫以及软硬混合压迫的受试者,由于病例数相对较少,两组的VAS评分下降值和变化率的组间比较无统计学差异。PPS分析结果与FAS集相似(表5)。
2.4 安全性分析
两组的不良事件、重要不良事件、严重不良事件、不良反应、导致脱落的不良事件、导致脱落的不良反应的发生率的组间比较均无统计学差异(P>0.05)。试验组发生率较高的不良反应为腹泻(6.7%)、上呼吸道病毒感染(5.9%)、头痛(3.9%)、头晕(3.4%)、上呼吸道感染(3.1%)、上腹痛(2.8%),除腹泻发生率稍高于对照组外(P=0.014),其余比较均无统计学差异。
表4 FAS分析用药前与用药后两组VAS评分-软压迫( ±s)
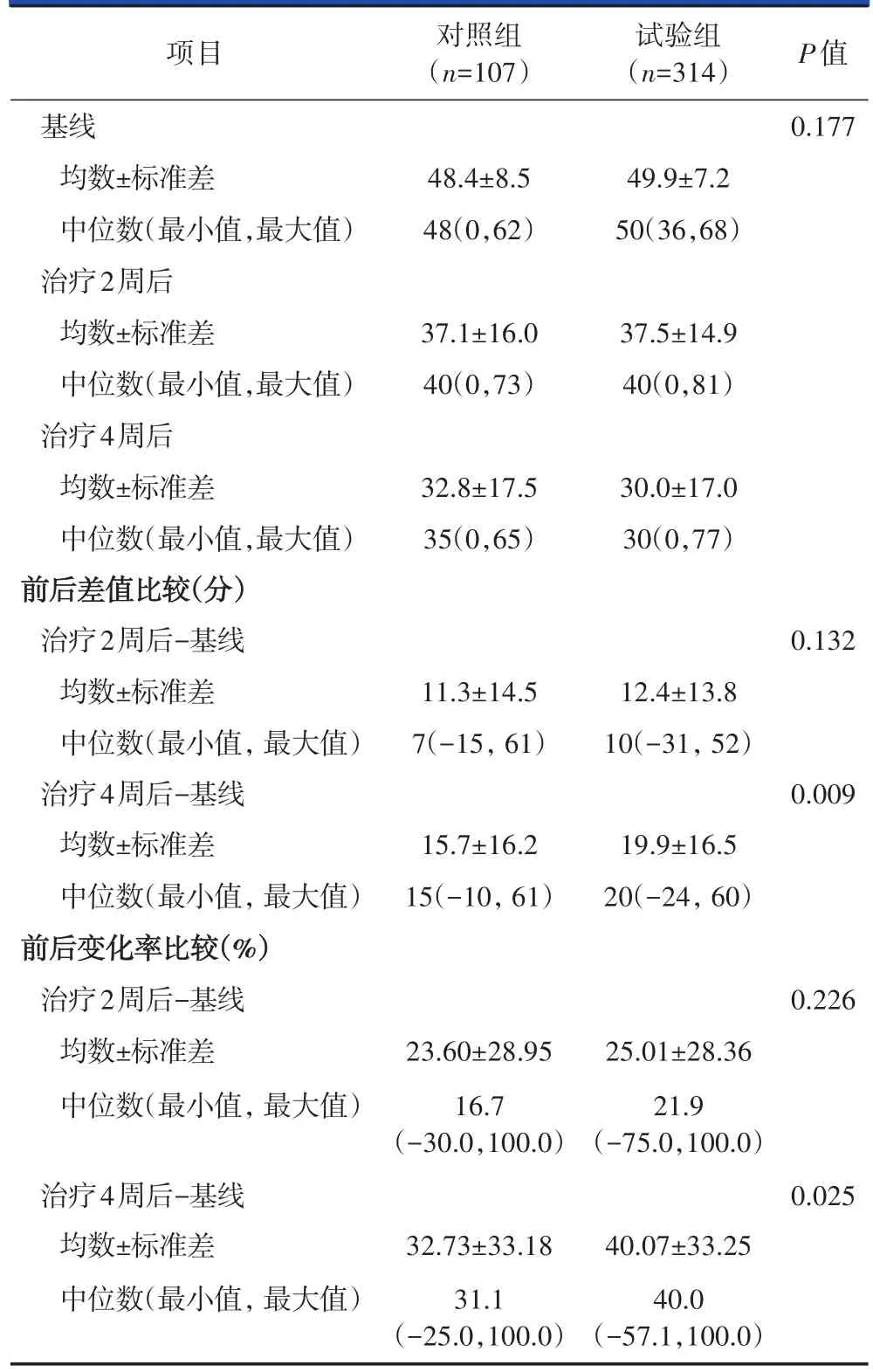
表4 FAS分析用药前与用药后两组VAS评分-软压迫( ±s)
项目基线均数±标准差中位数(最小值,最大值)治疗2周后均数±标准差中位数(最小值,最大值)治疗4周后均数±标准差中位数(最小值,最大值)前后差值比较(分)治疗2周后-基线均数±标准差中位数(最小值,最大值)治疗4周后-基线均数±标准差中位数(最小值,最大值)前后变化率比较(%)治疗2周后-基线均数±标准差中位数(最小值,最大值)对照组(n=107)试验组(n=314)P值0.177 48.4±8.5 48(0,62)49.9±7.2 50(36,68)37.1±16.0 40(0,73)37.5±14.9 40(0,81)32.8±17.5 35(0,65)30.0±17.0 30(0,77)0.132 11.3±14.5 7(-15,61)12.4±13.8 10(-31,52)0.009 15.7±16.2 15(-10,61)19.9±16.5 20(-24,60)0.226 23.60±28.95 16.7(-30.0,100.0)25.01±28.36 21.9(-75.0,100.0)治疗4周后-基线均数±标准差中位数(最小值,最大值)0.025 32.73±33.18 31.1(-25.0,100.0)40.07±33.25 40.0(-57.1,100.0)
表5 PPS分析用药前与用药后两组VAS评分-软压迫( ±s)

表5 PPS分析用药前与用药后两组VAS评分-软压迫( ±s)
项目基线均数±标准差中位数(最小值,最大值)治疗2周后均数±标准差中位数(最小值,最大值)治疗4周后均数±标准差中位数(最小值,最大值)前后差值比较(分)治疗2周后-基线均数±标准差中位数(最小值,最大值)治疗4周后-基线均数±标准差中位数(最小值,最大值)前后变化率比较(%)治疗2周后-基线均数±标准差中位数(最小值,最大值)对照组(n=81)试验组(n=264)P值0.268 49.0±7.0 48(40,60)50.0±7.2 50(40,68)40.1±14.0 41(11,73)35.8±14.6 37(0,72)36.1±15.3 38(5,65)27.1±16.0 26(0,66)0.001 8.8±11.4 6(-15,42)14.2±13.5 11(-30,52)<0.001 12.7±13.6 10(-10,45)22.9±15.3 24(-24,60)0.002 18.73±23.66 13.3(-30.0,73.7)28.57±27.56 25.0(-75.0,100.0)治疗4周后-基线均数±标准差中位数(最小值,最大值)<0.001 26.53±28.36 25.0(-20.0,87.8)46.25±30.62 47.6(-57.1,100.0)
3 讨论
神经根型颈椎病是一种常见的颈椎疾病。据报告,年发病率约为1.79/1000[9]。神经根型颈椎病主要由颈椎退变引起的机械压迫和(或)局部炎性反应引起患者明显不适症状。一般在没有脊髓病或明显功能障碍的情况下,75%~90%的患者可通过非手术治疗获得症状改善[2],抗炎药物及其他辅助治疗是主要手段。临床常用非甾体抗炎药、阿片类药物甚至口服激素类药物来治疗,但常控制欠佳且有较强的不良反应[2,10,11],目前为止尚无公认的首选药物。近年来有较多传统中草药被科学地验证在治疗疾病特别是在肌肉骨骼系统疾病中有效,并逐渐深入研究其有效性及潜在的机制[12-14]。本项多中心、随机、双盲、安慰剂对照研究中试验组所选用的活血化瘀止痛中成药已在国内临床应用数十年,临床疗效良好,本研究结果显示其治疗神经根型颈椎病是有效的,更对其安全性进行了临床科学论证。
本研究4周治疗后的PPS分析结果显示,试验组的VAS评分较基线的下降值达(22.7±15.1)分,变化率为45.71%±30.10%,治疗前后有显著改善,且与对照组变化相比有显著统计学差异(P<0.001),FAS分析结果类似。因此,认为本研究中试验组用药在缓解神经根刺激疼痛方面有效,且在一定程度上可改善患者的颈椎功能和生活质量。
在根据致压物性质进行亚组分析中,试验组用药对于软性压迫物引起的神经根型症状具有显著的缓解效果。软性压迫主要来自于退变突出的椎间盘及纤维环、增生肥厚的后纵韧带及黄韧带等,由于这些组织在解剖上邻近硬脊膜囊和神经根,是颈椎病致病因素中的主要部分,特别在颈椎病症状早期起关键致病作用。且随着时间的延长,这些退变组织可能会逐渐硬化甚至骨化,形成混合型及硬化性压迫,从而导致患者症状持续并加重。本研究纳入的病例以软性压迫居多,结果显示试验组治疗4周后,平均疼痛缓解率达40.07%,与对照组比较有统计学差异。而对于混合型、硬性压迫尚未见统计学差异,原因可能有两方面:一方面本研究纳入的这两类患者的病例数尚少,无法得出更准确的数据结论;另一方面可能硬性压迫者的发病和症状持续时间较长,神经根损害较为严重,短期使用的效果尚不明显,需要更长时间甚至联合其他药物进行治疗方可获得满意疗效。
按照中医药理论,试验组用药以三七为君药、活血化瘀止痛,为骨伤要药;臣药当归补血活血,红花祛瘀生新,川芎为血中之气药,行气活血,三药协同增强三七活血化瘀之功效。佐以肉桂、天麻,因病在骨缝,气血与风寒搏结,非肉桂温阳通脉,不能化瘀散痹,天麻入肝经,善治麻木眩晕,风药人工牛黄,性凉,功能清热开窍,其开窍通络之力,远非芳香通络之品可比,虽其性寒凉,但与肉桂同用,以肉桂之辛温,既可克服牛黄寒凉之弊,又能助其开窍通络功能的发挥,引诸药直达病所,共奏活血化瘀,温经通络之功效。
目前已知,试验组用药主要活性成分为当归、川芎中的阿魏酸和肉桂中的肉桂醛,可通过防止信号传导和转录激活因子3(STAT3)的激活而起到下调炎症介质的作用[15-17]。神经根型颈椎病的疼痛被认为是机械创伤性疼痛与神经病理性疼痛相互混合,有研究认为JAK/STAT3通路在神经病理性疼痛中起重要作用[18-21]。Zheng等[22]报道的该药作用机制的文章,通过结扎大鼠颈椎神经根模拟神经根压迫损伤,应用其治疗后并进一步进行机制研究,发现该药在术后第7日和第14日明显抑制神经根结扎导致的大鼠根性痛和脊髓小胶质细胞的激活,治疗组大鼠的p-STAT3表达明显下降,认为其可减轻机械性神经根性症状。这种镇痛作用可能是通过抑制脊髓小胶质细胞和p-STAT3的激活来实现的,对脊髓疼痛通路中的星形胶质细胞无明显影响。另外,该药对脊髓背角的STAT3磷酸化也有一定的抑制作用,可能通过干扰p-STAT3小胶质细胞通路来减轻神经病理性疼痛,研究显示其可作为治疗神经根型颈椎病难治性疼痛的替代方法。
本研究的安全性分析显示该药未发生严重不良反应及不良事件,报告率略高者主要为轻度腹泻,致泻因素可能是含有人工牛黄,此情况已在药品说明书上标注。大多数患者可通过调整服用时间及调整饮食后缓解,各项随访化验指标无显著性系统损害。张超等[23]在动物中进行了该药的急、慢性毒理学试验,发现动物的一般状态、体质量及血液生化指标均未受明显影响,脏器质量和脏器系数、病理组织学检查等各项指标均无异常改变,提示该药具有较高的安全性。另外,关于该药的各种科学验证也在逐渐开展[24-26],将来可能会进一步提示其活性成分、药代动力学和毒理学。
本研究的局限性是存在一定的剔除率,主要因素是失访,特别是部分患者所住区域偏远、搬家等因素,另一个因素是本研究遵循严格的纳入、排除标准,部分病例因合并用药、依从性差等因素予以排除。
综上,本研究是关于活血化瘀止痛中成药——颈舒颗粒的第一个前瞻性、多中心、随机双盲、安慰剂对照临床研究,结果显示其治疗神经根型颈椎病4周后在缓解疼痛方面有效,特别是对于软性压迫的病例效果良好。
