吡格列酮对肥胖哮喘大鼠气道重塑的影响及与瘦素的关系
2018-12-28陈治宇梁宇佳刘春凤王宋平
陈治宇,邓 俊,梁宇佳,刘春凤,王宋平△
(1.四川省自贡市第四人民医院呼吸内科 643000;2.西南医科大学附属医院呼吸内一科,四川泸州 646000)
随着经济水平提高,肥胖哮喘患病人数明显增加。ULRIK[1]研究发现,肥胖是哮喘的独立危险因素,肥胖哮喘治疗效果不佳,可进展为重症哮喘。肥胖对哮喘的影响除了胸腹脂肪堆积引起的机械效应导致呼吸肌功能紊乱,同时也可以通过内分泌途径分泌大量促炎因子,如瘦素、肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6。研究显示,瘦素可加重哮喘气道炎症[2],但其具体机制不明。吡格列酮是一种胰岛素增敏剂,对肥胖哮喘的气道炎症及重构有一定抑制作用,但机制亦不明确[3]。本研究利用吡格列酮作用于内源性及外源性瘦素干预的大鼠,探讨吡格列酮是否可以通过降低肺组织中瘦素水平从而抑制哮喘的气道重构及炎症病变,为肥胖哮喘的治疗提供一种新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 取3~4周龄雌性SD大鼠40只,体质量(80±5) g,清洁级,由西南医科大学中心实验室提供,饲养于西南医科大学动物房,恒温25 ℃,标准无卵清蛋白饲料,自由摄食和饮水,12 h黑暗交替,实验大鼠适应性喂养1周,1周后采用成组设计方法,将其分为空白组(A组)、肥胖哮喘组(B组)、瘦素+肥胖哮喘组(C组)、吡格列酮+瘦素+肥胖哮喘组(D组),每组10只。
1.1.2 主要实验药物及器材 卵清蛋白(OVA)、氢氧化铝(美国Sigma公司),盐酸吡格列酮片(天津武田药品有限公司),大鼠重组瘦素(美国Prospec公司),60% kcal高脂饮食(美国Research Diets 公司),StepOneTMReal-Time PCR仪(美国Life Technologies公司),大鼠转化生长因子-β1(TGF-β1)酶联免疫吸附试验(ELISA)试剂盒、大鼠基质金属蛋白酶-9(MMP-9)及其组织抑制剂(TIMP-1)ELISA试剂盒(苏州卡文生物科学有限公司),光学显微镜(日本Olympus公司)等。
1.2 方法
1.2.1 肥胖哮喘气道模型建立 参考文献[4]报道的方法,并加以改进制作慢性肥胖哮喘模型。B、C、D组均给予60% kcal高脂饮食喂养8周,共计19周。A组给予普通饲料喂养,自由摄水,人为控制大鼠饮食量,每周称重,B、C、D组大鼠以体质量超过A组大鼠体质量1/3为肥胖标准,第9周起B、C、D组在0、7、14 d腹腔注射0.5 mL生理盐水致敏液[OVA 1 mg和氢氧化铝25 μg]致敏,第21天对B、C、D组大鼠经腹腔注射50 mg/kg戊巴比妥钠麻醉后,经鼻滴入0.2% OVA激发,3次/周,持续8周,实验时间共19周,A组给予相同容积生理盐水致敏和激发,21 d起C、D组每次激发前1 h腹腔注射大鼠重组瘦素1.75 μg·g-1·d-1,溶解于0.5 mL生理盐水中,A、B组给予相同剂量生理盐水注射,D组每次激发前30 min给予吡格列酮10 mg·kg-1·d-1灌胃,A、B、C组给予相同容积生理盐水灌胃。
1.2.2 标本处理和采集 实验大鼠末次激发后24 h,戊巴比妥钠麻醉大鼠,心脏取血3 mL,静置离心后使用生化分析仪测定血糖,打开胸腔,分离气管,结扎左肺门,用冷生理盐水3 mL灌洗右肺,连续3次,每次停留30 s,收集肺泡灌洗液(BALF,回收率大于80%视为成功),以计数白细胞、中性粒细胞、嗜酸性粒细胞数量,离心后取上清液用ELISA测定干扰素γ(IFN-γ)、IL-13、8-异前列腺素F2α(8-iso-PGF2α)、TGF-β1、MMP-9、TIMP-1,取新鲜左肺上叶放入-80 ℃冰箱保存,用于实时荧光定量PCR检测,左肺下叶用4%多聚甲醛固定、常规制备病理石蜡切片,苏木素-伊红(HE)、Masson染色后镜下观察各组肺组织上皮细胞损伤程度及胶原沉积情况,并使用Image-Pro Plus图像分析软件分析并测量气道重塑(气道壁厚度、平滑肌厚度)相关指标。
1.2.3 肺组织中瘦素、脂联素受体、过氧化物酶体增殖物激活受体-γ(PPAR-γ)mRNA的表达 提取大鼠肺组织总RNA,采用PrimeScriptTMRT reagent Kit with gDNA Eraser合成cDNA,在StepOneTMReal-Time PCR仪上使用SYBR®Premix Ex TaqTM试剂盒完成实时荧光定量PCR,反应程序:95 ℃,1 min预变性;95 ℃ 15 s,58 ℃ 20 s,72 ℃ 45 s,40个循环,每个样品均作3个复孔,引物均由武汉金开瑞生物工程有限公司合成。实验后观察PCR熔解曲线确定扩增产物的特异性,引物序列见表1。

表1 实时免疫荧光检测引物序列
2 结 果
2.1 各组大鼠体质量及血糖的变化 实验开始时各组大鼠体质量相当,高脂饮食喂养9周后,B、C、D组较A组小鼠体质量增加,差异有统计学意义(P<0.01),随着喂养时间延长体质量亦增加,造模结束时B、C、D组体质量均较A组增加约1/3,肥胖大鼠造模成功。4组小鼠血糖水平比较,差异有统计学意义(P<0.01),D组血糖(Glu)较C组降低,差异有统计学意义(P<0.01),见表2。
2.2 支气管BALF中细胞计数及肺组织病理改变 C组BALF中白细胞、中性粒细胞计数较A、B组明显升高,差异有统计学意义(P<0.05),见表3。HE染色A组镜检示气道上皮排列较整齐,管腔光滑,未见炎性细胞浸润,B、C、D组气道上皮均可见炎性细胞浸润及气道上皮肿胀、断裂,管腔可见明显黏液分泌,其中C组较B组明显,D组上皮细胞破坏情况较C组有所改善(图1)。Masson染色镜检气道上皮可见A组气管腔光滑,气道上皮有少许胶原沉积,B、C、D组均可见较多胶原沉积,其中C组沉积量最多,D组较C组沉积量有所减少(图2)。

表2 不同组大鼠体质量及Glu水平比较
*:P<0.01,与A组比较;#:P<0.01,与B组比较;△:P<0.01,与C组比较
表3 不同组大鼠支气管BALF中细胞计数
*:P<0.05,与A组比较;#:P<0.05,与B组比较;△:P<0.05,与C组比较
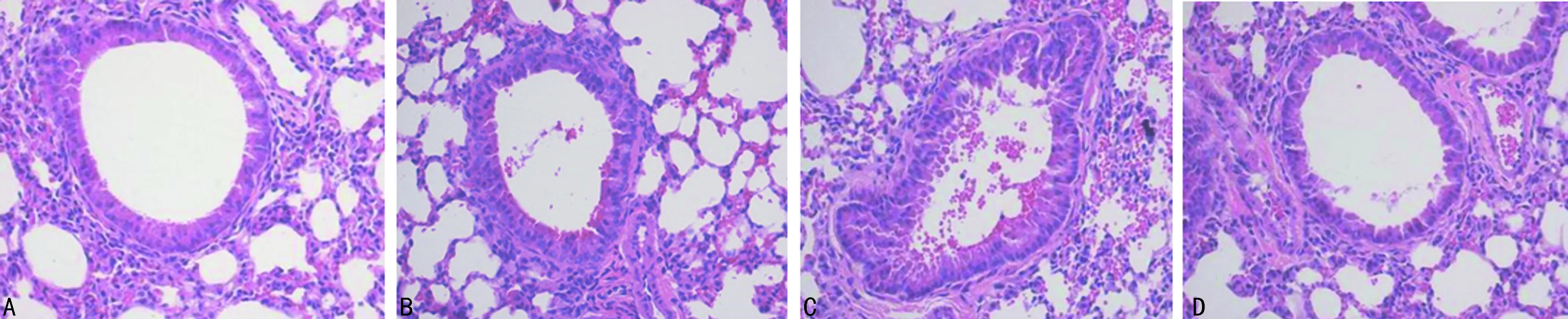
A:A组;B:B组;C:C组;D:D组
图1各组大鼠肺组织HE染色(×100)
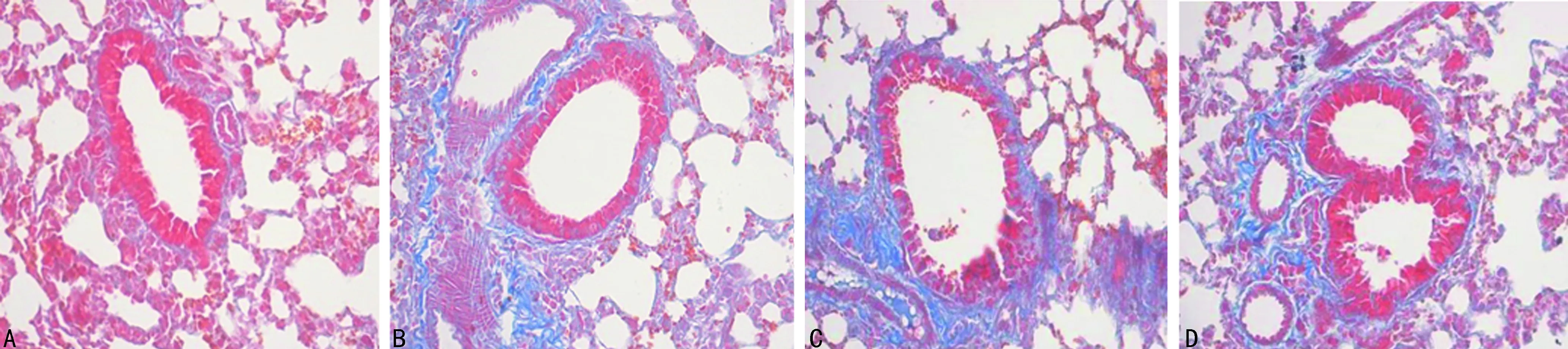
A:A组;B:B组;C:C组;D:D组
图2各组大鼠肺组织Masson染色(×100)
2.3 气道的形态学改变 在大鼠的支气管壁厚度测量中,B、C、D组较A组明显增厚,且C组较B组亦明显增厚,D组经吡格列酮干预后气道壁厚度较C组减小,差异有统计学意义(P<0.05);气管平滑肌厚度变化趋势与支气管壁厚度变化趋势大致相同(P<0.05),见表4。
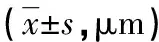
表4 不同组大鼠气道壁厚度及平滑肌厚度比较
*:P<0.05,与A组比较;#:P<0.05,与B组比较;△:P<0.05,与C组比较
2.4 各组大鼠BALF中IFN-γ、IL-13、8-iso-PGF2α、TGF-β1、MMP-9及TIMP-1水平比较 在BALF中,C组IFN-γ、8-iso-PGF2水平较A、B组升高,D组较C组降低,差异均有统计学意义(P<0.05);C组IL-13水平较B组降低,D组经吡格列酮干预IL-13水平升高,差异有统计学意义(P<0.05),见表5。B、C、D组TGF-β1、MMP-9及TIMP-1水平较A组明显升高,C组TGF-β1、MMP-9及TIMP-1水平较B组升高,D组TGF-β1、MMP-9及TIMP-1水平较C组降低,差异有统计学意义(P<0.05),见表6。
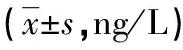
表5 各组大鼠BALF中IFN-γ、IL-13及8-iso-PGF2
*:P<0.05,与A组比较;#:P<0.05,与B组比较;△:P<0.05,与C组比较
2.5 肺组织中瘦素、脂联素受体及PPAR-γ mRNA表达水平比较 瘦素mRNA在C组表达水平最高,明显高于A、B组,D组瘦素mRNA表达水平较C组降低,差异均有统计学意义(P<0.05)。C组脂联素受体1、2的mRNA表达水平均低于B、D组,差异均有统计学意义(P<0.05)。D组PPAR-γ mRNA表达水平较C组升高,差异有统计学意义(P<0.05),见表7。
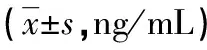
表6 各组大鼠BALF中TGF-β1 、MMP-9及TIMP-1
*:P<0.05,与A组比较;#:P<0.05,与B组比较;△:P<0.05,与C组比较

表7 各组大鼠肺组织瘦素、脂联素受体及PPAR-γ mRNA
*:P<0.05,与A组比较;#:P<0.05,与B组比较;△:P<0.05,与C组比较
3 讨 论
肥胖引起哮喘加重的原因除了胸腹脂肪堆积引起呼吸肌功能障碍的机械性因素,还存在内分泌因素的参与,脂肪组织具有内分泌功能,可分泌瘦素、TNF-α等促炎因子,也可分泌脂联素、PPAR-γ等抗炎因子[5-6]。研究显示,肥胖哮喘急性发作时血清瘦素水平明显升高[7],可以推测肥胖哮喘与体内瘦素水平之间存在一定联系[8]。肥胖哮喘主要以气道黏液分泌过多、气道重塑病变为主,易导致气道受限进行加重,激素治疗不佳。
吡格列酮是PPAR-γ受体激动剂,是胰岛素增敏剂,主要机制是与脂肪细胞PPAR-γ受体结合增加体内组织对胰岛素的敏感性。研究发现PPAR-γ广泛表达于气道上皮细胞、巨噬细胞、T淋巴细胞等,PPAR-γ受体激动剂对哮喘的气道炎症有一定的抑制作用,已知的机制可能参与调解脂联素/丝裂原活化蛋白激酶(Adipo/MAPK)通路,以及与上调Adipo水平及抑制核因子-κB(NF-κB)等因子相关[9-10]。此外,研究发现吡格列酮在血管平滑肌中可抑制瘦素表达,从而抑制血管平滑肌增殖达到抗动脉粥样硬化的作用[11-12]。TGF-β1是一种促纤维化因子,主要促进细胞外基质的产生及抑制其降解,基质金属蛋白酶类(MMPs)是一类可降解细胞外基质的蛋白酶,作用于肺组织中Ⅳ型胶原纤维,而TIMP-1可以抑制MMP-9产生,促进细胞外基质的胶原沉积,促进气道重塑进展,气道中MMP-9、TIMP-1水平升高可提示气道重塑的发生[11]。
本实验利用高脂饮食、OVA建立肥胖哮喘模型,并加用PPAR-γ激动剂吡格列酮干预,实验结果显示,肥胖哮喘组Glu水平明显升高,符合BOLINDER等[12]关于肥胖可引起Glu升高的研究,吡格列酮干预组大鼠Glu有所降低,其中机制可能是吡格列酮通过增加机体对胰岛素的敏感性降低血糖[13],内外源性瘦素共同作用的C组支气管壁及平滑肌厚度,TGF-β1、MMP-9、TIMP-1水平明显高于A、B组,说明肥胖哮喘引起气道重塑可能与瘦素相关,瘦素水平越高,气道重塑程度越严重,与SINGH等[14]研究结果一致;经吡格列酮干预后D组气道上皮破坏程度、气道重塑程度、TGF-β1、MMP-9 、TIMP-1水平较C组降低,且肺组织中PPAR-γ、脂联素受体1、2 mRNA表达水平较C组明显升高,而D组瘦素mRNA表达水平较C组降低,提示吡格列酮可以通过抑制肺组织中瘦素表达及上调脂联素的表达,进而降低肥胖哮喘大鼠气道相关促纤维化及促炎因子水平,达到抑制肥胖哮喘气道重塑及炎症病变的作用。
瘦素是白色脂肪组织分泌的蛋白,被发现广泛表达于气道上皮细胞、Ⅱ型肺泡上皮细胞、巨噬细胞。研究中发现,肥胖哮喘模型中瘦素水平较单纯肥胖组高,单纯肥胖组较空白组瘦素水平升高,表明肥胖促进体内瘦素水平升高,哮喘炎症使肥胖模型组瘦素水平更高[15]。本实验发现,B组中气道重塑及炎症程度较A组明显升高,且瘦素mRNA表达水平升高,说明肥胖哮喘气道重塑和炎症加重与瘦素水平上调相关,与ZHENG等[16]研究结果一致;而在SUTHERLAND[17]的研究中发现,单纯肥胖小鼠体内瘦素水平升高,但气道炎性病变较正常组无明显变化,考虑瘦素不是哮喘的始发因素,而是与哮喘气道炎症相互促进。本研究结果显示,C、B组BALF中炎性细胞以中性粒细胞计数升高为主,可以推测瘦素升高可促进气道内中性粒细胞增加,与普通型哮喘气道内嗜酸性粒细胞为主不同,解释了肥胖哮喘对激素的抵抗作用。IFN-γ由辅助性T淋巴细胞1(Th1)分泌,促使初始T淋巴细胞(Th0)向Th1分化,而IL-13由辅助性T淋巴细胞2(Th2)分泌,有募集气道内嗜酸性粒细胞的作用。LEIRIA等[18]研究显示,普通哮喘气道内主要是Th1/Th2细胞因子调节失衡,以Th2偏移为主;而本次实验中发现,肥胖哮喘大鼠气道内IFN-γ水平明显升高,IL-13水平降低,加用外源性瘦素后更加明显,说明瘦素引起肥胖哮喘模型气道重构与Th1优势表达相关,而吡格列酮干预后可以同时降低IFN-γ、IL-13水平,以IFN-γ水平降低明显,说明吡格列酮可以通过抑制Th1表达,促进Th1/Th2细胞因子平衡,抑制哮喘气道重构及炎症病变。8-iso-PGF2是氧化应激反应重要的细胞因子,本实验发现经吡格列酮干预后,气道内8-iso-PGF2水平和瘦素mRNA水平下降,提示吡格列酮抑制气道内瘦素表达与降低气道内氧化应激水平相关。
综上所述,本实验证实吡格列酮通过上调肥胖哮喘大鼠肺组织中PPAR-γ水平,抑制肺组织中瘦素表达,达到改善肥胖哮喘大鼠气道重塑及气道炎症病变程度的作用,其机制可能是通过降低肥胖哮喘大鼠肺组织中氧化应激水平,改善Th1/Th2细胞因子偏移,降低促肺纤维化因子水平、上调气道内脂联素水平,为肥胖哮喘的药物治疗提供了新的方向。
