流式技术监测急性白血病微小残留病的临床研究
2018-12-28蒋莉梅白晓川
蒋莉梅,马 慧,李 玲,白晓川
(宁夏医科大学总医院血液内科 750004)
现有标准方案已使绝大多数初治急性白血病(acute leukemia,AL)得到缓解。但大部分AL患者疾病复发仍是影响患者长期生存白血病微小残瘤,及预后的主要问题,一旦复发,治疗难度明显增加。复发的根本原因是患者体内存在白血病微小残留病(minimal residual disease,MRD)是指AL患者在经诱导治疗缓解后用骨髓细胞形态学方法难以检测出的体内残留少量白血病细胞的状态[1]。应用流式细胞数(FCM)监测MRD动态变化能更早发现白血病复发迹象,以便及早临床干预,减少复发,改善生存。本研究通过回顾性分析应用FCM动态监测成年AL患者在完全缓解(CR)后不同时间段内MRD的变化情况,探讨此项技术对判断AL患者复发风险、评价其预后及指导个体化治疗的临床意义。
1 资料与方法
1.1一般资料 收集2009年9月30日至2016年6月7日在本院确诊并行化疗达CR的76例监测过MRD的成年AL患者(年龄大于或等于14岁)的临床资料,其中急性髓细胞白血病(AML)患者(非M3)57例,M1型7例,M2型24例,M4型12例,M5型12例,M6型1例,M7型1例;急性淋巴细胞白血病(ALL)患者19例,B-ALL 14例,T-ALL 3例,T/B-ALL 2例。AML患者中男34例,女23例,中位年龄40岁(14~74岁)。ALL患者中男11例,女8例,中位年龄29岁(15~60岁)。诊断标准及疗效评价参照张之南等主编的第三版《血液病诊断及疗效标准》[2]。
1.2治疗方案 确诊患者按照AL的标准化疗方案进行诱导治疗,其中AML多采用以阿糖胞苷为主的吡柔比星+阿糖胞苷(TA)、米托蒽醌+阿糖胞苷(NA)、伊达比星+阿糖胞苷(HA)等方案,ALL多采用以长春瑞滨+地塞米松(VP)为基础的吡柔比星+长春瑞滨+培门冬酶+地塞米松(DVLP)、吡柔比星+长春瑞滨+培门冬酶+环磷酰胺+地塞米松(DVLCP)等方案。强化巩固治疗多使用原诱导缓解方案及大、中剂量阿糖胞苷单药交替化疗。
1.3随访 随访时间自确诊时起,至患者复发、死亡或随访截止期2017年1月31日。失访病例随访至末次就诊时间。定义无进展生存期(RFS),为患者达CR后至其出现复发、死亡或随访截止期。
1.4方法
1.4.1研究方法 搜集76例自2009年10月至2016年6月于本院确诊AL并经诱导治疗达血液学CR后监测过MRD的成人患者资料,对AML及ALL患者在CR后3、6、12及12个月后MRD阳性及阴性组复发率及RFS进行统计学分析。
1.4.2微小残留检测方法 抽取患者CR后不同时间点骨髓液3~4 mL肝素钠抗凝,采用FCM检测(流式细胞仪由美国Becton-Dickinson公司生产),可供选择的单克隆标记方法有6色、8色及10色荧光分析,以CD45/SSC来设门,定义MRD≥1×10-4为阳性,MRD<1×10-4为阴性。
1.5统计学处理 采用SPSS19.0软件分析数据,非正态分布的计量资料用中位数表示;计数资料用百分率(%)表示,比较采用χ2或Fisher确切概率法。生存曲线比较使用Kaplan-Meier法。以P<0.05为差异有统计学意义。
2 结 果
2.1FCM检测MRD与骨髓细胞形态学结果比较
2.1.1两种检测方法检出率的比较 76例AL患者检测MRD同时行骨髓细胞形态学检查。57例AML患者在随访期采用FCM方法内分别检测1~12次,中位检测次数 3次,共检测234例次;其中MRD阳性40例次,阴性194例次,阳性检出率为17.1%;而骨髓形态学检测复发仅5例次,CR结果229例次,复发检出率为2.1%,FCM检测MRD阳性率高于骨髓形态学检测复发检出率(P<0.05)。19例ALL患者在随访期内采用FCM方法分别检测1~9次,中位检测次数2次,共检测57例次;其中MRD阳性17例次,阴性40例次,阳性检出率为29.8%;而骨髓形态学检测复发仅4例次,CR结果53例次,复发率为7.0%,FCM检测MRD阳性率高于骨髓形态学检测复发检出率(P<0.05)。
2.1.2两种检测方法阳性与复发时间比较 骨髓形态学检测复发的5份AML标本中有1份在提前于形态学3个月发现MRD阳性,另外4份同时发现MRD阳性。骨髓形态学检测复发的4份ALL标本中有1份在提前于形态学1个月发现MRD阳性,另外3份同时发现MRD阳性。
2.2不同治疗阶段MRD与复发及无复发生存时间关系
2.2.1AML患者
2.2.1.1AML患者首次CR后3个月 此阶段33份标本,MRD阳性组7例,6例均在3个月内复发,1例未复发;MRD阴性组26例,复发5例,其中仅1例在MRD阴性后6个月复发;4例分别在MRD阴性后7~13个月复发。MRD阳性组复发率高于MRD阴性组(P<0.05)。MRD阳性组及MRD阴性组的中位RFS分别为1.0个月(0~12个月)、13.5个月(3~37个月),差异有统计学意义(P<0.05),见图1。

图1 AML患者首次CR后3个月MRD阴性及MRD阳性组的生存曲线图
2.2.1.2AML患者首次CR后6个月 此阶段24份标本均为MRD阴性,复发6例,分别在MRD阴性后4~15个月复发,中位RFS为29.0个月(3~36个月)。
2.2.1.3AML患者首次CR 后12个月 此阶段35份标本,MRD阳性5例,复发2例,分别在MRD阳性后1、10个月复发;MRD阴性30例,复发7例,分别在MRD阴性后1、3、4、5、6、12、15个月复发。两组复发率差异无统计学意义(P=0.586)。MRD阳性组及阴性组的中位RFS分别为5.0个月(4~10个月)、25.0个月(1~35个月),两组差异有统计学意义(P<0.05),见图2。

图2 AML患者首次CR后12个月MRD阴性及MRD
2.2.1.4AML患者首次CR 12个月后 此阶段142份标本,MRD阳性29例,复发12例(其中10例在MRD阳性后6个月内复发,仅2例分别在MRD阳性后7、21个月复发);MRD阴性组113例,复发23例(其中仅4例在MRD阴性后6个月内复发;19例分别在MRD阴性后7~36个月复发)。MRD阳性组复发率高于MRD阴性组(P=0.019)。阳性组及阴性组的中位RFS分别为5.0个月(0~24个月)、13.0个月(1~45个月),两组差异有统计学意义(P<0.05),见图3。

图3 AML患者首次CR 12个月后MRD阴性及MRD阳性组的生存曲线图
2.2.2ALL患者
2.2.2.1ALL患者首次CR后 3个月 此阶段9份标本,MRD阳性4 例,其中3例分别在MRD阳性后7个月内复发,1例未复发;MRD阴性5例,仅1例在MRD阴性后5个月复发。两组复发率差异无统计学意义(P=0.206)。MRD阳性组及MRD阴性组的中位RFS分别为4.5个月(0~10个月)、8.0个月(5~16个月),两组差异有统计学意义(P<0.05),见图4。

图4 ALL患者首次CR后3个月MRD阴性及MRD阳性组的生存曲线图
2.2.2.2ALL患者首次CR后6个月 此阶段9份标本,MRD阳性4例,其中2例在MRD阳性后2个月内复发;MRD阴性组5例,仅1例在MRD阴性后4月内复发。两组复发率差异无统计学意义(P=0.524)。MRD阳性组及MRD阴性组的中位RFS分别为3.0个月(0~5个月)、24.0个月(3~27个月),两组差异有统计学意义(P<0.05),见图5。
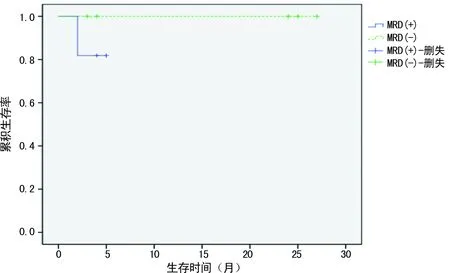
图5 ALL患者首次CR后6个月MRD阴性及MRD阳性组的生存曲线图
2.2.2.3ALL患者首次CR后12个月 此阶段11份标本,MRD阳性4例,其中3例分别在MRD阳性后2个月内复发;MRD阴性7例,均未复发。MRD阳性组复发率高于MRD阴性组(P=0.024)。MRD阳性组及阴性组的中位RFS分别为1.5个月(0~3个月)、10.0个月(3~25个月),两组差异有统计学意义(P<0.05),见图6。
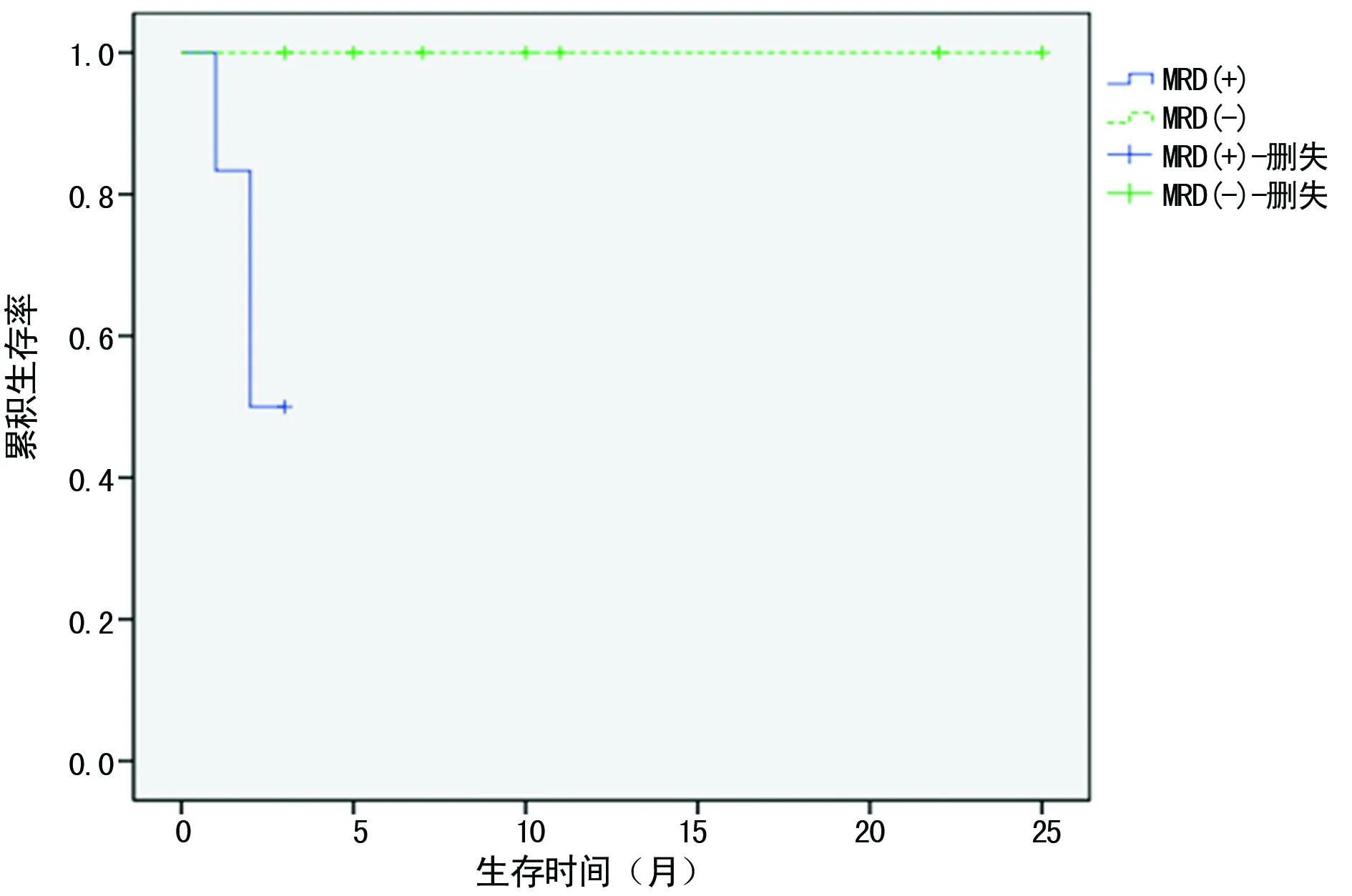
图6 ALL患者首次CR后12个月MRD阴性及阳性组的生存曲线图
2.2.2.4ALL患者首次CR 12月个后 此阶段29份标本,MRD阳性6例,均在MRD阳性后15个月内复发;MRD阴性23例,仅3例分别在MRD阴性后5~11个月复发。MRD阳性组复发率高于阴性组(P<0.05)。MRD阳性组及MRD阴性组的RFS分别为10.0个月(0~15个月)、14.0个月(1~24个月),两组差异有统计学意义(P<0.05),见图7。

图7 ALL患者首次CR 12个月后MRD阴性及MRD阳性组的生存曲线图
2.3动态检测MRD与治疗转归 57例AML患者检测出MRD的中位间隔时间为3个月(1~27个月)。其中11例在骨髓形态学复发前出现MRD阳性,中位提前时间为2个月(1~22个月)。7例MRD阳性后,经加强治疗MRD转阴,但部分出现交替转阳。19例ALL患者检测出MRD的中位间隔时间为3个月(1~10个月)。其中有3例在形态学复发前出现MRD阳性,中位提前时间为3个月(1~6个月)。
3 讨 论
已有研究显示CR后MRD监测结果是 AL无病生存的独立预后因素[3-5]。本研究分析了本院76例AL患者在首次CR后3、6、12及12个月后的4个阶段MRD结果,显示MRD阳性组患者的中位RFS较MRD阴性组缩短;且相应阶段MRD阳性组生存率较MRD阴性组低,但两组的复发率并非在各阶段都有显著性差异。可能受病例数较少;检测MRD的时间点及间隔时间无统一规范;部分患者的随访时间较短,随访期内尚无复发迹象;取材、操作误差等因素影响。而首次CR后3个月及12个月后MRD阳性患者的复发相对更多,前者可能提示患者体内白血病细胞存在原发耐药克隆;而后者多次化疗后仍然检出MRD阴性,提示存在白血病细胞继发耐药。目前相关研究相对较少,MARSHALL等[6]通过临床研究,认为第1、12、24个月时MRD高水平提示复发意义更大,与本研究基本一致。
本研究还显示,FCM检测AL患者MRD阳性率较形态学检测复发率高,多数患者在骨髓形态学复发前即可发现MRD阳性,说明FCM的灵敏度更高,能更早发现AL复发迹象,以便及早采取对策。这与国内外的研究结果基本一致。
有关MRD检测时间点及时间间隔,目前尚不统一,但普遍认为在AL诱导缓解及巩固治疗后的时间段内检测对判断预后意义更大,时间间隔建议是每3个月检测1次[7-8]。有关检测MRD的时间间隔,或许根据不同时间段MRD的具体值及变化趋势来制定,可能对指导患者的后续治疗更有帮助。
有关FCM检测MRD的阳性阈值,众多研究之间差异较大,从7.5×10-5~1.0×10-2不等,但大多采用的是0.01% 作为 MRD 阳性阈值[9-11]。本研究也是以1×10-4为MRD阳性阈值。此外,单次MRD阳性的患者在随访期内并非都出现骨髓形态学复发,而连续数次MRD阳性患者更容易出现骨髓形态学复发;且多次MRD阳性的患者如出现单次MRD阴性则仍需后续的监测。只有连续动态监测MRD水平的变化才能对AL患者的复发及预后判断提供可靠的临床依据。此外,部分患者MRD的检测结果是交替变化的,提示随着治疗的更改,MRD的检测结果可出现一定程度的变动,所以将FCM检测MRD结果作为判断治疗效果的惟一指标尚不可取。有条件者应当借助更为灵敏的检测方法如分子学、基因测序等查找MRD。已有文献提出增加AL患者缓解及治愈的分子学诊断标准[12-13]。
综上,FCM动态监测MRD对判断AL患者的复发、预后及指导个体化治疗有较大的临床价值。但目前MRD检测时间、间隔时间及阳性阈值等尚无统一标准。此外,提高检测灵敏度也是亟待解决的问题之一。
