冠心病患者舌苔菌群结构特点及不同舌苔的菌群结构研究*
2018-12-28陈炜玮林新富黄昉萌骆杰伟吴永希魏世超郑星宇
陈炜玮,林新富,杨 笑,黄昉萌,骆杰伟,吴永希,魏世超,郑星宇**
(1.福建医科大学省立临床医学院 福州 350001;2.福建省立医院中医科 福州 350001;3.福建卫生职业技术学院护理系外科护理学教研室 福州 350101;4.福建省立医院儿科 福州 350001)
2007 年美国国立卫生研究院(National Institutes of Health,NIH)为了揭示微生物与人体疾病之间的联系,启动了人类微生物组计划(Human Microbiome Project,HMP)[1-2]。NIH牙颅颌面研究所(National Institute of Dental and Craniofacial Research,NIDCR)在2008年启动了人体口腔微生物组数据库(Human Oral Microbiome Catabase,HOMD)计划[3]。HOMD的主要目标是提供数百种人体口腔原核生物物种群落的全面信息。2015年再次启动了“全民个体微生物组检测项目”,旨在以口腔、皮肤及肠道微生物群落为主要研究靶点,将“人类微生物组计划”的研究结果进行临床转化,从“第二基因组”中寻找更加精准的疾病预警分子标记。而因胃气的强弱不同、感受邪气的寒热不同,形成了多样的病理性舌苔[4]。本研究收集冠心病患者与健康对照者的舌苔标本,进行舌苔菌群16S rDNA的V4区域的高通量测序[5,6],将现代测序技术与传统中医辨证相结合,探索不同中医证型菌群的奥秘之处。
1 材料与方法
1.1 诊断标准
参照1979年WHO制定的《缺血性心脏病的命名及诊断标准》[7]、2014年美国心脏病学会/美国心脏病学院《非ST段抬高型急性冠脉综合征诊治指南》、2015年《中国急性ST段抬高型心肌梗死诊断和治疗指南》,包括:稳定型心绞痛、急性冠脉综合征(包括不稳定型心绞痛、非ST段抬高型心肌梗死、ST段抬高型心肌梗死)、陈旧性心肌梗死。舌苔分级:(1)薄白苔(white thin coating,WTC):苔色白,苔质薄,透过舌苔能隐隐见到苔质,舌苔润泽有津,舌色淡红,即“淡红舌,薄白苔”。(2)黄厚苔(yellow thick coating,YTC):苔色淡黄或黄,苔质较厚(即不能透过舌苔见到舌质),或部分舌面见厚苔,仅少部分舌面见薄苔,苔质干或不干,舌色淡红或红。(3)很黄厚苔(extremely yellow thick coating,EYTC):苔色黄,苔质厚或极厚,全舌面见厚苔,苔质干,舌色红或绛红。舌象诊断参照《中医诊断学》[8]。每一个舌像均由固定的2位福建省立医院中医科副主任及以上医师判定,并照相保存。
1.2 纳入与排除标准
纳入标准:经福建省立医院医学伦理学委员会批准,签订知情同意书。符合稳定型心绞痛、急性冠脉综合征、陈旧性心肌梗死标准患者。排除标准:排除3个月内使用抗生素治疗者;排除患有糖尿病、血液病、心力衰竭、肾衰等重要疾病者;排除有肝炎、结核病等传染性疾病者;排除不能进行正常交流及合作者;排除有口腔颌面部肿瘤患者;排除有放、化疗史者;排除有长期饮酒史者;排除有长期吸烟史者。
1.3 一般资料
共收集2015年12月至2016年3月于福建省立医院就诊且符合纳入标准和排除标准的冠心病患者70例,平均年龄为64.64±7.27岁,其中男性40例,女性30例,薄白苔15例(男11例,女4例),黄厚苔33例(男17例,女16例),很黄厚苔22例(男12例,女10例)。收集同期来自福建省立医院体检中心的体检人群中健康人组28例作为对照,健康对照组平均年龄为64.13±5.23岁,其中男性15例,女性13例,薄白苔28例。组间年龄、性别无显著差异(P>0.05)。
1.4 方法
1.4.1 舌苔样本取备、DNA提取
舌苔取样按照HMP手册流程(Manual of Procedures for Human Microbiome Project,Version 12.0(Accession:phd003190.2))。DNA提取严格按照QIAamp® DNA Mini Kit操作说明书进行。采用16s rRNA通用引物515F/806R(515F:XXXXXGTGCCAGCMGCCGCGGTAA,806R:XXXXXGGACTACVVGGGTATCTAATC)对提取的DNA样品进行PCR扩增。XXXXX:每组内标签序列,用于不同组别、不同样品的区分。
1.4.2 16s rRNA基因V4区测序
PCR扩增和产物纯化后,文库质检合格后,使用Ion Plus Fragment Library Kit进行文库定量,并根据每个样品的数据量要求,进行相应比例的混合均一化。用16S特定引物扩增特异可变区V4区域,得到300bp左右扩增片段。采用Ion PGM™System测序,对照组28个样品采用两个Ion 314™C hip K it v2芯片,其余样品采用一个Ion 318™Chip Kit v2芯片。
1.4.3 OTU聚类
将序列完全一样的Clean Reads按其丰度大小排序。过滤掉其中的Singletons(singletons为对应read只有一条的序列,疑因测序错误所致,为减少误差,将这部分序列去除,不进入后期OTU聚类)。再将所有的序列用vsearch分析软件去嵌合体,按相似度0.97进行OTU(Operational Taxonomic Units)聚类,对聚类后的OTU进行筛选,只保留大于两条的OTU(类似与之前的singletons筛选)。将丰度大于2的OTU代表序列用rdp-classifier进行物种注释,得到物种丰度表。统计各样本中各OTU的丰度信息,将各个OTU中丰度最高的一条序列挑选出来,作为该OTU的代表序列。使用RDP方法,将该代表序列与已知物种的16S数据库进行比对,从而对每个OTU进行物种归类。
1.4.4 显著性差异分析
在两组样本中采用Kruskal-Wallis秩和检验检测不同组间丰度差异显著的物种;再用成组的Wilcoxon秩和检验,对在上一步中获得的显著差异物种进行组间差异分析;最后用线性判别分析(LDA)对数据降维和评估具有显著差异的物种的影响力,即LDA score(差异菌群判定标准为LDAscore大于3,P值小于0.01)。用R语言软件进行treeplot构建,进行舌苔菌群类型分析。
2 结果
2.1 OTU与物种注释分析
统计出来的OTU的丰度初步说明了样品的物种丰富程度。采用cutadapt配合python脚本的方法进行拆分,并统计每个样品的测序条数,使用卡方检验分析两组间reads,冠心病reads中位数21969.50(17468.75-33261.00)多于对照组中位数16753.00(13326.25-24492.25),具有统计学意义(Z值=-2.253,P=0.024)。本实验共得到10506个不同的OTU,找出两组间有显著差异的OTU有1068个(P<0.05)。物种注释分析将1068个差异OTU(P<0.05)与已知物种的16S数据库进行比对。根据物种注释结果,在门水平得到16个物种,纲水平得到31个物种,目水平得到51个物种,科水平得到86个物种,属水平得到160个物种。本实验中在属水平上找出有差异的物种84个(P<0.05)。

表1 2组有显著作用的微生物类群(线性回归分析,LDA)
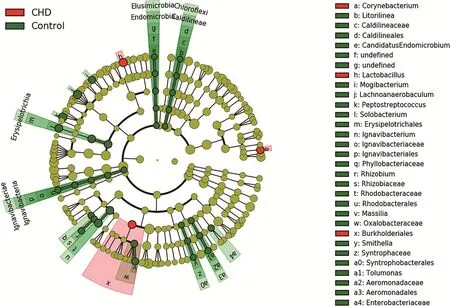
图1 LDA effectsize进化分支图
2.2 LDAEffectSize(LEfSe)
分析采用线性判别分析(LDA)来估算每个组分(物种)丰度对差异效果影响的大小,找出对样品划分产生显著性差异影响的群落或物种[9]。本实验组间有差异物种,见表1。LDA effectsize进化分支图,见图1。分析可以看出,冠心病优势菌属有棒状杆菌属(Corynebacterium)、布克氏菌属(Burkholderialles)、乳酸菌属(Lactobacillus);对照组优势菌属有消化链球菌属(Peptostreptococcus)、lachnoanaerobaculum、红细菌目(rhodobacterales)、红杆菌科(rhodobacteraceae)。
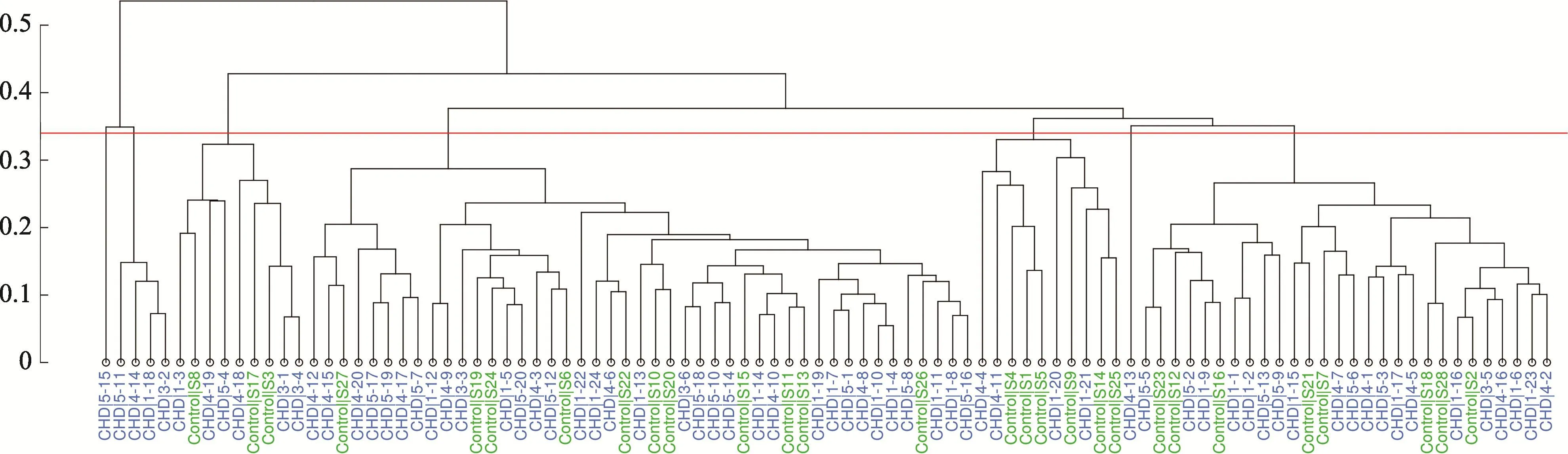
图2 属水平上的treeplot构建
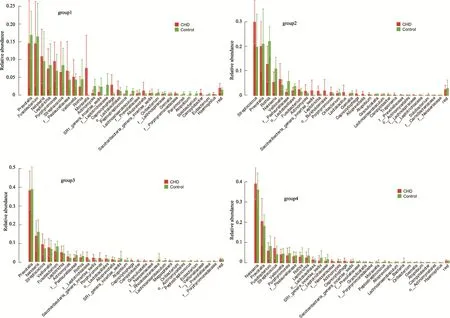
图3 4组group的冠心病组与对照组菌群占比分布图
2.3 舌苔菌群类型分析
对样品进行聚类为四大类(图2)。group1的优势菌属是链球菌属(Streptococcus),group2的优势菌属是普雷沃氏菌属(Prevotella),group3的优势菌属是梭杆菌属(Fusobacterium),group4的优势菌属是奈瑟菌属(Neisseria)。四种group特点(图3)。group1中普雷沃氏菌属、梭杆菌属、奈瑟菌属在CHD组、对照组占比均分列前三。group2中,CHD组的呈优势占比的菌属依次为链球菌属、普雷沃氏菌属和罗氏菌属(Rothia);对照组为罗氏菌属、普雷沃氏菌属、链球菌属。group3中,CHD组占比优势菌属分别为普雷沃氏菌属、奈瑟菌属、链球菌属;对照组则为普雷沃氏菌属、奈瑟菌属、梭杆菌属。group4的CHD组占比优势菌属依次为奈瑟菌属、普雷沃氏菌属、链球菌属;对照组则为奈瑟菌属、普雷沃氏菌属、梭杆菌属。
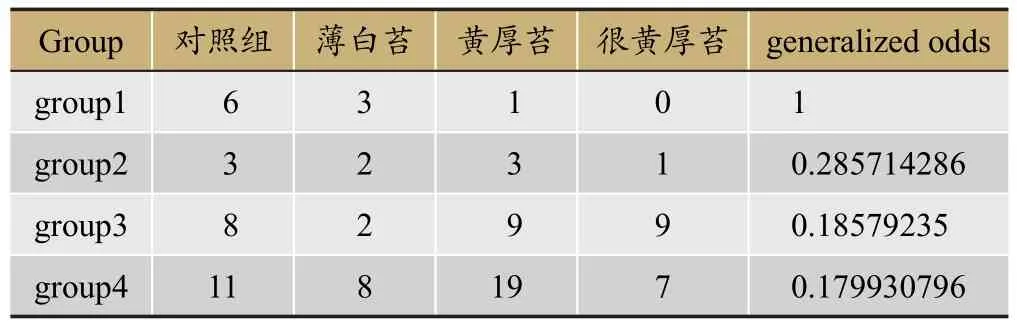
表3 各group舌苔情况预测
2.4 菌群分型风险预测
各组患冠心病风险预测(表2)。以group1为参照,group2、3、4患冠心病的风险递增。而罹患冠心病风险较高的group2,group3,group4又在菌群特征上有明显不同,提示冠心病可能存在特定的菌群结构。各group舌苔情况预测,见表3。以group1为参照,group2、3、4患薄白、黄厚、很黄厚舌苔递增关系。
2.5 RDA分析
冗余分析(redundancy analysis,RDA)主要用来反映菌群与环境因子之间的关系,见图4。group3与hs-CRP、IL-6、IL-8等炎症指标密切相关。
3 讨论
《舌鉴总论》中云:“舌为心之外候,苔为胃之明证,察舌可占正之盛衰,验苔以识邪之出入”。舌苔是由脾胃之气上熏,胃津上潮,凝聚于舌面而成。若胃气夹邪气上泛于舌,就会形成病理性舌苔。口腔微生物组与牙周疾病、心血管疾病之间的联系一直倍受关注。口腔菌群的失衡会启动或加剧动脉硬化过程[10]。泡沫细胞形成是动脉硬化初始关键步骤,低密度脂蛋白(LDL)与牙龈卟啉菌的特异性蛋白结合,聚集的LDL可诱导鼠巨噬细胞形成泡沫细胞[11]。此外,在动脉粥样斑块中找到韦荣菌、普雷沃氏菌、牙龈卟啉单胞菌、梭杆菌、华丽单胞菌属等的报道[12,13]。斑块中韦荣球菌属、链球菌属丰度与在口腔中的丰度相关,并且细菌与白细胞、血浆胆固醇水平相关[14]。牙齿的独特结构可以促进细菌生物膜的沉积,细菌生物膜在牙龈边缘处的过度积累会引起炎症。微生物内环境失稳会促进病原体毒力因子表达,如牙龈卟啉单胞菌可致龋齿或牙周炎等发生或加剧[15]。龋病、牙周病等常见口腔疾病患病率的升高,增加了人群罹患动脉粥样硬化、冠心病等的风险[16,17]。Mattila等研究发现,急性心肌梗死患者的牙周健康状况明显差于健康组,多存在慢性牙周炎、龋坏、慢性根尖周炎、冠周炎等[18]。一项有关CHD与牙周炎相关性的Meta分析结果显示牙周炎是独立于传统CHD危险因素的一种危险标记,相对危险度为1.24-1.35[19]。
牙周致病菌多为能产生脂多糖(LPS)的革兰阴性菌,可导致牙周组织局部炎症,并形成牙龈的溃疡和局部血管化[20]。牙龈致病菌可通过炎症的牙周组织进入血液,刺激内皮细胞表达各种致炎因子,包括单核细胞趋化蛋白(MCP-1)、细胞间黏附分子(ICAM-1)、血管细胞黏附分子(VCAM-1)、E选择素等,引起动脉炎症,参与动脉粥样硬化。此外,粥样硬化斑块形成后,牙周致病菌还能通过诱导基质金属蛋白酶(MMP)表达,降低MMP组织抑制物表达,参与斑块破裂[21]。血管平滑肌细胞感染牙龈卟啉单胞菌后,可致组织因子和纤溶酶原激活物等因子失调,导致高凝、血栓形成[22,23]。牙周致病菌及脂多糖等代谢产物在诱导局部炎症和组织破坏的同时,还不断刺激宿主,产生系统性炎症与免疫反应,导致CRP、TNF-α、IL-113、IL-6等炎性因子上调[23,24]。另外,与消化道菌群代谢产物氧化三甲胺(TMAO)有关,TMAO会抑制血液中胆固醇的降解,进一步促进动脉粥样硬化发展[25]。
本研究发现group 1、2、3、4的优势菌属分别是Streptococcus、 Prevotella、 Fusobacterium、 Neisseria。Streptococcus为革兰阳性菌,为口腔正常定植菌,为健康人及口臭者口腔中的优势菌群,与口臭等口腔症状密切相关[26];prevotella是革兰阴性专性厌氧菌,其可能为牙周疾病的主要可疑致病菌[27]。Neisseria是寄生在人体呼吸道的的条件致病菌属,与牙菌斑生物膜形成有关,牙菌斑生物膜过量沉积会诱发牙周炎[28]。此外,梭杆菌、链球菌和奈瑟菌丰度与动脉粥样硬化的危险信号如血浆胆固醇水平相关。分析发现group3与hs-CRP、IL-6、IL-8等炎症指标有较显著的相关性。Fusobacterium是临床常见的革兰阴性无芽胞厌氧杆菌,主要存在于口腔牙垢中,可致人的严重感染,如菌血症等[29]。具核梭杆菌(F.nucleatum)存在于牙龈下斑块中,是慢性牙周炎重要的感知生物体,其可以诱导外周嗜中性粒细胞的促炎细胞因子(IL-1β,TNF-α,IL-8)等的产生,参与慢性牙周炎炎症反应[30]。
本研究通过OR值分析出舌苔菌群结构与患冠心病风险相关,并影响着舌苔变化。有研究认为,冠心病舌色、苔色、舌形、舌苔厚度、瘀斑瘀点5类观察值在各中医证型有明显差别[31]。冠心病不同亚型的舌苔也存在着差异性,隐匿型冠心病患者舌苔多为薄白苔,冠心病心绞痛患者舌苔改变以腻苔和少苔或无苔为主。其中不稳定型冠心病心绞痛患者出现腻苔的几率较稳定型心绞痛患者高,且随着病情的好转,其舌苔逐渐转为正常[32]。而且冠心病患者舌象的动态变化可以反映病情进展,预示冠心病的预后情况。如急性心肌梗塞时舌苔有明显的由薄变厚、再由厚变薄的变化趋势[33]。可见疾病特有的舌苔菌群结构,使其发挥“疾病预警”的功能,将会为疾病防治提供新的靶点和思路。
