宁波舟山港域内5种病毒监测与遗传进化特征分析
2018-12-28沈飚黄雷叶凌胡兴娟滕跃王忠发张杰
沈飚黄雷叶凌胡兴娟*滕跃王忠发张杰
1.舟山出入境检验检疫局综合技术服务中心 浙江舟山 316000;2舟山市岱山县疾病预防控制中心
发热伴血小板减少综合征 (Severe Fever with Thrombocytopenia Syndrome,SFTS)是由新型布尼亚病毒也称发热伴血小板减少综合征病毒(SFTSV)感染所致的新发传染病,SFTSV广泛分布于中国中东部、韩国与日本[1]。潜伏期一般为 7~14 d,平均 9 d,其发病特点为发病急,病情进展快,临床上主要表现为发热、乏力、头痛、肌肉酸痛、局部淋巴结肿大、消化道症状及血小板及白细胞减少,转氨酶、肌酸激酶、乳酸脱氢酶升高。部分病例可出现出血症状,少数重症病例可因多脏器功能损伤救治无效而死亡,平均病死率约 10%~30%,在日本韩国则高达 50%[2,3]。2011 年 6月舟山市首例发热伴血小板减少综合征病例被确诊[4],此后每年都有新病例被确诊,发病人数与病死率都呈不断上升趋势,另有30%左右的临床疑似病例得不到病原学确诊,是否还有与SFTSV类似的病毒存在引起了我们的关注。当前国际上与SFTSV高度相关的类SFTSV病毒有来自美国的腹地病毒(Heartland virus,HRTV)、澳大利亚的猎人岛病毒(Hunter Island virus,HIGV)、印度的马尔索尔病毒(Malsoor virus,MalsoorV)及新疆的古尔图病毒(Guertu virus,GuertuV)[5],上述4种病毒基因结构与SFTSV相同,均有L、M、S的3个特异性基因节段,与SFTSV的基因序列相似度分别是:61.2%、52.0%、56.4%与75.2%。上述5种病毒基因编码的蛋白抗原也有一定得交叉反应,除了SFTSV与HRTV能感染人引起发热伴血小板减少综合征之外其他3种病毒未见致病性报道,但并不代表着这些类SFTSV不具有潜在的危险性[6,7]。
1 材料与方法
1.1 实验材料
1.1.1 疑似病人血清采集与处理
为适当扩大检测范围,SFTS疑似病例的确定参照《发热伴血小板减少综合征防治指南(2010版)附件2》执行。2014—2017年共采集临床SFTS疑似病例180例,男性78例,女性102例,年龄分布12~88岁,平均63.31岁±14.51岁。病人入院后采集清晨空腹静脉血5 mL,分离血清后以每管0.5 mL分装后置-80℃超低温冰箱保存。
实时荧光定量RT-PCR特异度验证用的SFTSV阴性血清由体检正常的婴幼儿血清与临床常见的其他血液病毒阳性血清:乙肝病毒(HBV)、丙肝病毒(HCV)、巨细胞病毒(CMV)及登革热病毒(DENV)组成,SFTSV阳性血清由舟山市妇幼保健院、舟山医院、岱山县疾病控制中心提供。
1.1.2 传播媒介采集与处理
1.1.2.1 鼠
在宁波舟山港域内每年有发热伴血小板减少综合征病例确诊的象山县、宁海县与岱山县的患者居住地周围野外山坡地(疫点)用鼠笼或鼠夹捕捉老鼠并进行鼠种分类登记,在生物安全柜内解剖老鼠,取鼠肺保存于-80℃超低温冰箱,取1 g左右鼠肺样本到2 mL EP管,加1 mL动物细胞培养液(MEM)在混合球磨仪(型号MM400)中低温研磨2次(50 Hz 2 min/次),然后8 000 rpm低温离心5 min,取上清200 μL提取RNA,上清为荧光RT-PCR检测用模板。余下的300 μL保存于-80℃作为复检与病毒分离备用样本。
1.1.2.2 蜱
游离蜱选用布旗法采集野外草地游离未吸血蜱,回实验室解剖显微镜下分类,10只蜱为一组。
1.1.2.3 螨
游离螨虫捕捉参照于娟等报道的小黑板方法[8],选晴天上午10时至下午3时在患者居住地周围草地上放小黑板若干块,10~20 min取回小黑板,观察正反面,如有缓慢爬行的游离螨,即用湿毛笔挑入EP管内带回实验室倒置显微镜下鉴定、计数、备用。寄生螨选疫区患皮肤病的猫与狗,用棉签刮取猫耳内分泌物放入EP管内或用手术刀片刮取狗耳皮炎处皮屑放入EP管内,在实验室倒置显微镜下鉴定、计数、分组,按每组100只螨样本放入2 mL EP管,用25%酒精清洗消毒1 min,加1 mL MEM涡旋清洗反复3次,8 000 rpm 5 min去上清。加500 μL MEM在MM400混合球磨仪中低温下进行研磨2次(50 Hz 2 min/次),8 000 rpm低温离心5 min取上清200 μL提取RNA,上清为荧光RT-PCR检测用模板。余下300 μL保存于-80℃作为复检与病毒分离备用样本。
1.1.3 荧光定量RT-PCR的引物与探针设计与合成
选用美国国家生物信息中心(NCBI)靶基因核苷酸序列搜寻软件 (Nucleotide)、Blast比对分析软件、美国综合DNA技术公司(IDTDNA)网上引物设计软件,进行发热伴血小板减少综合征相关病毒的引物、探针设计,设计的引物、探针序列经Blast比对验证合格的引物、探针,选择综合指标最优的序列提交到TaKaRa生物工程公司合成与标记,5’标记FAM或HEX发光基团,3’标记TAMARA或BHQ1淬灭基团,见表1。
1.1.4 5种病毒阳性质粒构建
从Nucleotide软件上分别下载5种病毒靶基因序列,经与荧光RT-PCR匹配的前引物至后引物连续序列作为5种病毒阳性质粒构建序列,经Blast特异度比对分析合格后,把上述5段阳性质粒序列提交到TaKaRa生物工程公司合构建质粒。上述5个阳性质粒可用于实时荧光定量RT-PCR的阳性对照、定量标准参照、标准曲线绘制等。5种病毒阳性质粒序列见表2。

表1 SFTS相关的五种病毒实时荧光定量RT-PCR检测引物探针序列

表2 发热伴血小板减少综合征相关的5种病毒构建的阳性质粒序列
1.1.5 主要试剂
一步法实时荧光定量RT-PCR试剂盒(RR064A)、一步法RT-PCR试剂盒(RR055A)、PCR试剂盒(RR 902A)、RNA逆转录试剂盒(6210A)均购自宝生物工程(大连)有限公司,病毒RNA提取试剂盒(德国QIAGEN公司74104)、酶联免疫SFTSV抗体检测试剂盒(无锡鑫连鑫生物医学科技公司)。
1.2 方法
1.2.1 5种病毒实时荧光定量RT-PCR快速检测体系构建
荧光RT-PCR扩增体系与反应条件、引物与探针配比与浓度的优化,然后对建立的荧光RT-PCR的灵敏度、特异度、重复性、扩增曲线形态、反应所需时间等重要指标进行测试、比对与评估。
1.2.2 病毒载量检测体系构建
定量标准品制备:根据宝生物工程(大连)有限公司构建提交的5种病毒的阳性质粒浓度数据换算成拷贝数,换算公式:(每微升质粒质量×10-9/660×质粒碱基长度)×6.02×1023=拷贝数/μL。 经计算 5种病毒的阳性质粒原液的每微升拷贝数见表3。

表3 5种病毒的阳性质粒原液的每微升拷贝数
1.2.3 荧光定量RT-PCR检测阳性样本的鉴定
1.2.3.1 病毒L、M、S 3个特异性基检测鉴定
5种病毒遗传基因结构相同均含有L、M、S 3个特异性基因,所有实时荧光RT-PCR阳性样本须经L、M、S 3个特异性基因检测,3个特异性基因检测阳性该样本确认为阳性。3个特异性基因检测方法采用巢式PCR,引物选用参考文献[9]中的引物。
1.2.3.2 病毒分离培养鉴定
符合病毒分离的阳性样本(距发病时间5d以内、CT值<35的血清)用非洲绿猴肾细胞(Vero)进行病毒分离培养,具体步骤按胡逢蛟等[10]报道的方法执行,取样本 100 μL,加 10 μL 青霉素和链霉素,使双抗终浓度为1 000 U/mL,4℃放置4 h。将生长至70%~80%的单层Vero细胞用维持液洗涤3次后加入双抗处理过的血清样本及3 mL细胞维持液。置于35℃、5%CO2培养箱中过夜,次日弃去液体,并用细胞维持液洗一遍,再加入3 mL细胞维持液放置于35℃、5%CO2培养箱培养。每隔3 d换一次液,并逐日观察细胞病变 (CPE)至++++时取上清作病毒鉴定,无细胞病变(CPE)的样本继续培养至第14 d,阴性样本盲传3代,第3代仍未出现CPE者进行间接荧光免疫法(IFA)与PCR检测,有阳性反应的继续传代,无阳性反应的样本作阴性处理。
1.2.3.3 病毒序列测定比对分析及聚类进化树构建
选择具有代表性阳性样本进行序列测定分析及聚类进化树构建。运用MEGA5.2软件中的Clustal W进行序列比对,基于Kimura-2模型构建NJ(Neighbor-Joining)系统进化树,并计算序列之间的遗传距离。基因分型参照复旦大学付永锋博士的方法[11]。
1.2.4 实验质量控制与数据统计
实验样本采集、检测、诊断、病例分类等标准按《发热伴血小板减少综合征防治指南,2010版》执行[12]。实验室个人防护、实验废弃物处置、防护设备要求等生物安全措施按 《病原微生物实验室生物安全管理条例》执行[13]。实验数据统计参照陈坤主编的《临床流行病学》[14]。
1.2.5 伦理学问题
采样、检测与数据分析专业工作者应对被调查者的所有信息及病情进行保密。
2 结果
2.1 5种病毒实时荧光定量RT-PCR与阳性质粒验证结果
2.1.1 实时荧光定量RT-PCR扩增体系与反应条件优化结果
荧光 RT-PCR 扩增体系为 25 μL(064 A),优化后各反应物的体积为:RT-PCR缓冲液12.5 μL;校正液 (ROX)0.5 μL;Taq 酶和逆转录酶各 0.5 μL(5单位/μL);10 μmol/L 上游引物 0.5 μL;10 μmol/L 下游 引 物 0.5 μL;5 μmol/L 荧 光 探 针 0.5 μmol/L(TaqMan);Rnase Free 水 4.5 μL;模板 5 μL。反应条件(FAST):逆转录:42.0℃ 5 min、95℃ 10 s ;PCR:95℃ 1 s、60℃ 20 s,40 个循环;60℃在 FAM 或 VIC通道采集荧光信号。在上述条件下HRTV、SFTSV、HIGV、MalsoorV与GuertuV优化后的荧光RT-PCR用于以下不同浓度的阳性质粒检测,检测结果显示本研究建立的方法均能用于HRTV、SFTSV、HIGV、MalsoorV与GuertuV病毒核酸检测,并能获得有规律的典型的扩增曲线。HRTV、SFTSV扩增曲线见参考文献[15]报道,HIGV、MalsoorV与GuertuV的扩增曲线见图1。

图1 HIGV、MalsoorV与GuertuV的扩增效果与重复性
2.1.2 实时荧光定量RT-PCR检测体系的灵敏度测试结果
将构建的5种病毒阳性质粒标准品从5×107拷贝/μL稀释至 5×100拷贝/μL共 8个浓度,用上述荧光RT-PCR快速检测体系分别测其定灵敏度,测定结果是:SFTSV、MalsoorV、GuertuV 均达到 5×100拷贝/μL,HRTV、HIGV 达到 5×101拷贝/μL。
2.1.3 实时荧光定量RT-PCR的重复性测试结果
将构建的5种病毒阳性质粒标准品从5×107拷贝/μL 稀释至 5×101拷贝/μL 共 7个浓度,每个浓度重复测试3次,计算重复测试样本的平均CT值、标准差与变异系数,结果见表4。
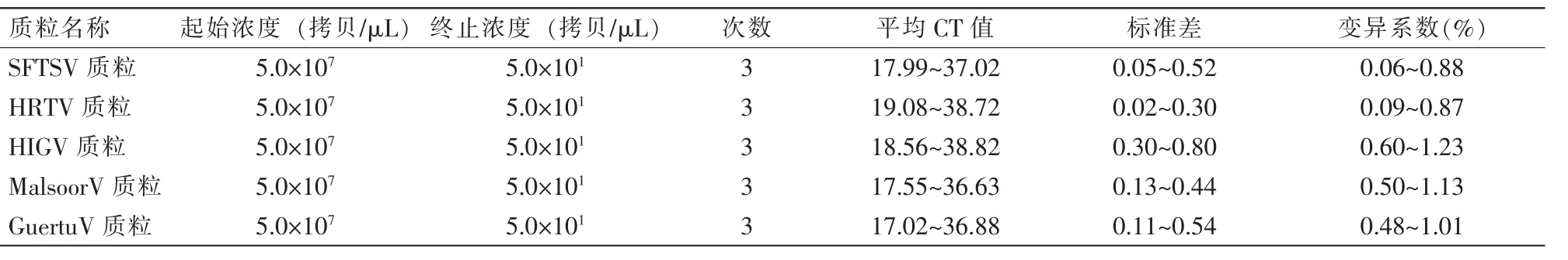
表4 荧光RT-PCR对5种质粒7个浓度的重复性测试结果
2.1.4 实时荧光定量RT-PCR的特异度测试结果
取临床常见的血液病毒阳性血清、体检正常的成人血清、SFTSV确诊阳性血清各30份,以体检正常的婴幼儿混合血清为5种病毒阴性对照,以5种病毒阳性质粒为阳性对照。用上述5种实时荧光定量RT-PCR分别检测验证,验证结果:阳性对照均为阳性,阴性对照均为阴性,在90份验证血清中未检测到 HRTV、HIGV、MalsoorV、GuertuV 4 种病毒,但在30份SFTSV确诊阳性血清中均能检测到阳性结果。
2.2 临床疑似病例血清中5种病毒监测结果及阳性病人岛屿分布
2014—2017年共收集临床疑似病例急性期血清180份,用上述实时荧光定量RT-PCR检测试剂对 5种病毒进行检测, HRTV、HIGV、MalsoorV、GuertuV 4种病毒的检测结果,除了阳性对照(质粒)获得阳性结果外,180份血清样本与阴性对照均为阴性。SFTSV的检测结果:阳性92份、阴性88份,SFTSV的检出阳性率为51.11%(92/180)。92例SFTS确诊病人分布在岱山本岛有69例、长涂岛有12例、衢山岛2例、大猫摘箬山岛5例、金塘岛2例、枸杞岛2例,见图2。
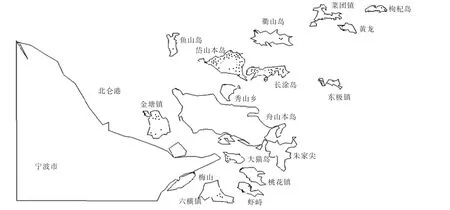
图2 92例SFTS确诊病例在宁波舟山港域内分布(图中有黑点的岛屿上)
2.3 传播媒介中5种病毒监测结果
疫区鼠肺283份,每个鼠肺为一组。疫区恙螨605只,每100只为一组共分6组。疫区蜱200只,每10只为一组共分20组。实时荧光定量RT-PCR检测上 述 样 本 中 的 SFTSV、HRTV、HIGV、MalsoorV、GuertuV 5种病毒核酸RNA,检测结果均为阴性。
2.4 阳性样本特异性基因鉴定结果
SFTSV具有L、M、S 3个特异性基因节段,用巢式PCR对92份阳性血清进行L、M、S 3个特异性基因节段检测确认,检测结果显示92份均能检测到SFTSV 3个特异性基因,因此可以确认上述92例临床疑似病人均为SFTSV病毒感染所致。SFTSV的3个特异性基因(M、S、L)的巢式PCR扩增产物长度分别是:420 bp、601 bp、1 020 bp,见图 3。
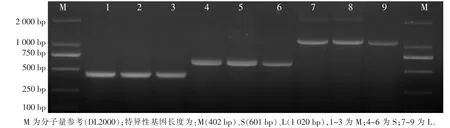
图3 巢式PCR鉴定SFTS病毒特异性基因长度
2.5 阳性样本病毒分离鉴定结果
在92份阳性血清中挑选适合病毒分离(距发病时间5 d以内、CT值<35)的样本65份进行病毒分离,在65份血清样本中分离到SFTSV 47株,分离阳性率为72.31%(47/65)。SFTSV致Vero细胞病变形态,见图4。
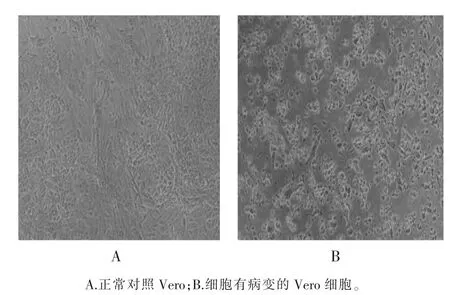
图4 SFTSV致Vero细胞病变形态
2.6 病毒基因序列测定分析与聚类进化树构建
47株SFTSV可分为A与B两个基因型,A基因型占 25.53%(12/47)、B 基因型占 74.47%(35/47),A与B两基因距离在0.046~0.054,由于同一基因型内的序列聚类差异原因,B基因型分成2个进化分支,A基因型可分为3个进化分支,5个进化分支之间的基因距离0.019~0.038。B基因型中第一分支占94.29%(33/35),主要分布在岱山本岛,分支内33株病毒之间的同源性均≥99.5%,与基因库中同源性最高的是 Zhejiang/01/2011(KJ597832)毒株,序列同源性为99.99%,是B基因型中一支相对独立的进化系统被称为舟山系[11]。B基因型中第二分支占5.71%(2/35),仅分布在嵊泗枸杞岛,分支内2株病毒的同源性99.99%,与基因库中同源性最高的是日本毒株SPL053A(AB985523)序列同源性是99.71%。A基因型中第一分支占41.67%(5/12),主要分布在岱山长涂岛,分支内5株病毒株间的序列同源性均≥99.6%,与基因库中同源性最高的是韩国毒株CB3(KY789440),序列同源性是99.08%。A基因型中第二分支占41.67%(5/12),主要分布在定海的大猫摘箬山岛,分支内毒株间的序列同源性均≥99.50%,与基因库中同源性最高的是宁波毒株NB34(KR698327),序列同源性是99.54%。A基因型中第三分支占16.66%(2/12),仅分布在岱山大衢岛,分支内的2株病毒同源性99.99%,与基因库中同源性最高的是江苏毒株JS2011-109(KC505140),序列同源性是 99.71%。宁波舟山港域内的SFTSV聚类进化树见图5。
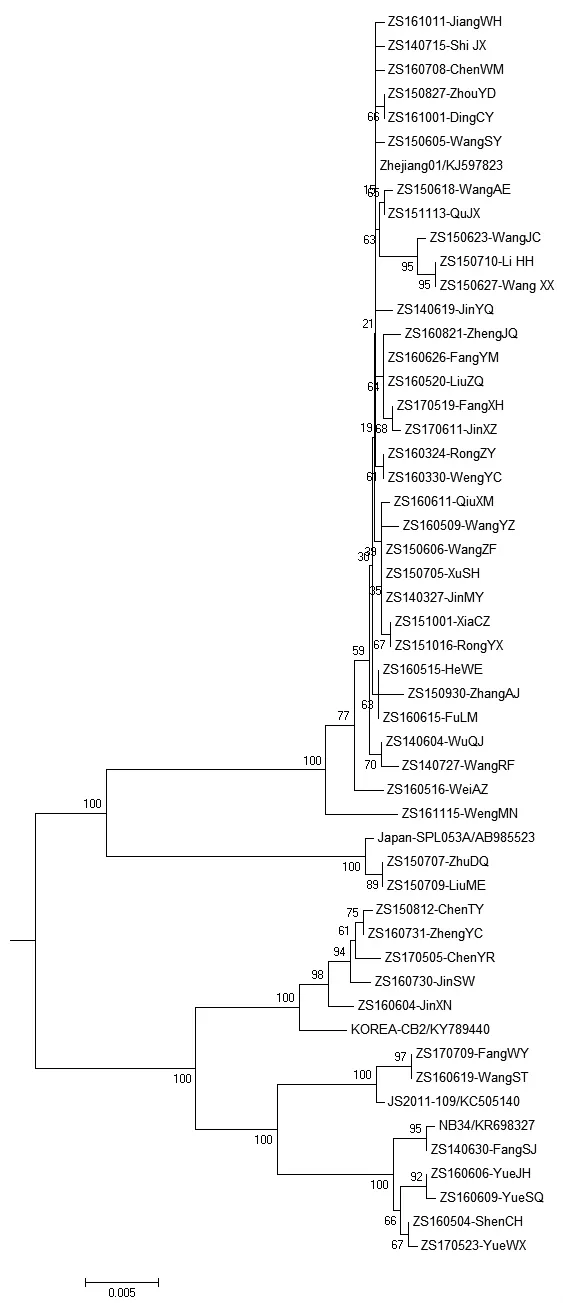
图5 2014—2017年47株SFTS病毒S基因型与系统发育进化树
3 讨论
本次监测用于 SFTSV、HRTV、HIGV、MalsoorV、GuertuV 5种病毒检测的实时荧光定量RT-PCR方法经过灵敏度、重复性、特异性及扩增曲线等重要指标验证均取得比较满意的结果,唯一欠缺的是未能获得 HRTV、HIGV、MalsoorV、GuertuV 4 种病毒的阳性参照样本,因此只能选用特异性的阳性质粒取代,根据既往的工作经验应用阳性质粒对检测结果的可靠性不会造成较大的影响。通过对2014—2017年舟山各医院上送的180份临床SFTS疑似病例监测结果显示:除SFTSV外其余4种病毒均为阴性,SFTSV核酸的检出率为51.11%(92/180)稍为偏低的原因是与送检样本关系密切,本次监测因考虑到其他4种病毒的存在可能,只要有发热、血小板白细胞降低、转氨酶升高、不分发病季节与病人年龄均作为SFTS疑似病例样本收集,若是典型样本的检出率则可明显提高。用上述实时荧光定量RT-PCR对1 088份传播媒介的检测结果全部阴性与浙江省疾控中心和山东大学结果一致[16]。本地没有Guertu病毒宿主-长尾黄鼠与草原革蜱[17],HRTV、HIGV与MalsoorV病毒分布于美国、澳大利亚与印度,上述情况可能是检测阴性的主要原因。从上述监测结果来分析,当前宁波舟山港域区内发热伴血小板综合征病原体为单一的SFTSV,未见有其他类SFTSV传入。
复旦大学的付永锋博士根据系统发育分析表明当前的SFTSV可以分为6种基因型,不同基因型之间的基因距离为 0.035~0.062。F、A、D基因型在中国大陆地区占主导地位,E基因型仅在江苏和山东被发现,B基因型在日本和韩国占主导地位,但是没有在中国大陆被发现[11]。当前流行于宁波舟山港域内的B基因型病毒是本地的主要流行病毒株,具有相对独立的遗传特征与流行于日韩的B基因型病毒基因序列有较大的差异,基因距离为0.038。因此宁波舟山港域内临床病例在发病率与病死率、感染发生时间与感染年龄、虚弱与腹胀等临床症状也与国内其他地区有一定差异。另一个遗传进化特征是每个进化分支在各岛内聚集比较明显,如B基因中第一分支的33株病毒聚集于岱山本岛;B基因中第二分支的2株病毒聚集于靠近公海的枸杞岛;A基因第一分支的5株病毒聚集于岱山岛、长涂岛;A基因中第二分支5株病毒聚集于紧靠宁波的大毛摘箬山岛;A基因中第三分支2株病毒聚集于大衢岛;可能是通过海鸟传播,也可能是通过外轮修理(长涂岛上有大型船厂与韩国外轮关系密切)或通过大宗农产品转运中的传播媒介传播。总之SFTSV的传播途径还不十分明确,因此今后需严密关注重视国际上新发传染病病原体的检验被检疫工作。
