磁共振波谱对早产儿缺血缺氧性脑病的诊断价值
2018-12-28沈丹丹蒋佳珅贾中正周学军
沈丹丹, 蒋佳珅, 贾中正, 花 烨, 葛 敏, 周学军
南通大学附属医院医学影像科,南通 226001
新生儿缺血缺氧性脑病(hypoxic ischemic encephalopathy, HIE)指围生期、新生儿期窒息引起缺氧、脑血流减少或暂停而导致的脑损伤,也是导致新生儿围产期死亡及严重神经系统发育异常的主要原因之一。每年约有149万早产儿出生,占所有新生儿的11%[1]。目前,随着新生儿抢救及护理技术的不断提高,早产儿的成活率明显提高,但是同时早产儿脑损伤的发病率也逐渐升高。由于早产儿脑损伤多可逆,早期诊断、早期干预治疗是提高早产儿存活率及降低其残疾率的关键。
HIE的临床诊断依据主要为窒息史、低Apgar评分、意识障碍、代谢性酸中毒及癫痫、抽搐等,但是目前其诊断标准存在一定的主观性[2]。目前常用的HIE辅助检查方法有颅内超声(ultrasound, US)、计算机体层摄影(computed tomography, CT)及磁共振成像(magnetic resonance imaging, MRI)。US及CT的组织分辨率及病灶检出率均小于MRI[3-5]。此外,CT存在放射暴露。MRI作为一种成熟的无创影像检查技术,对HIE的诊断及预后判断具有重要的临床价值。然而,由于早产儿脑富含水分及髓鞘化不完全,常规MRI对HIE的早期发现及脑损伤程度的判断存在一定的局限性[6]。因此,寻找早期无创诊断早产儿HIE的方法显得十分重要。
氢质子磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS)作为能无创性直接检测脑组织代谢物浓度的方法,可用于监测HIE发生后脑组织代谢产物的变化,进而有利于预测HIE患儿的预后情况[7-8]。相比于常规MRI图像所显示的解剖结构的异常,1H-MRS显示的脑内代谢产物的变化更早出现,从而能早期诊断HIE及其脑损伤。因此,本研究探讨了1H-MRS对早产儿HIE的临床诊断价值,并获取HIE患儿脑损伤诊断的阈值,为临床提供参考。
1 资料与方法
1.1 一般资料 选取2015年12月至2017年2月在我院新生儿科确诊为HIE的28例早产儿(HIE组)。患儿均进行MRI检查,其中男性17例,女性11例;出生体质量1.1~2.5 kg,平均出生体质量2.0 kg;胎龄30+1~35+4周,平均33周;日龄1~30 d,平均13 d;矫正胎龄为33+3~36+5周,平均35周。同时选取45例颅脑正常早产儿作为对照组,其中男性28例,女性17例;出生体质量0.8~2.4 kg,平均出生体质量1.8 kg;胎龄28+2~35+4周,平均33周;日龄1~34 d,平均13 d;矫正胎龄为33+1~36+6周,平均35周。所有HIE病例均符合足月儿HIE诊断标准[9]。
颅脑正常早产儿的纳入标准:(1)有胎盘异常、胎膜早破、羊水污染或黄疸等病史,经MRI检查排除HIE;(2)无抽搐、意识改变等神经系统功能异常;(3)排除先天性疾病、严重低血压等疾病。本研究通过医院伦理委员会批准。MRI检查前均获得监护人的同意并签署知情同意书。
1.2 MRI检查方法 采用GE Signal 1.5 T MR扫描仪及8通道相控阵头颅线圈。所有早产儿于扫描前静脉注射苯巴比妥(鲁米那)镇静,待其熟睡后进行扫描。检查时早产儿在家属的陪同下进入MRI检查室,取仰卧位,平躺于扫描床上,采用头先进的方式,用儿童专用耳塞保护听力,并用海绵垫固定颅脑,同时加盖棉被。为了减少风险,新生儿主治医师随同检查。
1.2.1 常规MRI扫描参数 常规MRI检查包括横断位SE-T1WI、SSFSE-T2WI、DWI。SE-T1WI:TR/TE 380 ms/11 ms,层厚3.5 mm,层间距1.5 mm,FOV 160 mm×160 mm,矩阵256×192。SSFSE-T2WI:TR/TE 2 500 ms/120 ms,层厚3.5 mm,层间距1.5 mm,FOV 160 mm×160 mm,矩阵256×224。DWI:TR/TE 5 300 ms/86.5 ms,层厚3.5 mm,层间距1.5 mm,FOV 160 mm×160 mm,矩阵130×130,激励数2,b值为1 000 s/mm2,成像时间87 s。
1.2.21H-MRS扫描参数1H-MRS采用点分辨波谱(point resolved spectroscopy, PRESS)序列进行横断面扫描,TR/TE 1 000 ms/144 ms,层厚10 mm,FOV 180 mm×180 mm,矩阵18×19,激励数1,成像时间328 s。1H-MRS结合横断面SE-T1WI设定感兴趣区为右侧基底节区,避免颅骨、脑脊液等影响[10]。定位后先进行预扫描,当自动匀场达到半高线宽98%时,开始1H-MRS扫描。
1.3 图像后处理 采用GE公司提供的后处理工作站的Functool 9.4软件进行后处理,进行相位校正、基线校正、ppm转换后获得1H-MRS中各代谢物在波谱线中的峰下面积。在1H-MRS的图像中,横坐标表示共振频率,单位为ppm,纵坐标表示信号强度。以肌酸(Cr)为参考标准,将其他化学物质峰下面积与Cr峰下面积相比,计算右侧基底节区的乙酰天门冬氨酸/Cr(NAA/Cr)、NAA/胆碱(NAA/Cho)、乳酸/Cr(Lac/Cr)比值。
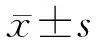
2 结 果
2.1 一般情况 两组新生儿中,27例由于镇静效果欠佳,未进行1H-MRS检查或1H-MRS基线欠稳被剔除。HIE组早产儿HIE的常规MR主要表现为:皮质下及深部白质多发点状异常信号,T1WI稍高信号,T2WI稍低信号;基底节区、丘脑在T1WI上呈均匀或不均匀高信号;可伴有脑室积血、蛛网膜下腔出血;2例早产儿可见脑室周围白质软化(periventricular leukomalacia, PVL)。
2.2 两组右侧基底节区各代谢物比值的比较 结果(表1,图1)表明:HIE组患儿中右侧基底节区NAA/Cho、NAA/Cr明显低于对照组,差异均有统计学意义(P<0.05);HIE组患儿中右侧基底节区Lac/Cr高于对照组,差异有统计学意义(P<0.01)。

表1 HIE患儿与对照组右侧基底节区各代谢物比值的比较
HIE:缺血缺氧性脑病
2.3 右侧基底节区各代谢物比值鉴别HIE组与对照组的ROC曲线分析 结果表明:右侧基底节区NAA/Cho与NAA/Cr分别为0.57、1.07时,鉴别HIE组与对照组的灵敏度分别为63.2%、89.5%,特异度分别为81.5%、55.6%,曲线下面积(area under curve, AUC)分别为0.72、0.71(P=0.01)。当右侧基底节区Lac/Cr为0.09时,鉴别HIE患儿与对照组的灵敏度为89.5%、特异度为88.9%,AUC为0.88(P<0.01)。
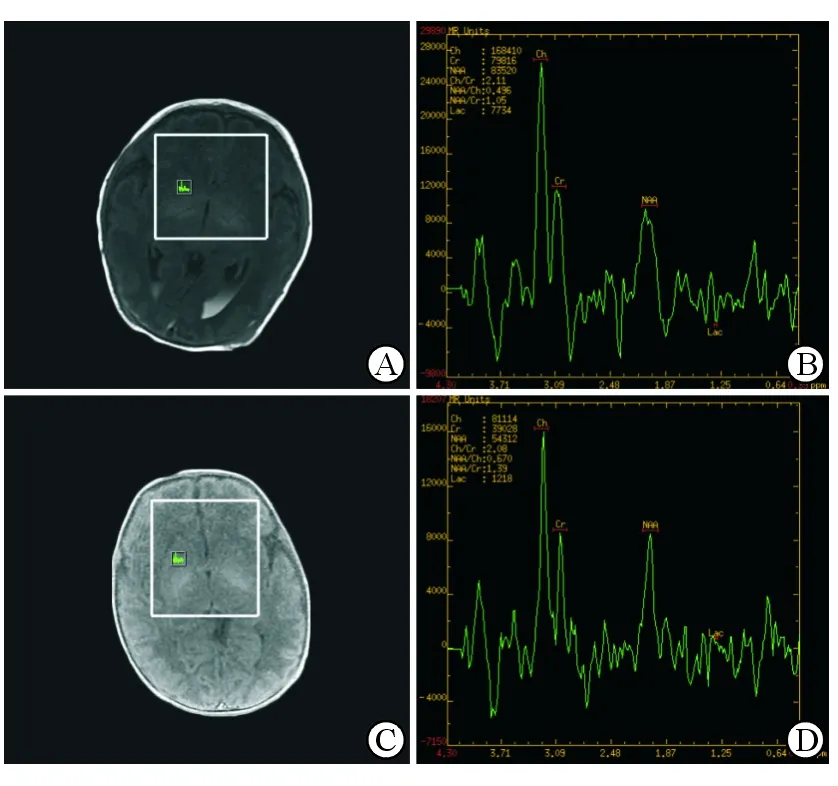
图1 HIE患儿的NAA/Cho、NAA/Cr、Lac/Cr的测定
A,B:缺血缺氧性脑病(HIE)早产儿,35+2周,男性,右侧基底节区1H-MRS,Cho/Cr=2.11、NAA/Cr=1.05、NAA/Cho=0.49、Lac/Cr=0.10;C,D:对照组早产儿,36+3周,男性,右侧基底节区1H-MRS,Cho/Cr=2.08、NAA/Cr=1.39、NAA/Cho=0.67、Lac/Cr=0.03
3 讨 论
HIE是导致早产儿脑损伤的主要原因之一。胎儿在32~41周,尤其36周以后,髓鞘形成的白质的体积突然以5倍的速度增长,此时少突胶质细胞的前体细胞对缺血缺氧极其敏感[11-12]。正因为这种特殊的脑结构及脑发育成熟方式,早产儿脑更易受到缺血缺氧的影响而发生脑损伤[13]。单光子发射计算机体层显像(single photon emission computed tomography, SPECT)研究显示,早产儿基底节区的血流量是皮层的2倍、白质的4倍多,因此相对于白质,基底节区对缺血缺氧更敏感[14]。早产儿脑损伤严重者可出现PVL,而严重的基底节区损伤可导致新生儿喂养困难、抽搐及四肢瘫痪,从而导致早产儿残疾率及死亡率升高。因此,在HIE早产儿脑白质及基底节区发生不可逆性损伤前及早诊断与治疗对其预后至关重要。
1H-MRS能从细胞水平上观察缺血缺氧时脑代谢物的变化情况,提供HIE发生后细胞能量代谢、神经元功能等相关信息,从而帮助临床评估HIE脑损伤。研究[8]证实,Lac可作为早期HIE快速诊断的主要指标,Lac的升高与HIE的严重程度及HIE患儿远期预后相关。本研究中HIE患儿的Lac/Cr值高于对照组(P<0.01),与相关研究[15]报道一致。早产儿脑中葡萄糖转运能力较低,一旦发生缺血缺氧,葡萄糖转运更少,从而导致氧化磷酸化受到抑制,葡萄糖无氧酵解增加,细胞内Lac蓄积;同时又由于局部脑血流量减少,Lac不能被及时清除,导致Lac含量增加。随着细胞的再灌注,Lac水平可暂时恢复正常,但24~48 h后又由于第2次能量衰竭而再次升高[16]。本研究中早产儿日龄大于48 h,Lac的升高主要是由于第2次能量衰竭所导致的,但是具体机制需要进一步的研究证实。除此之外,刘绪明等[17]报道,PVL患者早期可出现Lac/Cr的升高;Lac/Cr升高可用于预测PVL的发生。
NAA只在神经元细胞中合成和释放,与神经元功能有关。Cho是神经递质的主要组成部分,参与细胞膜磷脂代谢,与新生儿髓鞘化密切相关[18]。NAA/Cho、NAA/Cr降低提示神经元破坏或丢失,预示HIE患儿预后不良[19]。在早产儿脑缺血缺氧的亚急性期(约3 d内),NAA/Cr下降并不明显,但是随着病情的发展,NAA/Cr明显下降,因此NAA/Cr可作为晚期诊断HIE的重要指标[20]。另有研究[21]表明,Cho在HIE急性期无明显异常,而脑损伤后几周可升高。本研究中,HIE患儿的NAA/Cho、NAA/Cr均低于对照组(P<0.05),与文献结果[22]相类似,提示HIE患儿的神经元功能受损。研究[8]显示,NAA/Cr<0.99时,HIE患儿出现不可逆性脑损伤,预后不良。而Ancora等[23]对20例低体温治疗后的足月HIE患儿进行1H-MRS检查及随访调查,结果显示,基底节区NAA/Cr预测不良预后的阈值为0.67。上述研究中阈值的差异可能与新生儿HIE分期、是否接受治疗及使用设备的不同有关。本研究中,NAA/Cr平均值为0.97,提示部分新生儿可能会出现较重的后遗症。本研究中右侧基底节区的NAA/Cho、NAA/Cr、Lac/Cr诊断早产儿HIE的灵敏度分别为63.2%、89.5%、89.5%,特异度分别为81.5%、55.6%、88.9%。由此可见,1H-MRS中Lac/Cr的灵敏度及特异度较高。
此外,早产儿出生后,脑组织以不同的速度不断生长发育[24],仅用孕龄或日龄并不能很好地反映早产儿脑的发育情况及变化。因此,本研究中运用矫正胎龄来代替孕龄或日龄选择患儿,从而使数据更符合早产儿脑发育的实际情况。
本研究存在一定的局限性:(1)样本数较少;(2)MRI检查时早产儿日龄较大,不利于反映HIE患儿早期脑损伤;(3)早产儿HIE的诊断标准参考足月儿HIE的诊断指南,但是足月儿与早产儿脑结构存在一定的差异性,部分指标(如脐动脉血pH<7.0)也会受到早产的影响[25]。
综上所述,本研究显示,1H-MRS能提供右侧基底节区NAA/Cho、NAA/Cr、Lac/Cr诊断早产儿HIE的有效阈值,从而能提高其诊断早产儿HIE的准确性,为临床诊疗早产儿HIE提供重要的参考价值。
