慢性低压低氧暴露对小鼠海马CA1区神经元树突棘形态及细丝蛋白A表达的影响*
2018-12-27赵再华沈学锋骆文静曹子鹏
周 杨, 赵再华, 沈学锋, 骆文静, 曹子鹏
(第四军医大学军事预防医学系军队劳动与环境卫生学教研室, 特殊作业环境危害评估与防治教育部重点实验室, 陕西 西安 710032)
高原低压低氧环境对人体的影响涉及多个系统和器官,其中中枢神经系统特别是大脑对低氧极为敏感[1-3]。长期处于低压低氧易出现学习记忆能力下降,并导致认知功能障碍[4]。海马作为大脑最敏感、最具有可塑性的功能区,在学习记忆过程中发挥重要的作用[5]。低压低氧暴露会影响神经元NMDA受体表达,使海马神经元兴奋性降低,导致学习记忆功能障碍,但其分子机制尚不完全明确[6]。树突棘是神经元树突上的突起结构,其结构和形态具有高度的可塑性,对学习记忆功能以及认知过程至关重要[7]。细丝蛋白A(filamin-A)是高分子质量细胞骨架蛋白细丝蛋白的亚型结构,可与多种细胞骨架蛋白和信号蛋白结合,具有整合细胞力学和信号转导的功能[8-9]。本研究通过模拟高原低氧环境观察慢性低压低氧暴露对小鼠树突棘形态和细丝蛋白A表达的影响,为进一步深入了解高原低氧环境影响认知功能的机制进行了探索。
材 料 和 方 法
1 动物分组
C57BL/6雄性小鼠,6~8周龄,起始体质量18~20 g,购自第四军医大学实验动物中心,动物许可证编号为SCXK(陕)2014-002。小鼠在本实验室动物房适宜条件下饲养适应4 d后,随机分为4组:常氧暴露7 d (normoxia 7 d)组、常氧暴露14 d (normoxia 14 d)组、低压低氧暴露7 d (hypoxia 7 d)组和低压低氧暴露14 d (hypoxia 14 d)组,每组20只。
2 主要仪器和试剂
低压低氧小动物模拟实验舱(贵州风雷航空军械有限责任公司);VT1000S 振动切片机(Leica);CM1900 冰冻切片机(Leica);超声裂解仪(Sonics & Materials);蛋白电泳系统(Bio-Rad);紫外分光光度计(SHIMADZU);凝胶成像仪(Bio-Rad);BX51 荧光显微镜(Olympus)。FD快速高尔基染色剂(FD Neurotechnologies);二甲苯(国产分析纯);无水乙醇(国产分析纯);5×Buffer缓冲液、RIPA中效组织裂解液和DAPI染色试剂(上海碧云天); BCA蛋白定量试剂盒(Thermo);Tween-20(Sigma);化学发光试剂(Pierce);中性树酯胶和抗β-actin抗体(Sigma);抗细丝蛋白A抗体(Cell Signaling Technology);山羊抗兔IgG(中国康为试剂公司);PVDF膜(Millipore);牛血清白蛋白(bovine serum albumin, BSA; MP Biomedicals);Triton X-100试剂(中国科昊生物公司)。
3 主要方法
3.1低压低氧暴露小鼠模型 方法同文献[10],低压低氧暴露组小鼠置于低压低氧小动物模拟实验舱内暴露,期间小鼠自由饮水,正常饲料喂养。模拟海拔高度为6 000米,分别连续暴露7 d 和14 d。
3.2Golgi染色 小鼠腹腔注射2%戊巴比妥钠(10 mL/kg)麻醉后开胸,经主动脉灌注37 °C生理盐水冲洗小鼠体内血液,再以4%多聚甲醛灌注至肢体僵硬。取完整脑组织浸泡在高尔基液(A∶B=1∶1)中避光常温放置2~3周。用振动切片机经海马区冠状位连续切片(厚100 μm)。切片分别经蒸馏水漂洗,高尔基液(D∶E∶蒸馏水=1∶1∶2)浸泡,去离子水再次漂洗,50%、75%、95%和100%无水乙醇依次脱水,最后二甲苯透化,树胶封片剂封片。
3.3树突分支及树突棘密度和长度的测定
3.3.1树突的分支及长度 在光学显微镜200倍镜下采集大鼠海马CA1区Golgi染色图片,利用Imaris软件对单个神经元进行重构和Sholl分析,以神经元胞体为圆心,做间距为20 μm的同心圆,统计树突与同心圆的交点数之和,用交点总数反映树突的分支。
3.3.2树突棘分类及计数 在光学显微镜1 000倍镜下观察树突棘,用Imaris软件对神经元树突棘进行重构并计数,以每10 μm树突棘个数反映其密度。
3.4Western blot方法 方法同文献[10]。小鼠麻醉后开胸,生理盐水经主动脉灌注后取脑组织,轻轻剥离海马置于1.5 mL的EP管中,每1 mg组织10 μL的比例加裂解液。充分研磨组织,静置样品于冰上充分裂解15 min,超声裂解仪进一步裂解(时间30 s、振幅25%),离心(12 500 r/min,15 min),定量后加入5×SDS样品缓冲液,煮沸。每组样品按40 μg蛋白上样,电泳后电转至PVDF膜。5% BSA室温封闭2 h,加入I抗4 ℃孵育过夜。次日PBST洗膜,后加相应II抗,室温孵育2 h,再次PBST洗膜后小心滴加化学发光试剂,凝胶成像仪成像并观察拍照,以目标蛋白与内参照(β-actin)积分吸光度(IA)的比值表示蛋白的相对表达量。
3.5免疫荧光染色 小鼠麻醉后开胸,生理盐水经主动脉灌注,4%多聚甲醛灌注至肢体僵硬后取完整脑组织。蔗糖溶液梯度脱水2~3 d,冰冻切片机经海马区冠状位连续切片(厚20 μm),晾干(室温2 h)后PBS洗片3次,每次5 min,5% BSA(含0.3% Triton X-100)溶液室温封闭透化30 min,将 I 抗用1% BSA溶液稀释(1∶100),滴加在封闭好的玻片上,放入湿盒中4 °C过夜。次日用PBS洗片3次,每次5 min,将荧光 II 抗用1% BSA溶液稀释(1∶500),小心滴加在玻片上,室温下避光孵育2 h,PBS洗片3次,每次5 min,加入DAPI试剂染胞核,室温下避光30 min,PBS洗片3次,每次5 min,70%甘油避光封片,晾干后在荧光显微镜下观察和拍照。
4 统计学分析
采用SPSS 20.0统计软件分析处理数据,数据以均数±标准差(mean±SD)表示,用t检验进行组间数据的比较,以P<0.05为差异有统计学意义。用GraphPad Prism 5软件作图。
结 果
1 慢性低压低氧暴露后海马CA1区树突分支的变化
神经元树突分支在接受信息传入和反馈回路形成中起着重要作用[11]。我们采用Golgi染色法观察慢性低压低氧暴露对小鼠海马CA1区神经元树突分支的影响,并用Imaris软件对神经元进行分析计数,结果显示,与常氧暴露组相比,低压低氧暴露7 d与14 d后小鼠海马CA1区神经元树突分支数略有升高,但差异无统计学显著性,见图1。
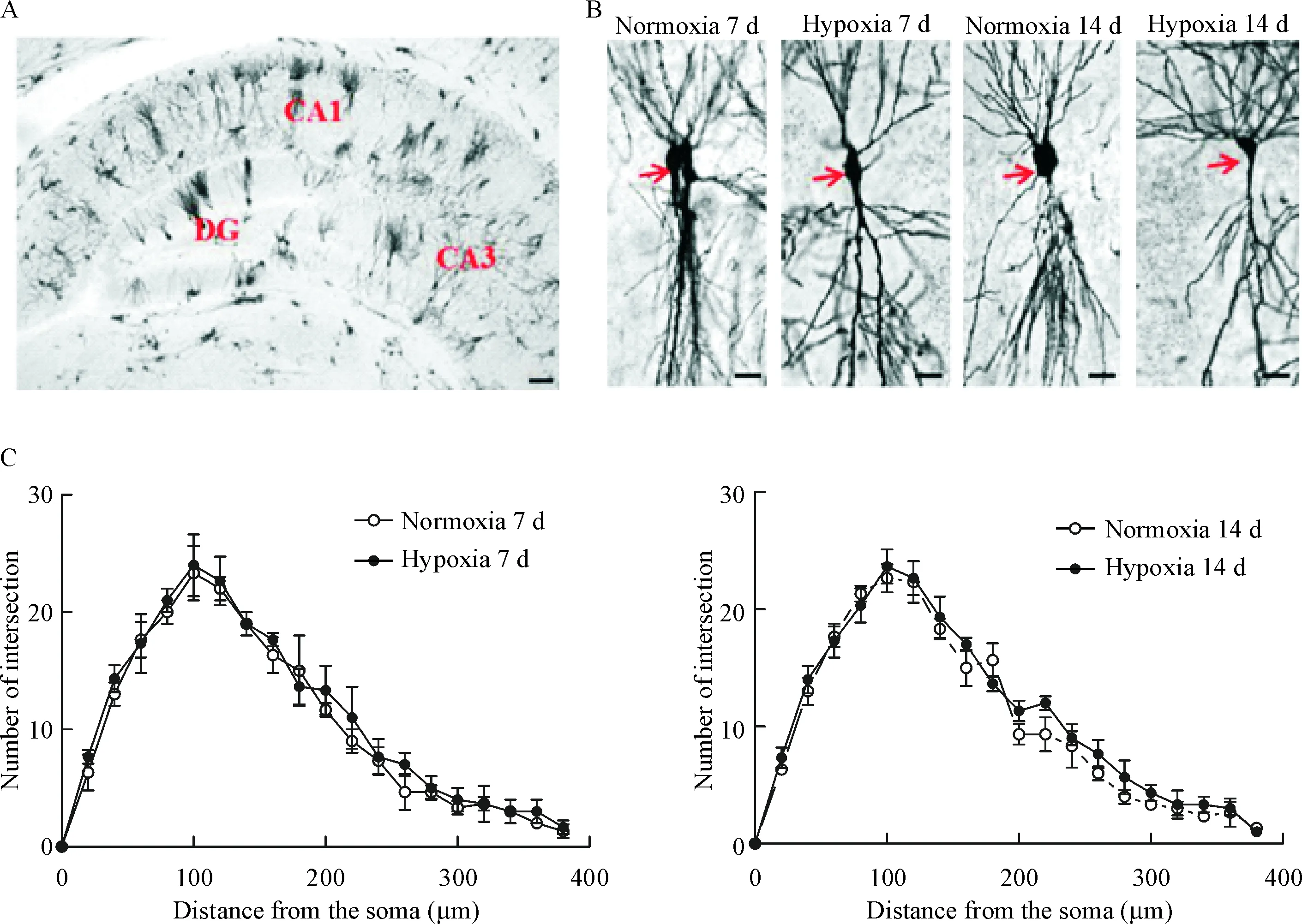
Figure 1.Effect of hypobaric hypoxia exposure on branches of dendrites in the neurons of mouse hippocampal CA1 region. A: Golgi staining of mouse hippocampus (scale bar=100 μm); B: Golgi staining of mouse pyramidal neurons in hippocampus CA1 region (scale bar=50 μm); C: total number of intersection points of dendrites in hippocampal CA1 region after 7 d and 14 d of exposure. Mean±SD. n=6.
2 慢性低压低氧暴露后海马CA1区树突棘密度及长度的变化
为了进一步探讨低压低氧暴露对神经元树突结构的影响,将Golgi染色片在显微镜下观察,采用Imaris软件采集神经元树突棘图片并进行分析统计。结果显示,与常氧暴露组相比,低压低氧暴露7 d 与14 d后小鼠海马CA1区神经元基树突棘和顶树突棘的密度均显著减少(P<0.01),并且树突棘长度增加(P<0.05),见图2。
3 慢性低压低氧暴露后海马组织细丝蛋白A表达的变化
通过Western blot法检测低压低氧暴露后小鼠海马区细丝蛋白A的表达变化。结果显示,低压低氧暴露7 d和14 d后,小鼠海马组织细丝蛋白A的蛋白表达水平低于常氧暴露组(P<0.01或P<0.05)。与低压低氧暴露7 d 组相比,暴露14 d 组细丝蛋白A表达水平升高(P<0.05),表明随着低压低氧暴露时间延长,细丝蛋白A的表达水平有一定程度的恢复,见图3。
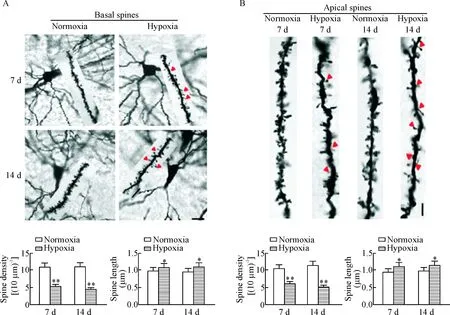
Figure 2.Effect of hypobaric hypoxia exposure on dendritic spine density and length in the neurons of mouse hippocampal CA1 neurons. A: basal dendrites and dentritic spines (Golgi staining, ×1 000, scale bar=10 μm); B: apical dendrites and dentritic spines (Golgi staining, ×1 000, scale bar=5 μm). Mean±SD. n=6. *P<0.05, **P<0.01 vs normoxia group.
4 慢性低压低氧暴露后海马CA1区细丝蛋白A表达和分布的变化
为了明确低压低氧暴露对海马CA1区细丝蛋白A表达和分布的变化,采用免疫组织荧光染色法检测低压低氧暴露后小鼠海马CA1区细丝蛋白A表达和分布。结果显示,细丝蛋白A在小鼠海马CA1区有正常表达,低压低氧暴露7 d 和14 d 后表达水平低于常氧暴露组(P<0.05)。与低压低氧暴露7 d组相比,暴露14 d 组细丝蛋白A表达水平升高,但差异无统计学显著性,这可能是由于免疫组织荧光染色实验中固定切片引起少部分抗原被封闭,导致检测的敏感性下降[12],见图4。
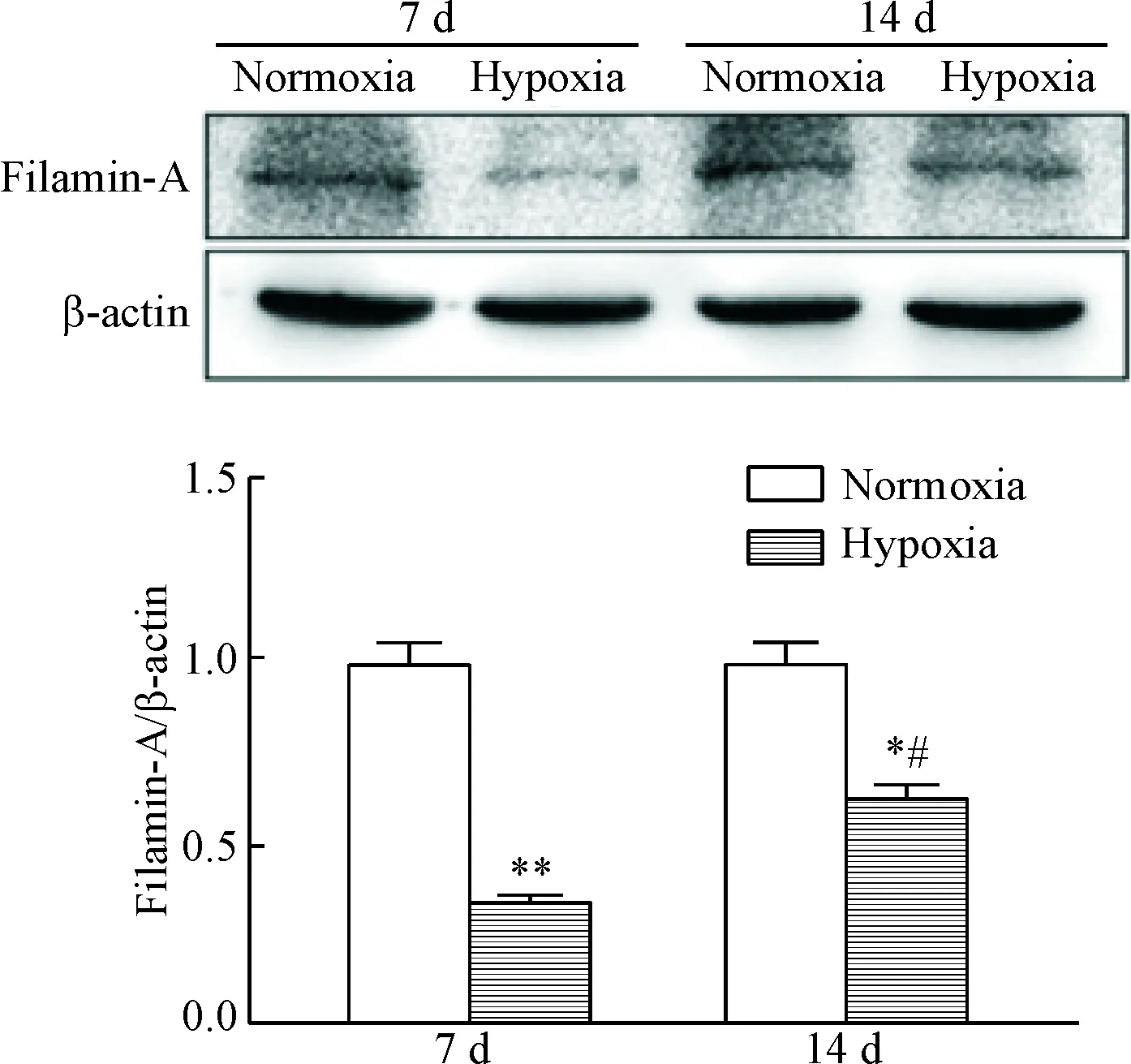
Figure 3.The effects of hypobaric hypoxia exposure on expression of filamin-A in mouse hippocampus. Mean±SD. n=6. *P<0.05, **P<0.01 vs normoxia group; #P<0.05 vs hypoxia 7 d group.
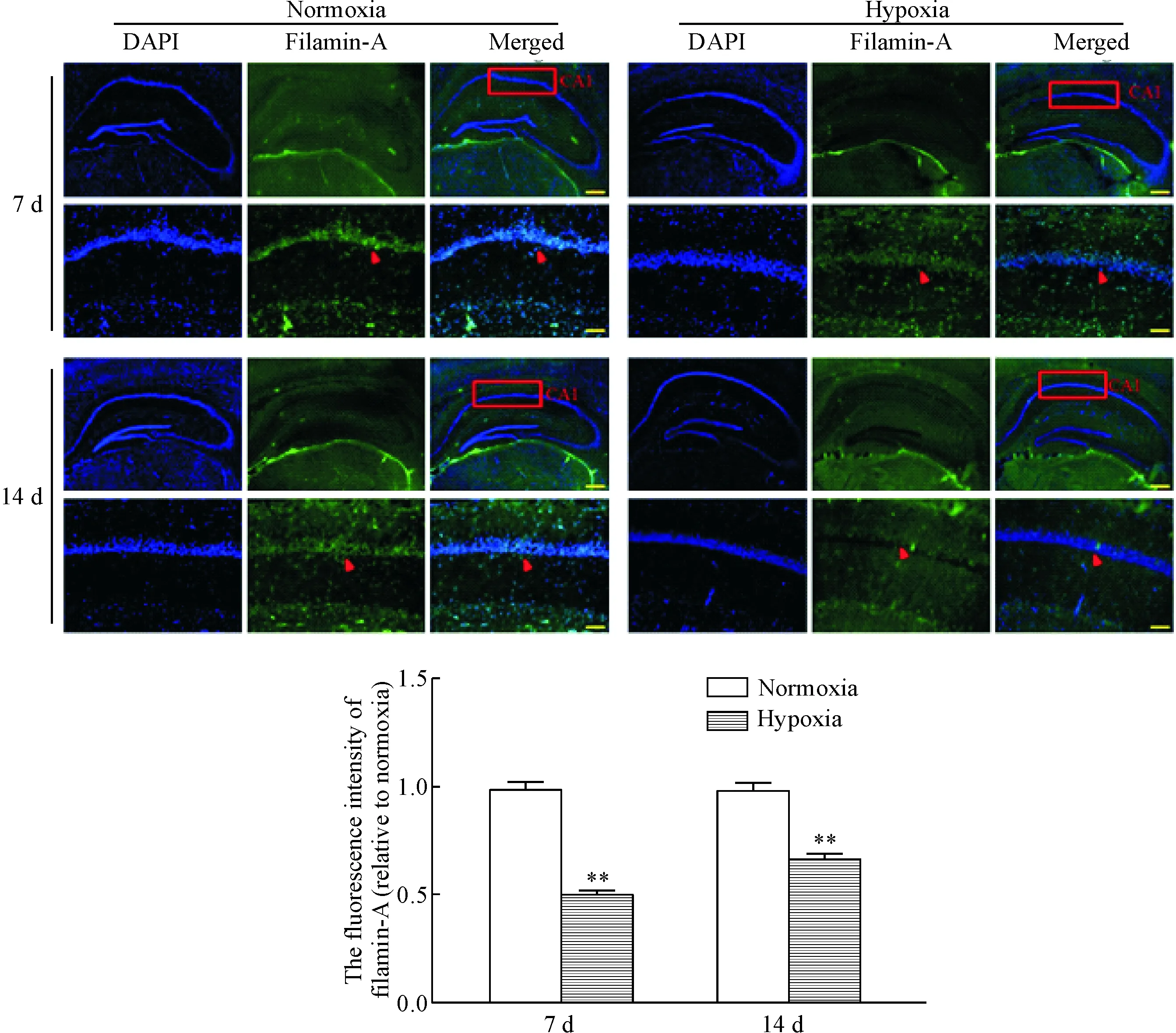
Figure 4.The distribution of filamin-A in mouse hippocampal CA1 region. The scale bars are 100 μm in the upper pannel and 20 μm in the lower panel. Mean±SD. n=6. **P<0.01 vs normoxia group.
讨 论
研究表明,慢性高原低氧可以影响大/小鼠的学习记忆功能[13-14]。缺氧对不同部位的脑神经有不同的敏感性,其中海马CA1锥体神经元、皮层神经元、丘脑网状神经元和脑干神经元更易受到缺氧的干扰,这些神经元被称为“缺氧易感细胞(anoxia-prone cells)”[15-16]。而工作记忆功能易发生慢性损伤主要是由于海马椎体CA1细胞对低氧有极高的敏感性。目前对低压低氧环境暴露对大脑认知功能影响的研究多局限于功能可塑性以及学习记忆行为学测试,关于结构可塑性的研究较少。树突棘作为神经元树突的重要特征性结构,其形态的动态变化对神经元信息传递和接收有重要的意义[17-18]。本研究采用Golgi染色方法观察小鼠海马CA1区神经元树突结构改变,结果表明慢性低压低氧暴露对神经元交叉点数目无显著影响,但低压低氧暴露后CA1区神经元树突棘密度下降,长度增加。Segura等[19]利用原代培养小鼠海马神经元观察低氧暴露对神经元树突结构的影响,发现低氧暴露后树突棘密度降低,长度增加,且无膨突伪足状树突棘比例增加。由此可见,低氧暴露可导致小鼠海马神经元树突结构的改变,提示树突棘结构改变可能与低氧暴露导致学习记忆功能损伤有关。
细丝蛋白A是细胞骨架蛋白细丝蛋白的亚型结构,在中枢神经系统中表达,参与维持神经元正常结构和功能[20]。以往研究表明细丝蛋白A参与树突形态发生[21],轴突生长锥形成[22]和神经元迁移[23]。在体外培养海马神经元中,改变细丝蛋白A表达水平可影响树突棘的结构[19]。本研究通过Western blot和免疫组织荧光染色方法检测慢性低压低氧暴露对小鼠海马CA1区细丝蛋白表达的影响,结果显示慢性低氧暴露导致细丝蛋白A表达降低,说明细丝蛋白A可能与低氧暴露引起海马CA1区树突棘结构损伤的过程有关,是低氧损伤学习记忆功能的分子机制之一。Western blot结果显示,低压低氧暴露14 d 后细丝蛋白A表达水平有一定程度恢复,而此时海马CA1区神经元树突棘的密度和长度与暴露7 d 组无明显差异,因此推测可能还有其它分子参与了低压低氧暴露导致的树突棘结构改变。以上结果提示,需进一步深入研究树突棘结构改变在低压低氧致学习记忆功能改变中的确切作用及其分子机制。
综上所述,慢性低压低氧暴露可导致小鼠海马CA1区椎体神经元树突棘结构改变,密度降低且长度增加,并影响CA1区细丝蛋白A的正常表达,提示细丝蛋白A表达降低可能与慢性低压低氧暴露影响CA1区神经元树突棘结构,进而影响小鼠学习记忆功能有关。
