棉田Cry1Ac蛋白降解菌株12T-103的分离鉴定及降解能力研究
2018-12-27
(塔里木大学植物科学学院,新疆 阿拉尔 843300)
棉花(GossypiumhirsutumL.)是新疆农业的重要经济作物和特色资源。转Bt棉产生的Cry1Ac杀虫蛋白可降低棉铃虫等害虫的为害程度,减轻农药对环境的污染。因其优势,转Bt基因棉种植面积日趋扩大[1]。但Cry1Ac杀虫蛋白可经转Cry1Ac基因作物根系分泌物或作物残留等形式进入土壤生态系统,残留于土壤而影响土壤微生物类群和多样性[2]。Cry1Ac蛋白与土壤颗粒紧密结合不易降解[3]。转Bt基因棉粉碎叶还土能促使土壤中细菌和真菌数量显著增加[4]。Cry1Ac杀虫蛋白对土壤生态环境的潜在安全风险也受到关注。
土壤生态环境也具一定抗风险能力。其土壤微生物可促进Bt蛋白的降解。从转Cry1Ac基因水稻种植田土壤中得到降解Cry1Ac蛋白的细菌FJSB3,为寡养单胞菌(Stenotrophomonassp.),4 d内水稻秸秆中Cry1Ac蛋白降解率达到92. 86%[5-6]。新疆阿克苏盐碱地土壤细菌资源丰富,已分离培养盐碱地土壤中的细菌103株[7],但目前新疆棉田Cry1Ac蛋白的降解研究鲜有报导。因此对Cry1Ac毒蛋白的降解细菌进行筛选和鉴定将可对长期种植转Bt棉田土壤的生态治理提供参考。
1 材料与方法
1.1 材料与试剂
棉田土壤:采集地为新疆建设兵团第一师十二团园林队棉田,以五点法取样法收集去除表层土壤2~3 cm后的土样。
主要试剂:蛋白胨和牛肉膏(均购置北京奥博星生物技术有限责任公司),十二烷基硫酸钠(SDS),NaCl、H2O2、磷酸氢二钾、磷酸二氢钾、溴酚蓝、甘油、甲醇和无水乙醇(均购置天津市致远化学试剂有限公司),琼脂(海南省琼海市长青琼脂厂),丙烯酰胺、过硫酸氨、甘氨酸(电泳级)、冰乙酸和考马斯亮蓝(R250)(均购置天津博迪化工股份有限公司),三羟甲基氨基甲烷(Tris,天津市鼎盛鑫化工有限公司),N,N′-亚甲基双丙烯酰胺和四甲基乙二胺(TEMED)(均购置天津市大茂化学试剂厂),Cry1Ac蛋白(纯度96%)及其酶联免疫试剂盒(上海佑隆生物科技有限公司)。
NA培养基:蛋白胨1%,牛肉膏0. 3%,NaCl 0. 5%,琼脂1. 5%,pH 7. 2~7. 4。
NB液体培养基:蛋白胨1%,牛肉膏0. 5%,NaCl 0.5%,pH 7. 2~7. 4。
蛋白质电泳试剂:30%丙烯酰胺溶液(丙烯酰胺30 g,N,N’-亚甲基双丙烯酰胺0. 8 g,去离子水100 mL,滤纸过滤于棕色瓶,室温保存,pH小于7);十二烷基硫酸钠(十二烷基硫酸钠SDS10 g溶于100 mL去离子水配制,室温保存);10%过硫酸氨(用去离子水配制少量10%(m/V)的贮存液,4 ℃保存,现配现用);分离胶缓冲液(Tris-HCl pH8. 8:Tris 碱1.5 mol/L,用盐酸调至pH8. 8);浓缩胶缓冲液(Tris-HCl pH6. 8:Tris碱1. 0 mol/L,用盐酸调至pH6. 8);Tris-甘氮酸电泳缓冲液(Tris碱15. 1 g,甘氨酸94. 0 g,SDS 5. 0 g,加去离子水至1 000 mL,用时按1∶5稀释,室温保存);考马斯亮蓝R250染色液(取0. 25%考马斯亮蓝R250 1. 25 g,溶解于500 mL混合液中,过滤并室温保存);脱色液(脱色液比例按甲醇∶去离子水∶冰乙酸=45∶45∶10,混匀室温保存)。
1.2 主要仪器
蛋白质电泳仪(北京六一生物科技有限公司)、恒温恒湿培养箱(宁波赛福实验仪器有限公司)、Sky-1102C 型全温度恒温摇床培养箱(上海苏坤实业有限公司)、FC型酶标仪(赛默飞世尔仪器有限公司)、超纯水机(成都优普生物科技有限公司)、PCR扩增仪(德国耶拿分析仪器股份公司) 。
1.3 试验方法
1.3.1 Cry1Ac蛋白降解菌株的分离与纯化
土壤细菌分离纯化参照赵辉欣等方法[5-6],将采集的土壤样品均匀混合后称取10 g溶于90 mL无菌水中,摇匀,将菌悬液用无菌水按10倍比例稀释(10-1、10-2、10-3、10-4、10-5、10-6、10-7),并分别取各梯度稀释液100 μL涂布于NA培养基上,置于28 ℃恒温培养箱,48 h后观察。在培养基上用接种环挑取大小、颜色、形态各异的菌落,划线分离后挑取单菌落纯培养48 h。挑取纯化后的单菌落1环接入NB液体培养基中,并置于恒温摇床培养箱(37 ℃,200 rpm,48 h),即为待测菌株。
1.3.2 Cry1Ac蛋白降解菌株的筛选
菌株降解Cry1Ac蛋白的方法参照赵辉欣等方法[5-6]。取培养的待测菌株1 mL,5 000 r/min离心5 min,取上清液10 μL与Cry1Ac蛋白(16 μg/L)90 μL混合,水浴37 ℃,4 h。取反应液50 μL加入2×SDS上样缓冲液,混匀后水浴100 ℃,5 min,取15 μL作为蛋白质电泳待测液。无菌蒸馏水作为空白对照。
蛋白质凝胶电泳方法[5-6]:(1)先制备8%分离胶,再制备5%浓缩胶;(2)用微量进样器往凝胶梳孔中加蛋白质电泳待测液15 μL、标准蛋白Marker。(3)电泳先用电压60 V 浓缩后进入分离胶,再增到120 V 至电泳结束。(4)采用考马斯亮蓝染色、甲醇-乙酸溶液脱色及凝胶成像。(5)降解菌的判别依据为蛋白质条带有无表示Cry1Ac蛋白已被降解与否。
1.3.3 菌株的鉴定
参照《伯杰氏细菌鉴定手册》采用常规细菌鉴定方法[8]对菌株的形态观察,通过对菌株16S rDNA分子检测技术对其鉴定。首先取待测菌悬液3 mL,10 000 r/min、4 ℃离心5 min,弃去上清液,对细菌总DNA提取并作为PCR扩增模板,以16S rDNA扩增通用引物,27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1541R:5′-AAGGAGGTGATCCAGCCGCA-3′。PCR反应条件:95 ℃ 3 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 90 s,循环35次;72 ℃延伸10 min[5-6]。PCR产物采用胶回收试剂盒纯化后测序(由上海生工公司完成)。将测序结果与NCBI进行同源比较。
1.3.4 降解菌株对Cry1Ac蛋白降解能力的测定
取已筛选的待测菌株1 mL,5 000 r/min离心5 min,取上清液10 μL与Cry1Ac蛋白(16 μg/L)90 μL混合,水浴37 ℃,于0 h、1 h、2 h时段取出样品。采用酶联免疫(ELISA)法定量分析Cry1Ac蛋白含量,分析降解菌对Cry1Ac蛋白在不同时间的降解作用能力。
1.3.5 数据处理
采用Excel 2007和SPSS 17.0软件进行数据处理和多重比较(Duncan氏新复极差法)分析。
2 结果与分析
2.1 Cry1Ac蛋白降解菌株的分离与筛选
分离培养的100-111号菌株中,103号菌株处理无明显电泳条带显示,而其他11种菌株均呈现不同亮度的电泳条带(图1)。经验证表明12T-103菌株处理依然无明显电泳条带显示(图2)。这说明103菌株能明显的降解Cry1Ac蛋白,命名为12T-103菌株。另外,Cry1Ac蛋白标准品、无菌水处理和各菌株处理均在70 kDa附近有明显电泳条带,Cry1Ac蛋白标准品分子质量约70 kDa。

图1 Cry1Ac蛋白降解菌株的初步筛选电泳图图2 12T-103菌株降解Cry1Ac蛋白验证电泳图
(左至右,1为Cry1Ac蛋白标准品,2为无菌水处理,M为 (左至右,1为Marker,2~4为Cry1Ac蛋白标准品,5~7为Marker,3~14分别为100-111号菌株) 无菌水处理,8~10为12T-103菌株,11~13为12T-111菌株对照)
2.2 Cry1Ac蛋白降解菌株的特征及鉴定

表1 12T-103菌株菌落形态与生理生化特征
12T-103菌株菌落的形态特征为菌淡黄色,不透明,边缘有一圈不规则裂纹,中央凸起(见图4),菌体特征为杆状,产生内生芽孢(见图4)。革兰氏染色为阳性,接触酶反应为阳性(见表1)。这表明12T-103菌株属于芽孢杆菌属(Bacillus)。此外,利用细菌16S rDNA通用引物扩增12T-103菌株总DNA,扩增产物长度约1. 5 kb,将测序结果与NCBI进行同源比较得出12T-103菌株与Bacillussubtilis(登录号KC441788.1)同源性为100%。由此鉴定12T-103菌株为枯草芽孢杆菌(Bacillussubtilis)。
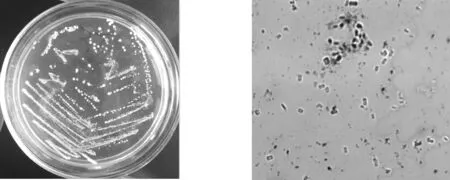
图3 12T-103菌株分离及菌落形态图4 12T-103菌株100倍油镜
2.3 12T-103菌株对Cry1Ac蛋白降解能力的测定

表2 不同时间12T-103菌株对Cry1Ac蛋白降解含量的测定
由表2可知,在1h时12T-103菌株对Cry1Ac蛋白降解降较为明显,由15. 95 μg·L-1降低至0. 68 μg·L-1,降低程度达极显著水平(p<0. 01),其降解率达92. 26%,此后12T-103菌株对Cry1Ac蛋白降解较为缓慢且不显著。由此,12T-103菌株对Cry1Ac蛋白的降解能力较强。
3 讨论
从12团棉田土壤中分离和纯化82种菌株,经蛋白质凝胶电泳筛选出12T-103菌株对Cry1Ac蛋白降解能力较强,该菌株为枯草芽孢杆菌(Bacillussubtilis),其1 h的降解率达92. 26%。这与赵辉欣等报道降解Cry1Ac蛋白的细菌为寡养单胞菌(Stenotrophomonassp.),4 d内稻秸秆中Cry1Ac蛋白降解率达到92. 86%[5-6]结果不同,因采集的水稻土壤细菌多样性以及稻秸秆试材的不同而呈现不同结果。另外,本试验未鉴定和分析棉田土壤其他菌株种类和降解能力,但从电泳条带亮度可判断,其他菌株也对Cry1Ac蛋白仍具不同程度的降解能力。转Cry1Ac基因棉土壤中Cry1Ac蛋白的细菌降解种类和能力有待进一步研究。
此外,枯草芽孢杆菌对蛋白的降解能力较强。从养殖池塘底泥中分离的枯草芽孢杆菌也作为降解饲料蛋白菌剂,并采用紫外诱变提升蛋白酶活性[9],通过高温发酵提高发酵液中蛋白质的降解率[10]。另外,新疆阿克苏盐碱地土壤中可培养的优势菌群为芽孢杆菌属(36. 27%)、链霉菌(10.8%)、微球菌属(6.9%)等[7],采用变性梯度凝胶电泳分析芽孢杆菌目也为优势菌群[11],由此推测芽孢杆菌属菌群对土壤中Cry1Ac蛋白降解可能具有较大贡献。芽孢杆菌属菌群与Cry1Ac蛋白降解特性还需深入研究。
4 结论
棉田Cry1Ac蛋白土壤降解菌12T-103为枯草芽孢杆菌(Bacillussubtilis),该菌对降解Cry1Ac蛋白能力较强,在1 h的降解率为92. 26%。
