类芽孢杆菌WY-01发酵生产低温β -甘露聚糖酶培养基的研究
2018-12-26李晓艳迟乃玉王一茜
李晓艳, 迟乃玉, 王一茜
(大连大学 生命科学与技术学院, 辽宁 大连 116622)
0 引 言
半纤维素是自然界中第2大类杂聚多糖,其中β -甘露聚糖是一种主要的半纤维素。甘露聚糖广存在于槐豆胶、瓜尔豆胶、魔芋精粉和其他植物多糖中[1],β -甘露聚糖酶(β-1,4-D-mannan mannohydrolase,EC 3.2.1.78)能够水解含有β-1,4-D-甘露糖苷键的多聚糖(如均一甘露聚糖、半乳甘露聚糖、葡甘露聚糖)为甘露低聚糖的酶[2]。甘露低聚糖有良好的生物调节功能,能够有效降低人体血糖[3]、胆固醇,作为双歧因子能够促进肠道中双歧杆菌的生长,改善菌群结构,减少有害细菌的产生,是良好的食品添加剂[4]。作为一种新型工业用酶,β -甘露聚糖酶酶广泛应用于饲料、造纸、纺织印染、石油开采和生物学研究等诸多方面[4-7]。
β -甘露聚糖酶广泛存在于植物、动物、人类的肠道中,但微生物来源的酶具有成本低,生产周期短、产酶活性高的特点,多年来一直是国内外研究和应用的热点。国内外研究主要集中在中高温产酶菌株的选育[1,8]、产酶条件的优化[9-11]、酶的制备工艺优化[12-13]、酶基因克隆与表达[14-16]等方面。国外(Yutaka Tamaru,O.Politz)[17-18]对海洋细菌β -甘露聚糖酶基因进行研究,国内张云光等[19]对海洋细菌β -甘露聚糖酶进行菌株筛选研究,得到最适作用温度30 ℃产酶菌株。低温酶具有低温高催化活性、高效结构柔顺性、热不稳定性等特点,使其在应用上比中温酶、高温酶更有优势。近几年来,低温脂肪酶、纤维素酶、蛋白酶等多种低温酶已经实现产业化生产,低温β -甘露聚糖酶研究与开发是大势所趋。
本文以辽宁省海洋微生物工程技术中心从海泥中筛选的产低温β -甘露聚糖酶的类芽孢杆菌WY-01为研究对象,通过单因素实验,对其产酶培养基进行研究,提高其产酶量,为低温β -甘露聚糖酶的酶学特性及应用研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌株:类芽孢杆菌WY-01筛选自海泥,保藏至辽宁省海洋微生物工程技术研究中心。
1.1.2 培养基:斜面培养基(g/L):瓜豆胶 10,琼脂粉15,氯化钠20,pH自然,115 ℃ 0.056 MPa灭菌20 min。
种子培养基(g/L):魔芋粉 10,酵母膏5,蛋白胨3,硫酸镁0.3,氯化钾5,磷酸氢二钾1,硫酸亚铁0.01,pH自然,115 ℃ 0.056 MPa灭菌20 min。
发酵培养基(g/L):魔芋粉5,蛋白胨5,磷酸氢二钾1,氯化钠10,氯化钾6,硫酸镁5,pH自然,115 ℃ 0.056 MPa灭菌20 min。
1.1.3 主要试剂及仪器:魔芋粉、瓜豆胶、蛋白胨、酵母膏等购自Sigma公司,其他试剂均为分析纯试剂;LRH系列培养箱、HWS24型电热恒温水浴锅,购自上海一恒科学仪器有限公司;HZP-256全温振荡培养箱,购自武汉建伟生物科技有限公司。
1.2 培养方法
1.2.1 菌株活化:用灭菌的牙签挑取保存菌株接种于固体种子培养基,置于恒温培养箱中,25 ℃培养活化。
1.2.2 种子培养:挑取单菌落接种于5 mL液体种子培养基中,于25 ℃、180 r/min恒温振荡培养12 h。按3%接种量将一级种子液接入100 mL液体种子培养基,于25 ℃、180 r/min恒温振荡培养12 h为二级种子液。
在线条上,画面下半部分我都是选择一些比较圆滑的线条,例如海面上的波浪,沙滩上的波纹。而画面上半部分我则是选择了一些顿一些、起伏不太明显的线条来维持整个画面的对比关系。但是这些线条也远远不够,所以我还在这些线条的基础上做了其他的更微妙的线条,例如画面中的人物、花草及鸟类。这样一些细小的、微妙的线条也能打破之前的一些形状,这样的碰撞对于整个画面来说也是好的。在初期定草图的时候,我将海浪的起伏感、立体感定位重点之一,将其起伏变化都进行了反复修改,线条的穿插、长短都是画面成功与否的关键。
1.2.3 发酵培养:按3%接种量将二级种子液接入发酵培养基中,25 ℃、180 r/min恒温振荡培养22 h。
1.3 酶活的测定方法
1.3.1 底物的处理:粗魔芋粉中含有还原糖,需进行预处理使其变为精魔芋粉,测定酶活时作为底物使用。将魔芋粉浸泡于75%酒精中,24 h后换酒精,再浸泡4 d,用斐林试剂检测无还原糖后,加入pH 6.0的磷酸钠缓冲溶液中备用[20]。
1.3.2 制备粗酶液
250 mL的锥形瓶中配制100 mL发酵培养基,以3%的接种量接种,25 ℃、180 r/min恒温振荡培养22 h,用1 mL移液枪从发酵培养基中取1 mL发酵液于1.5 mL Tube管,4 ℃ 8 000 r/min离心10 min,上清液为粗酶液。
1.3.3 酶活的测定(DNS法)
在0.9 mL底物(将魔芋粉溶于pH 6.0的磷酸钠缓冲液中配制20 g/L的溶液作为底物)中加入0.1 mL的粗酶液,50 ℃水浴反应10 min。加入DNS试剂2.0 mL,沸水浴5 min显色,立即以流动水冷却至室温,加去离子水定容至10.0 mL,以空白液调零,在540 nm处测定吸光度。酶活力定义:每分钟产生1 μmol还原糖所需酶量。
1.4 实验设计
1.4.1 碳源种类:配制碳源种类分别为0.6%的魔芋粉、淀粉、麦芽、蔗糖、葡萄糖发酵培养基,灭菌后接种3%二级种子培养液25 ℃、180 r/min恒温振荡培养22 h后用DNS法测定酶活,每个处理做3个平行。
1.4.2 碳源浓度:魔芋粉为最佳碳源,浓度为0.2%、0.4%、0.6%、0.8%、1.0%配制发酵培养基,灭菌后接种3%二级种子培养液25 ℃、180 r/min恒温振荡培养22 h后用DNS法测定酶活,每个处理做3个平行。
1.4.4 有机氮源浓度:以蛋白胨作有机氮源,浓度设定为0.1%、0.2%、0.3%、0.4%配制培养基,灭菌后接种3%的二级种子培养液25 ℃、180 r/min恒温振荡培养22 h后用DNS法测定酶活,每个处理做3个平行。
无机氮源浓度:磷酸氢二铵作无机氮源,浓度设定为0.1%、0.2%、0.3%、0.4%配制培养基,灭菌后接种3%的二级种子培养液25 ℃、180 r/min恒温振荡培养22 h后用DNS法测定酶活,每个处理做3个平行。
1.4.5 有机氮源和无机氮源比例(复合氮源):以蛋白胨为有机氮源、磷酸氢二铵为无机氮源,有机氮源和无机氮源比例(复合氮源)设定为1∶1、2∶1、3∶1、4∶1、5∶1配制发酵培养基,灭菌后接种3%二级种子培养液25 ℃、180 r/min恒温振荡培养22 h后用DNS法测定酶活,每个处理做3个平行。
1.4.6 无机盐种类:在上述最佳优化条件下,0.02%的Na+、K+、Ca2+、Fe2+、Zn2+、Mg2+配制发酵培养基,灭菌后接种3%的二级种子培养液25 ℃、180 r/min恒温振荡培养22 h用DNS法测定酶活,每个处理做3个平行。
2 结果与分析
2.1 碳源种类及最佳碳源浓度对产酶的影响
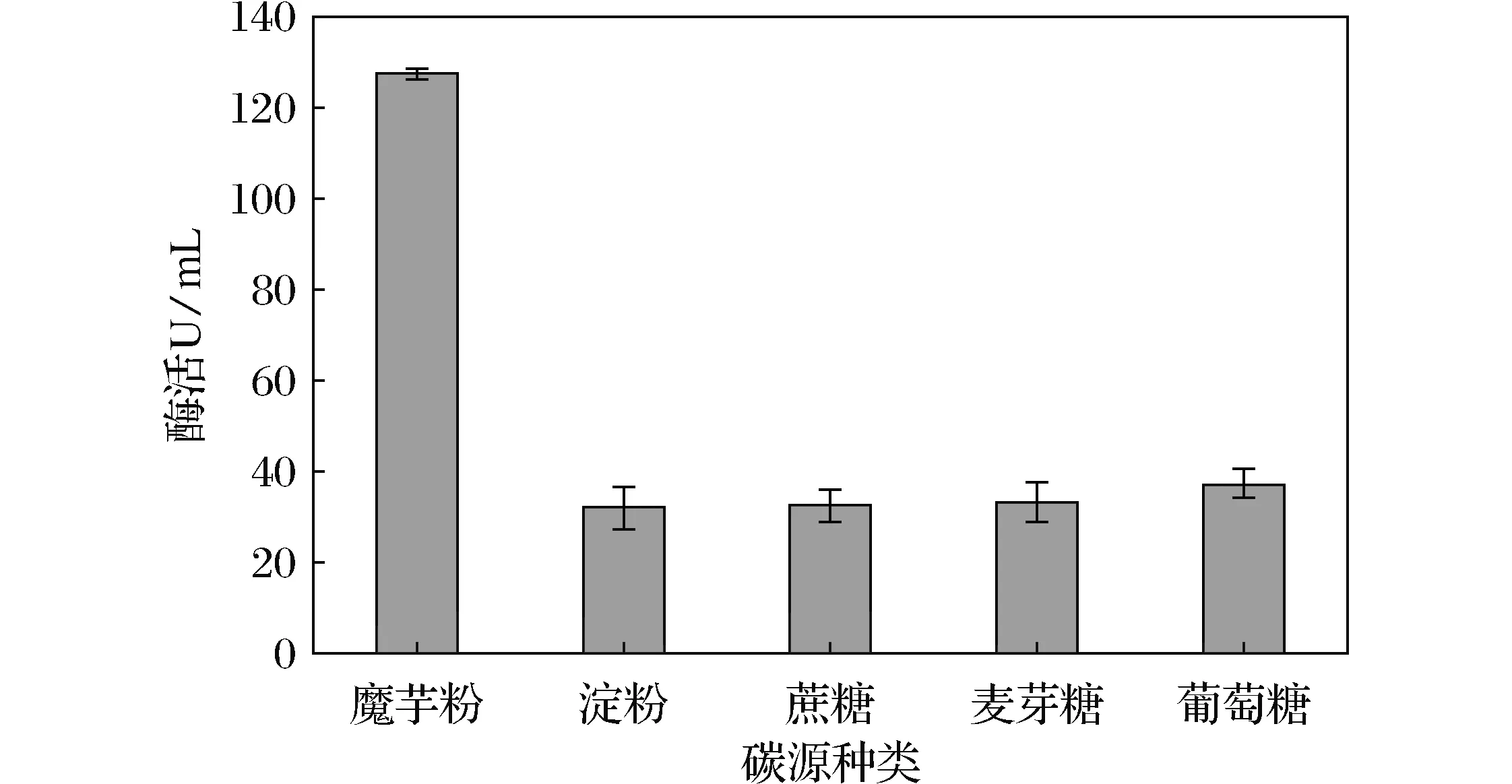
图1 碳源种类对产酶的影响Fig.1 Effect of carbon source kinds on enzyme production
对异养微生物来说,糖类物质能够提供碳素来源同时具有能源功能,不但影响菌株的生长,而且影响菌株代谢产物的形成。微生物碳源谱虽广,但对异氧微生物来说,利用糖类物质的一般规律是单糖优于双糖和多糖。由图1可知,多糖为魔芋粉和淀粉,双糖为蔗糖、麦芽糖,单糖为葡萄糖。在5种碳源物质中,菌株以魔芋粉为主要碳源,其发酵产生的β -甘露聚糖酶的量明显比其他4种碳源高,其酶活最高为127.71 U/mL,碳源物质为淀粉时酶活最低为32.2 U/mL。由此可见,多糖魔芋粉为其最优碳源。一方面是由于魔芋粉能提供碳素营养兼具能源功能,进而影响细菌WY-01的生长;另一方面β -甘露聚糖酶是菌株生理代谢的产物,它的产生需要魔芋粉作为诱导物进行诱导才能产生此酶。

图2 不同浓度魔芋粉对产酶的影响Fig.2 Effect of carbon source concentration on enzyme production
由图2可知,在魔芋粉浓度为0.2%~0.6%时,酶活随着魔芋粉浓度的升高而增大,0.6%时酶活达到最大值为274.65 U/mL;在魔芋粉浓度0.6%~1.0%时,酶活随着浓度的升高而降低。在魔芋粉浓度为0.2%时,酶活最低为220.41 U/mL。魔芋粉做为最佳碳素营养物质,含有葡苷聚糖。葡苷聚糖吸水性,粘性较强。发酵培养基中魔芋粉浓度过高,且具有较强的吸水性和粘性,使菌株生长环境的渗透压变大,菌株因环境渗透压变大而失去水分,影响菌株的生长和代谢产物的形成,影响β-甘露聚糖酶的合成及其产量;魔芋粉浓度过低,则菌株由于营养物质不足而影响生长与β -甘露聚糖酶的形成,进而影响产酶量,由此可确定发酵培养基中魔芋粉最佳浓度为0.6%。
2.2 氮源种类及最佳氮源浓度对产酶的影响
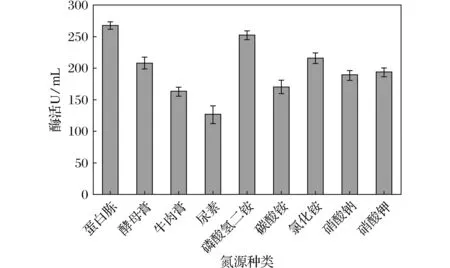
图3 氮源种类对产酶的影响Fig.3 Effect of nitrogen source kinds on enzyme production
氮源作为构成细菌生命的大分子物质核酸和蛋白质的主要营养物质,用来合成微生物细胞物质和含氮代谢物。微生物氮源谱广,分为无机氮源和有机氮源,无机氮源一般为速效性氮源,一般在菌体生长时吸收利用,菌体吸收快利于生长;有机氮源为迟效性氮源,一般在菌株形成次级代谢产物时利用,利于菌体代谢产物的形成。在发酵过程中选择合适种类有机氮源、无机氮源、或有机氮源与无机氮源比例即复合氮源种类及比例尤为重要。由图3可知,在4种有机氮源中,蛋白胨为最佳有机氮源,酶活最高达269.69 U/mL;在5种无机氮源中,磷酸氢二铵为最佳无机氮源,酶活最高达254.15 U/mL。类芽孢杆菌WY-01在发酵培养基中菌体生长期以吸收无机氮磷酸氢二铵为其主要氮源满足菌体生长需求,在β -甘露聚糖酶的形成时,以蛋白胨为有机氮源满足产物的需求。
由图4可知,在蛋白胨浓度为0.1%~0.2%时,酶活随浓度的升高而增大,0.2%达到最大值为228.25 U/mL;在蛋白胨0.3%~0.4%,随浓度升高,酶活下降,0.3%时酶活最低为172.46 U/mL。由此可确定最优单一有机氮源蛋白胨的浓度为0.2%。
由图5可知,在磷酸氢二铵浓度为0.1%~0.2%时,酶活随浓度升高而增大,在磷酸氢二铵浓度为0.2%时酶活达到最大值为204.15 U/mL,在磷酸氢二铵浓度为0.3%~0.4%,酶活随浓度升高而下降。磷酸氢二铵浓度0.1%时酶活最低为126.53 U/mL。由此确定最优单一无机氮源磷酸氢二铵浓度为0.2%。
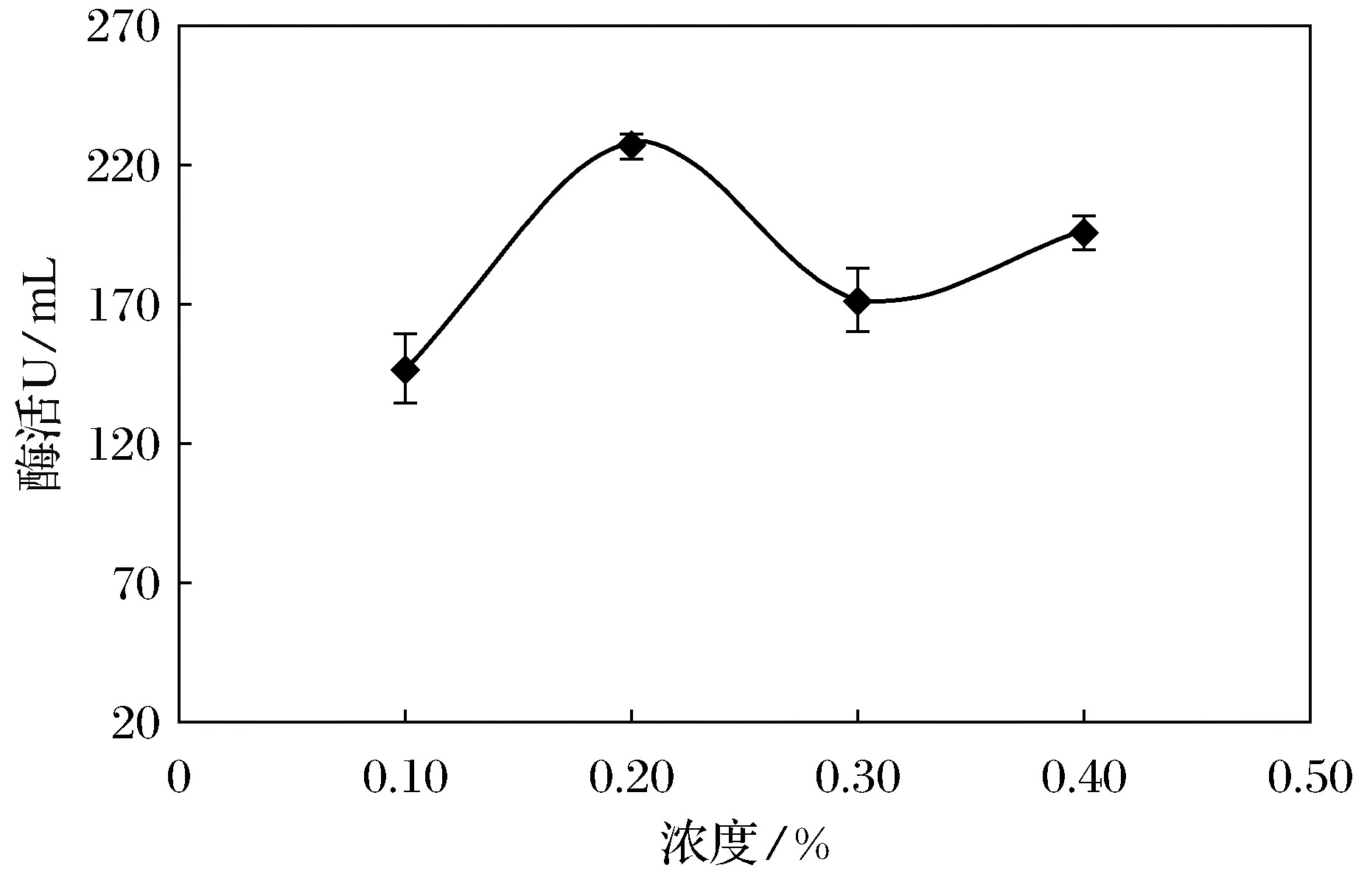
图4 不同浓度蛋白胨对产酶的影响
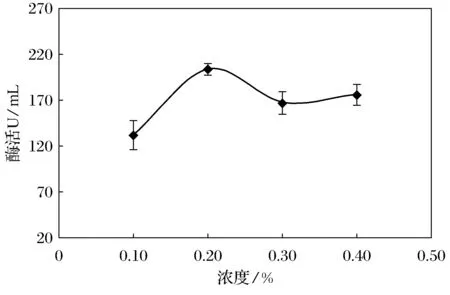
图5 不同浓度磷酸氢二铵对产酶的影响
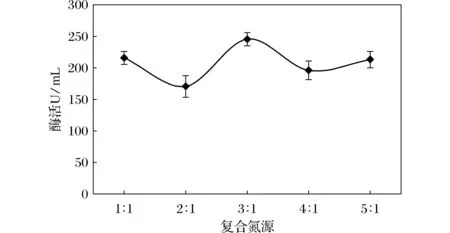
图6 复合氮源对产酶的影响Fig.6 Effect of complex nitrogen source on enzyme production
有机氮源选用蛋白胨,无机氮源选用磷酸氢二铵,且有机氮源与无机氮源比例分别为1∶1、2∶1、3∶1、4∶1、5∶1。由图6可知,复合氮源对产酶影响较大,当有机氮与无机氮的比例为3∶1时,酶活最高达246.24 U/mL;2∶1时酶活最低为170.98 U/mL。由此可确定复合氮源中有机氮源和无机氮源最优比例为3∶1。有机氮蛋白胨富含有机含氮的化合物,也含有糖类和一些维生素等营养成分,为类芽孢杆菌WY-01提供丰富的营养物质和生长因子,有机氮源的物质结构复杂,菌株利用较慢为迟效性氮源,在发酵不同阶段不同程度影响菌体的生长和代谢产物的形成。无机氮源的物质结构简单、利用快捷,可做速效性氮源,但在发酵后期,随着无机氮中的铵盐被吸收殆尽,发酵液中的pH值也会随之降低酸化,改变环境中pH,对酶的合成有一定的阻遏作用,而一定量有机氮源的存在,在不同程度上对环境pH改变有一定缓冲作用,同时促进代谢产物的形成,所以复合氮源效果最佳,优化最优的比例能更好的促进菌株生长及代谢产物的形成。
2.3 无机盐种类对产酶的影响
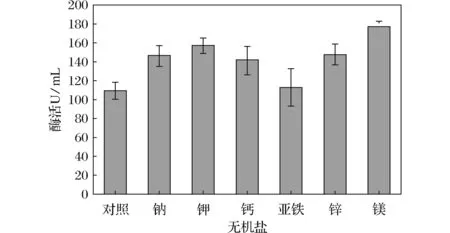
图7 无机盐种类对产酶的影响Fig.7 Effect of inorganic salt kinds on enzyme production
由图7可知,6种无机盐离子中,Fe2+对酶活明显无作用,Na+、K+、Ca2+、Zn2+、Mg2+对酶活有一定促进作用,统计分析表明, K+和Mg2+对酶活影响显著。无机盐是微生物生长必须的元素,一些无机盐构成细胞内一般分子成分;一些无机盐作为生理调节物质。有些无机盐作为微生物酶的激活剂,作用于微生物酶的活性部位,促进酶制剂的产生;有些无机盐作为酶的抑制剂,对产酶起一定程度的抑制作用。无机盐是影响产酶的重要因素。
2.4 在上述最佳发酵培养基条件下类芽孢杆菌WY-01发酵生产β-甘露聚糖酶的酶活测定
对类芽孢杆菌WY-01发酵生产低温β-甘露聚糖酶菌株培养基通过单因素实验研究魔芋粉浓度为0.6%,复合氮源浓度为0.2%,复合氮源蛋白胨与磷酸氢二铵的比例为3∶1,氯化钠0.1%,氯化钾0.6%,硫酸镁0.5%,在最佳发酵培养基条件下产酶活力达到276.24 U/mL,未优化前酶活最大为168.71 U/mL,是优化前的1.64倍。
3 结 论
对类芽孢杆菌WY-01发酵生产低温β -甘露聚糖酶的培养基进行单因素实验,从碳源种类、碳源的浓度,氮源种类、氮源浓度、有机氮源与无机氮源的比例、无机盐种类进行优化,提高其产酶量。结果表明:最佳碳源为魔芋粉,浓度为0.6%;最佳有机氮源为蛋白胨,浓度为0.2%,无机氮源为磷酸氢二铵,浓度为0.2%,有机氮源与无机氮源的比为3∶1。统计分析表明:Fe2+、Na+、Ca2+、Zn2+对产酶影响不显著,K+和Mg2+对产酶影响显著。在上述最佳营养条件下酶活力达276.24 U/mL,未优化前酶活最大为168.71 U/mL,是优化前的1.64倍,这一结论为类芽孢杆菌WY-01后期的发酵放大与潜在的工业化生产提供了理论参考。
