柯萨奇病毒 A16型抗原与呼吸道黏膜上皮组织内先天淋巴细胞的相互关系及其疫苗应用价值
2018-12-26王永蓉廉亚茹蒋国润范胜涛冯敏杨二霞姜莉董承红赵志梅王丽春廖芸张莹李琦涵
王永蓉,廉亚茹,,蒋国润,范胜涛,冯敏,杨二霞,姜莉,董承红,赵志梅,王丽春,廖芸,张莹,李琦涵
1. 中国医学科学院北京协和医学院医学生物学研究所,云南省传染病疫苗研发重点实验室,昆明 650118; 2. 艾美康淮生物制药(江苏)有限公司,泰州 225300
柯萨奇病毒A16型(coxsakievirus A16,CA16)作为肠道病毒家族成员之一[1],与肠道病毒71型(enterovirus 71,EV71)类似,是引起儿童手足口病(hand,foot and mouth disease,HFMD)的主要病原体[2-3],这两种病毒引起的HFMD病例达总病例的80%[4-5]。虽然EV71灭活疫苗已大规模推广应用[6],但其对CA16无交叉保护作用,因此CA16很可能成为今后儿童HFMD的主要病原[7],针对CA16的疫苗研究具有十分重要的意义[8]。
近年来,随着相关研究工作的推进,CA16疫苗研究已在多种技术层面取得进步[9-10],但CA16感染病理学及相关免疫学基础尚不清楚,迄今尚未取得实质性进展。本课题组前期有关CA16灭活疫苗的非人灵长类实验结果提示,CA16灭活疫苗以常规模式难以获得良好的有效免疫反应,尤其是在病毒攻击时未能表现出有效的临床保护效果[11]。尽管这一动物模型结果尚不能完全模拟CA16在人体内的感染与免疫过程,但深入探讨其免疫学机制十分必要。
大量人群流行病学和临床观察及本课题组前期动物模型实验结果提示,CA16和EV71均可通过呼吸系统导致感染[12-14]。呼吸道上皮组织作为具有天然免疫功能的器官,在机体抗病毒感染免疫反应的激活中发挥着重要作用[15-16]。近期受到人们关注的天然淋巴细胞(innate lymphoid cell,ILC)则是完成这一作用的主要成分之一[17]。ILC分为3个型别:ILC1、ILC及 ILC3。它们可由多种信号通路分子活化,包括表达于上皮细胞表面的干扰素(interferon,IFN)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α)家族信号通路分子。受到病毒刺激时,ILC表面与这些信号分子结合的受体表达量会增加,以调节或整合天然免疫与适应性免疫,甚至非特异炎症效应[18-19]。尽管ILC在机体抵抗病原体入侵免疫应答中的作用尚未完全清楚,但ILC缺失小鼠在病原体感染时不能提供有效的免疫保护,表明其在机体抵抗病原体的免疫反应中发挥关键作用[20-22]。
本研究利用组织培养体系和BALB/c小鼠模型,初步分析CA16抗原与ILC的相互关系及由此形成的机体特异性免疫反应的特点,为进一步探索基于病毒感染模型而设计相应疫苗免疫模式的可能提供线索。
1 材料与方法
1.1 材料
1.1.1毒株及细胞CA16-G20株病毒从中国广西壮族自治区全州县的HFMD患儿咽拭子中分离,并经中国医学科学院医学生物学研究所培养、纯化及保存[11]。增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)标记的CA16(EGFP-CA16)由本实验室构建并保存。小鼠气管上皮细胞CP-M175购自武汉普诺赛生命科技有限公司。
1.1.2主要试剂及设备TriZol试剂、DAB试剂购自天根生化科技(北京)有限公司,One-Step PrimeScript RT-PCR Kit购自日本TaKaRa公司,CA16抗体、细胞特异性表面标记KLRG1和CD11c、白细胞介素13(interleukin 13,IL-13)、TNF-α、IFN-γ、特异性荧光二抗等购自英国Abcam公司,GATA-3购自美国Santa Cruz公司,NKP46购自BioLegend 公司,视黄酸相关孤儿受体γt(retinoid-related orphan receptor γt,RORγt)、 4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)购自美国BD公司,Areg、白细胞介素1β(interleukin 1β, IL-1β)购自美国R&D Systems公司,IL-22购自美国Novus公司,牛血清白蛋白(bovine serum albumin,BSA)、苏木素购自美国Sigma公司,淋巴细胞分离液购自北京索莱宝科技有限公司,小鼠IFN-γ酶联免疫斑点试验(enzyme-linked immunospot assay,ELISPOT)试剂盒购自美国Mabtech公司。实验使用的主要仪器为实时定量PCR仪(CFX ConnectTMReal-Time PCR Detection System;Bio-Rad,美国)、冷冻切片机(Thermo,美国)、TCS SP8荧光共聚焦显微镜(Leica,德国)和C.T.L酶联免疫斑点读板机(Cellular Technology Limited,美国)。
1.1.3实验动物实验用BALB/c小鼠购于北京维通利华生物公司。动物实验方案均由中国医学科学院医学生物学研究所动物伦理委员会审核通过,饲养管理等均符合动物福利要求。
1.2 方法
1.2.1细胞培养Vero细胞由含10%新生牛血清的MEM培养基培养,16HBE细胞由含10%胎牛血清(fetal bovine serum,FBS)的DMEM培养基培养,CP-M175细胞培养在特别配制的完全培养基(CM-M175)中。
1.2.2CA16灭活抗原的制备与疫苗配方抗原灭活、纯化方法如文献所述[23],然后按两种方式进行实验用疫苗的制备:①病毒抗原(400 EU/1.0 mL)与Al(OH)3佐剂(1 mg/mL)混合制备;②病毒抗原(400 EU/1.0 mL)与一种缓冲液(含1%角鲨烯、3%丙三醇和5%蔗糖)混合配制。
1.2.3病毒纯化采用噬斑纯化法对病毒进行纯化。将病毒样本连续10倍稀释,取不同稀释度的病毒液接种于细胞,于37 ℃孵育1 h,移去上清液,每孔加入含1×DMEM、3% FBS及1%琼脂的混合试剂,于37 ℃孵育7 d,以多聚甲醛固定,0.1% 结晶紫染色[24]。
1.2.4定量反转录-聚合酶链反应(quantitativereversetranscription-polymerasechainreaction,qRT-PCR) 利用TriZol试剂对样品RNA进行抽提。qRT-PCR按One-Step PrimeScript RT-PCR 试剂盒说明操作,特异性引物序列详见表1。在CFX ConnectTMReal-Time PCR Detection System仪上进行扩增,条件为42 ℃ 5 min,95 ℃ 10 s,95 ℃ 5 s,Tm 30 s,40个循环。以相对定量法计算各信号分子的表达量,内参基因为GAPDH,采用2-ΔΔCt法计算。
表1PCR引物序列
Tab.1SequencesofprimersforPCR

GeneSequence (5' to 3')H-4-1BBL-FACTCCTGGACTTAGACGATH-4-1BBL-RGCTGGCACATTACAGATGH-BTLA-FCAAGTTGGAAGGAAGAGAAGAH-BTLA-RGCAGAACAGCGGTATGACH-CD160-FGGATAGATGGTGTTGGTGAAH-CD160-RCCTGACTTCTGGCTTCTGH-GITRL-FCAATTAGAGACTGCTAAGGAGH-GITRL-RAGGTTCAGAAGATGCCATTH-IKKα-FATACAGCGAGCAGATGACH-IKKα-RCAACCTCAGCATAGTGGATH-IKKβ-FCATTGTTGTTAGCGAAGACTH-IKKβ-RGCCAGGACACTGTTAAGATH-LIGHT-FTCTTGCTGTTGTTCATTGCH-LIGHT-RCCTTCTTGGATGCTTCATTCH-LTα3-FGATGTCTGTCTGGCTGAGH-LTα3-RCCTGCTCTTCCTCTGTGTH-NIK-FCCGAGAAGAAGTCCACTGH-NIK-RGTCTGCTTGTCCTCCATCH-OX40L-FATGAGTCAAGGAGTGTAACCH-OX40L-RATGGCTGAGGAAGATGTAAGH-RANKL-FGGAGGAAGCACCAAGTATTH-RANKL-RCCTCTCCAGACCGTAACTH-TAK-FCCAACCAGAGTCGCAATCH-TAK-RGCAAGTCACATAGCAGAAGAH-TLIA-FAAGCCAGACTCCATCACTH-TLIA-RTACCTACTTCGCATACAGAC

(续表1)

(续表1)
1.2.5小鼠实验分组及免疫体外实验:鼻腔途径免疫4周龄小鼠(100 EU/只)。免疫后第1、2、3天分别处死小鼠,采集口、鼻、肺组织,进行RNA提取和组织切片,用于qRT-PCR、免疫组织化学和免疫荧光检测。体内实验:将4周龄小鼠分为A、B、C、D四个组,进行两次免疫(每次100 EU/只),间隔28 d。A组两次免疫均采用肌内注射;B组初次免疫采用肌内注射,加强免疫采用鼻腔途径;C组采用鼻腔途径仅进行一次免疫;D组两次免疫均采用鼻腔途径。于免疫前,一次免疫后14、28 d,二次免疫后7、14、28 d分别采血,分离血清,进行中和抗体测定。另外,于初次免疫后第28天和加强免疫后第1、3、5天分别处死小鼠,取脾脏,分离淋巴细胞,进行ELISPOT实验。于全程免疫后第56天,对免疫组的雌鼠与非免疫组的正常雄鼠交配产下的乳鼠(24 h内)以颅内注射CA16(2×104CCID50/只)方式攻击,每日观察乳鼠活动、进食情况及生存率。
(1)为保持开挖后基岩的完整性和开挖面的平整度,对岩质基础、边坡、马道的所有轮廓线上的垂直、斜坡面必须采用控制爆破。
1.2.6共聚焦显微镜检测利用冷冻切片机将保存于液氮中的组织样品切成薄片,丙酮固定,然后进行抗原封闭(5% BSA溶液),孵育特异性一抗,清洗,再孵育荧光标记的二抗,清洗,滴加DAPI,用荧光共聚焦显微镜观察。
1.2.7免疫组织化学检测组织切片用丙酮固定,置于3% H2O2中去除内源性过氧化物酶,然后以5% BSA封闭,随后分别孵育特异性一抗和相应二抗,清洗,滴加DAB,以苏木素复染,置于显微镜下观察。
1.2.8中和抗体检测按标准试验方案倍比稀释血清样本,用于中和抗体检测[23]。将不同稀释度的血清与病毒液(每孔300 CCID50/100 μL)于37 ℃孵育1 h,加入Vero细胞,37 ℃培养7 d,每日观察细胞病变效应(cytopathic effect,CPE)。
1.2.9ELISPOT实验采用淋巴细胞分离液,从小鼠脾脏中分离淋巴细胞。按IFN-γ ELISPOT试剂盒说明书操作,加入纯化的CA16灭活抗原(20 EU/孔)刺激,利用酶联免疫斑点读板机检测分泌IFN-γ的淋巴细胞数量。
1.3 统计学分析
采用SPSS 19.0软件对数据进行统计分析。采用两独立样本均数t检验比较基因相对表达量,生存率采用log-rank法分析,P<0.05 为差异有显著意义。
2 结果
2.1 CA16感染16HBE后上调ILC激活相关信号分子的表达
本课题组前期研究证实,CA16可感染包括呼吸道上皮细胞在内的人类多种细胞[25-26]。本研究用CA16感染体外培养的人支气管上皮细胞16HBE,感染复数(multiplicity of infection,MOI)为 0.1~0.2 时,CA16可引起16HBE细胞发生病变(图1A),伴随细胞逐渐肿胀变圆及从培养瓶底部脱落这一过程的是病毒动力学增殖过程(图1B)。呼吸道上皮细胞表面表达多种受体,如模式识别受体(pattern recognition receptor,PRR)、病原体相关分子模式(pathogen-associated molecular pattern,PAMP)和能激活免疫细胞的信号分子[27-28]。通过这些受体行使功能,呼吸道上皮细胞在天然免疫中发挥着十分重要的作用。用CA16(MOI=1)感染人支气管上皮细胞后,检测上皮细胞表达的ILC激活相关重要信号分子的转录水平,包括IFN和TNF家族。结果显示,在CA16感染早期,16HBE细胞就上调了针对ILC活化的信号分子表达,包括TNF-α、RANKL、GITRL、LIGHT。相较之下,IFN-α上调程度较低,而IFN-λ表达水平明显上升(图1C)。结果提示, CA16感染气管内具有重要天然免疫启动作用的上皮细胞的过程实际上是一个上调组织内激活天然免疫系统信号分子的阶段。
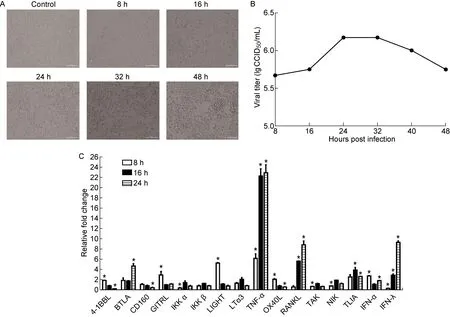
A: Typical cytopathic effects of 16HBE cells during CA16 infection. The sample was obtained at 8, 16, 24, 32 and 48 h after CA16 infection. B: Viral dynamic proliferation in 16HBE cells. C: Expression of signaling molecules that activate ILCs in CA16-infected 16HBE cells. The sample was obtained at 8, 16 and 24 h after CA16 infection. The results were normalized to the level of endogenous GAPDH. The y-axis indicates the relative quantity of specific mRNA in the samples compared with the same gene in the control group (uninfected cells, y=1). Error bars indicate the SEM of the relative quantities.*P<0.05.
图1CA16感染人气管上皮细胞16HBE的生物学特性
Fig.1BiologicalanalysisofCA16infectioninhumantrachealepithelial16HBEcells
2.2 CA16抗原导入CP-M175后上调ILC激活相关信号分子的表达
进一步探讨CA16抗原或灭活的CA16是否也能模拟活病毒对ILC的激活起刺激作用,从而为后续能在动物模型中揭示其诱导免疫反应机制提供一定的基础。然而,成年小鼠体内缺乏CA16受体而对CA16不易感,因此采用特别配制的类脂性试剂与CA16灭活病毒制备实验用疫苗,研究CA16抗原与小鼠气管上皮细胞系CP-M175的相互作用。
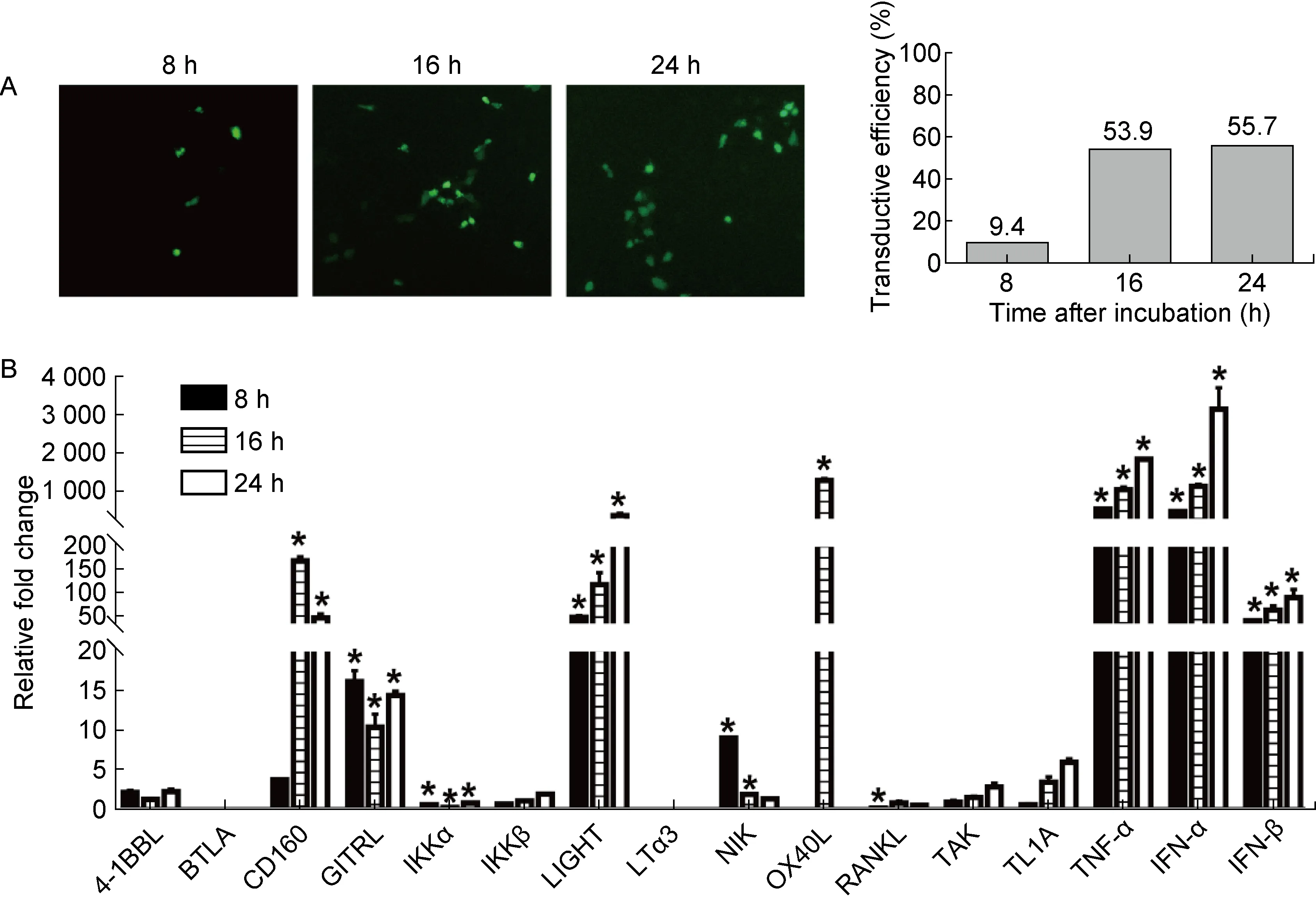
A: Transduction efficiency of CA16 antigen in CP-M175 cells. The fluorescence intensity was scanned by gray-scale software. The sample was obtained at 8, 16 and 24 h after CA16 infection. B: Expression of signaling molecules that activate ILCs in CA16-infected CP-M175 cells. The sample was obtained at 8, 16 and 24 h after CA16 infection. The results were normalized to the level of endogenous GAPDH. The y-axis indicates the relative quantity of the specific mRNA in the samples compared with the same gene in the control group [cells treated with specific buffer (containing 1% squalene, 3% glycerol, 5% sucrose) but without viral antigen, y=1]. Error bars indicate the SEM of the relative quantities.*P<0.05.
图2灭活的CA16颗粒内化到小鼠呼吸道CP-M175细胞中上调ILC激活相关信号分子的表达
Fig.2InactivatedCA16virusparticlesinternalizedintomouseepithelialCP-M175cellsupregulatesignalingmoleculesforILCactivation
2.3 CA16抗原在呼吸道上皮组织中的分布及相关信号分子表达
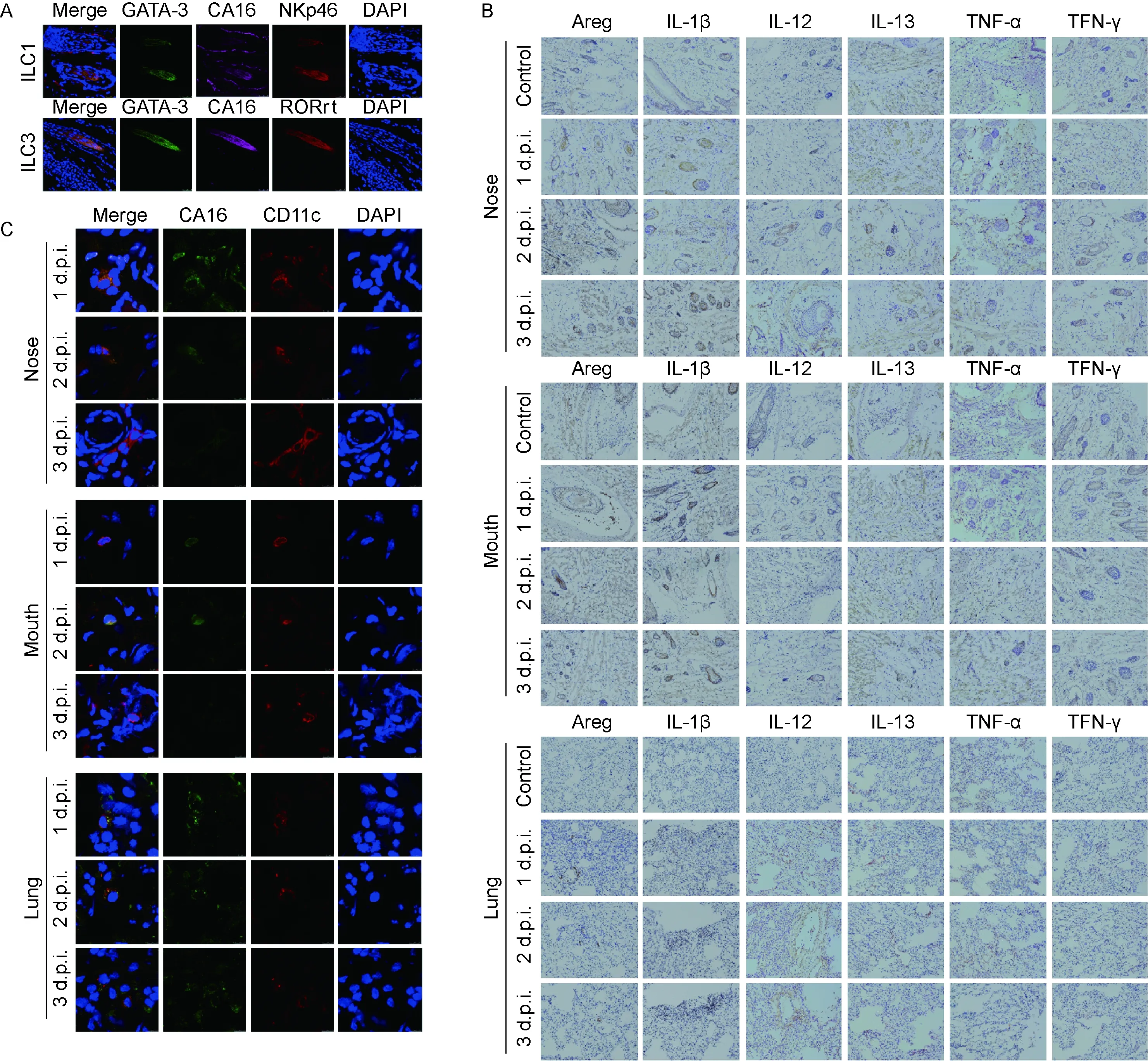
上皮细胞可通过分泌功能分子与免疫细胞相互作用来调节天然免疫和适应性免疫[29]。为进一步研究CA16抗原与ILC的相互作用,采用特别配制的CA16灭活实验疫苗通过鼻腔途径免疫BALB/c小鼠,以模拟病毒在自然情况下的感染。于免疫后第1、2、3天,分别处死小鼠,检测呼吸道组织包括鼻腔、口腔和肺组织病毒抗原分布及对ILC有激活作用的信号通路分子的表达量。结果显示,抗原经鼻腔免疫后3 d内,呼吸道黏膜组织中可观察到CA16抗原广泛分布(图3A)。此外,对ILC有激活作用的多种信号通路分子mRNA均出现明显上调,包括TNF-α、RANKL、CD160、LIGHT及GITRL(图3B)。这与CA16感染人上皮细胞时出现的ILC激活相关信号分子表达趋势类似。这些基因高表达区域主要集中于上呼吸道,特别是口腔和鼻腔组织;而肺组织中只有TNF-α出现较高表达(图3B)。此外,还检测了各类ILC活化后分泌的细胞因子表达水平(图3C)。口腔和鼻腔组织中ILC分泌的各种细胞因子基因表达趋势类似,但鼻腔组织中的表达水平高于口腔;肺组织中仅IL-22、IL-25、IL-1β及Areg表达升高。结果表明,CA16抗原内化到呼吸道黏膜上皮细胞后,能被上皮细胞表面的PRR识别并上调ILC激活相关信号通路分子的表达,同时ILC分泌的各类细胞因子mRNA表达量明显升高。
2.4 CA16抗原进入呼吸道黏膜组织后与ILC及树突细胞(dendritic cell,DC)的相互关系
CA16抗原通过鼻腔途径免疫以模拟病毒自然感染途径从而激活机体的抗病毒免疫是笔者提出的一个假说,本研究的核心即揭示CA16抗原与天然免疫的相互关系。基于抗原免疫小鼠呼吸道黏膜组织中高水平的ILC激活相关信号通路分子表达,进一步检测病毒抗原与天然免疫系统,尤其是其与ILC和DC的相互作用。对3类具有不同特征分子的ILC[30]与CA16抗原的共定位观察表明,以GATA-3和NKp46为特征分子的ILC1在鼻腔黏膜组织中与CA16抗原共定位。与ILC1类似,在以GATA-3和RORγt为特征分子的ILC3中也观察到CA16抗原的存在(图4A)。但这种与CA16抗体共定位的关系并未在以GATA-3和KLRG-1为特征分子的 ILC2中观察到。与此同时,采用免疫组织化学方法检测ILC活化后分泌的细胞因子发现,伴随CA16抗原出现,部分细胞因子如Areg、IL-1β、IL-13、IL-12、TNF-α及IFN-γ分泌增加(图4B)。结果提示,CA16抗原进入呼吸道黏膜组织后,明显激活了ILC系统。此外,还观察到CD11c+DC与CA16抗原有共定位关系(图4C)。
2.5 CA16抗原经鼻腔免疫后在小鼠体内诱导的免疫反应
上述实验结果表明,特殊佐剂介导的CA16灭活抗原经鼻腔途径免疫可有效激活呼吸道组织中的ILC等天然免疫系统。据此提出疑问:ILC的免疫应答是否能引起特异性的抗病毒免疫应答从而保护机体?因此,进一步比较4种免疫方式的小鼠体内中和抗体和细胞免疫反应指标。结果显示,单纯的一次或两次鼻腔免疫均可诱导小鼠抗CA16的血清中和抗体,但显然仅进行一次免疫诱导的抗体效价较低,几何平均效价(geometric mean titer,GMT)仅为 1∶8 左右;而采用两次免疫可在第二次免疫4周后诱导出相对较高的中和抗体,GMT达 1∶16。两次肌内注射免疫可诱导更高的中和抗体,GMT达1∶64左右。然而,采用一次肌内注射免疫和一次鼻腔加强免疫的小鼠中,GMT达1∶128~1∶256(图5A)。同时,比较各组免疫小鼠脾淋巴细胞的IFN-γ特异性ELISPOT反应,结果表明抗原刺激后,各组小鼠均出现了明显的特异性IFN-γ反应细胞增殖(图5B)。在进一步的保护性实验中,采用不同方式免疫的雌鼠所产下的乳鼠受到病毒攻击时,显现出了不同生存率,其中以肌内注射首次免疫加鼻腔加强免疫的保护率最高,为100%(图5C)。乳鼠受病毒攻击后也表现出不同的临床症状,对照组所有乳鼠均出现四肢消瘦、麻痹的现象,其中 22.2% 死亡;而免疫组小鼠出现明显临床症状的比例相对较低(表2)。综上表明,CA16抗原通过与ILC相互作用启动了有效的抗病毒免疫反应。

A: Distribution of CA16 antigens in respiratory tract tissues. Samples from mouth, nose and lung tissues were obtained at 1, 2 and 3 d after inactivated CA16 vaccine immunization. B: Expression of signaling molecules that activate ILCs in respiratory tract tissues harvested from CA16-immunized mice. Mouth, nose and lung tissue samples were obtained at 1,2 and 3 d after inactivated CA16 vaccine immunization. The results were normalized to the level of endogenous GAPDH. The y-axis indicates the relative quantity of the specific mRNA in the samples compared with the same gene in the control group (immunized with specific buffer containing 1% squalene, 3% glycerol, 5% sucrose but without viral antigen, y=1). Error bars indicate the SEM of the relative quantities.*P<0.05. C: Expression of cytokines that were secreted by ILCs in respiratory tract tissues harvested from CA16-immunized mice. Mouth, nose and lung tissue samples were obtained at 1, 2 and 3 d after inactivated CA16 vaccine immunization. The results were normalized to the level of endogenous GAPDH. The y-axis indicates the relative quantity of the specific mRNA in the samples compared with the same gene in the control group [immunized with specific buffer (containing 1% squalene, 3% glycerol, 5% sucrose) but without viral antigen, y=1]. Error bars indicate the SEM of the relative quantities.*P<0.05.
图3CA16抗原在呼吸道组织中分布且上调ILC激活相关信号分子的表达
Fig.3CA16antigendistributedinrespiratorytracttissuesupregulatessignalingmoleculesforILCactivation
A: Confocal fluorescence microscopy of CA16 antigen and ILC1/ILC3 in respiratory mucosal tissues from CA16-immunized mice. Nose tissue samples were obtained at 2 d after inactivated CA16 vaccine immunization. B: Expression of immune molecules secreted by activated ILCs in respiratory tract tissues from CA16-immunized mice. Nose, mouth and lung tissue samples were obtained at 1, 2 and 3 d after inactivated CA16 vaccine immunization. Mice were immunized with specific buffer (containing 1% squalene, 3% glycerol, 5% sucrose) but without viral antigen in the control group. C: Confocal fluorescence microscopy of CA16 antigen and DCs in respiratory mucosal tissues from CA16-immunized mice. Nose, mouth and lung tissue samples were obtained at 1, 2 and 3 d after inactivated CA16 vaccine immunization.
图4CA16抗原与ILC和DC在呼吸道黏膜组织中的相互作用
Fig.4InterrelationshipsofCA16antigenwithILCsandDCsinrespiratorymucosaltissues
表2颅内注射病毒后乳鼠临床症状的比较
Tab.2Comparisonofclinicalsymptomsofneonatalratswithintracranialinjectionofvirus
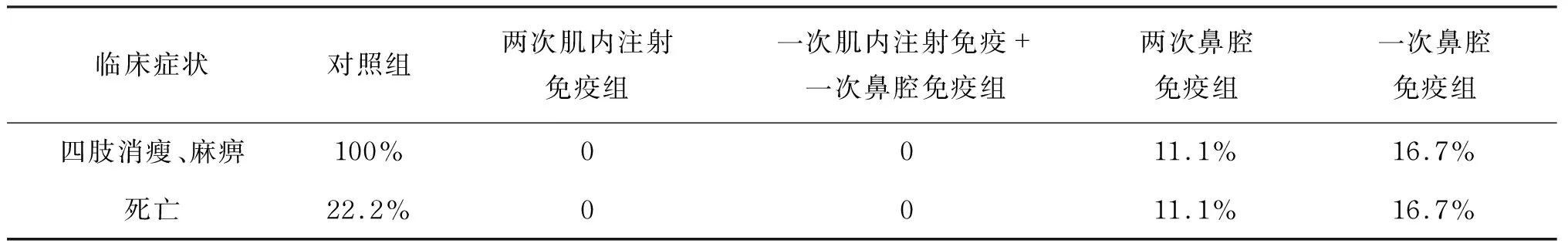
临床症状对照组两次肌内注射免疫组一次肌内注射免疫+一次鼻腔免疫组两次鼻腔免疫组一次鼻腔免疫组四肢消瘦、麻痹100%0011.1%16.7%死亡22.2%0011.1%16.7%
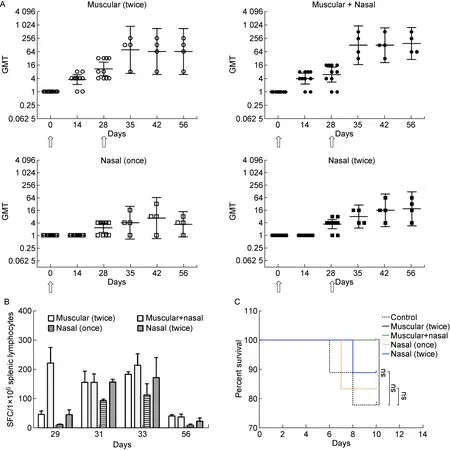
A: Neutralizing antibody titers induced by the inactivated CA16 vaccine via different routes in mice. The samples were obtained within 56 d after inactivated CA16 vaccine immunization (arrow). B: IFN-γ-specific immune responses induced by the inactivated CA16 vaccine via different routes in mice. The samples were obtained within 28 d after booster immunization. C: Protective effects of the inactivated CA16 vaccine administered to mice via different routes. The immunized mice were challenged with CA16 on day 0. The survival rates were analyzed within 14 d of CA16 infection. Mice were immunized with specific buffer (containing 1% squalene, 3% glycerol, 5% sucrose) but without viral antigen in the control group. ns, not significant.
图5CA16抗原经小鼠鼻腔免疫后特异性抗CA16的免疫反应评价
Fig.5EvaluationofspecificimmuneresponsesagainstCA16inmiceimmunizedvianasalroute
3 讨论
众所周知,ILC是一群具有免疫功能的细胞,在天然免疫和适应性免疫应答之间建立联系[31]。其活化依赖一些上皮黏膜组织细胞表达的信号通路分子[32],大部分为IFN或TNF-α家族成员,通过与ILC表面的受体结合而发挥作用[33]。许多病毒通过呼吸道上皮细胞、胃肠道及尿道甚至皮肤感染机体,在这种情况下,诱导抗病毒免疫与ILC激活可能存在直接关联[34]。从这个意义上讲,如果病毒疫苗能模拟病毒感染路径,则其诱导有效抗病毒免疫反应的可能性大大提高。
本课题组前期关于EV71和CA16感染机制的研究发现,这两个病毒均可通过呼吸道传播而感染灵长类动物。因此,本研究首先以人气管上皮细胞16HBE细胞为模型,用CA16进行体外感染并检测ILC激活相关信号通路分子的表达。结果显示,16HBE被CA16感染时,细胞中IFN、TNF家族包括IFN-λ、TNF-α、RANKL、GITRL、LIGHT等表达上调。这些信号通路分子通过与ILC表面的受体结合而促进ILC的激活[35]。然后,以特殊介质介导CA16抗原进入小鼠呼吸道上皮细胞,观察细胞内天然免疫信号分子的表达变化。结果表明,以IFN、TNF家族为中心的信号分子表达趋势与CA16感染人气管上皮细胞类似,即细胞中ILC激活相关因子表达水平明显上升。其后,将这种特别配制的CA16灭活抗原通过鼻腔途径免疫小鼠,检测ILC激活相关信号分子的转录水平。结果显示,呼吸道组织包括鼻腔、口腔及肺组织中ILC激活相关因子表达水平上调。结果表明,这种新的免疫方式确实能模仿病毒感染途径,且在感染初期能调节天然免疫系统。同时,对免疫后小鼠的口腔、鼻腔及肺组织进行免疫荧光检测,证明CA16抗原在组织中分别能与ILC1、ILC3及CD11c+DC共定位。对这些组织进行免疫组织化学分析,观察到活化的ILC分泌的细胞因子表达上升,也为以上推论提供了支持。以上这些结果为病毒抗原如何与天然免疫系统相互作用及接种疫苗后早期阶段的最初免疫应答提供了新的理解。此外,还检测了采用不同方式免疫的小鼠体内抗CA16中和抗体和特异性免疫应答,结果为“CA16抗原与ILC之间的相互作用是诱导抗病毒免疫的起始”这一假设提供了证据。
综上所述,CA16疫苗的研究进展缓慢,表明人们对这类病毒感染过程及其相关免疫学反应尚缺乏足够认识。基于人们对天然免疫系统尤其是ILC认识的逐渐深入,本研究从CA16抗原与天然免疫反应之间的相互关系方面探讨了CA16疫苗研究的一个可能途径。目前,尽管很多研究认为CA16疫苗研发需较好的免疫策略及剂型,但本研究所得结果可能会加深人们对病毒抗原如何激活免疫系统的认识,为今后疫苗研发提供新的思路。
