海蜇的铝吸附行为研究
2018-12-26郭文慧李佳敏林少玲罗联忠曾绍校
郭文慧,李佳敏,林少玲,罗联忠,曾绍校*
(1.福建农林大学食品科学学院,福建 福州 350002; 2.厦门医学院,厦门市海洋药用天然产物资源重点实验室,福建 厦门 361008)
海蜇(Rhopilemaesculentum)隶属于钵水母纲、根口水母目、根口水母科、海蜇属,是一种兼具食用及药用价值的大型水母[1]。新鲜海蜇捕捞后需经盐、明矾加工处理成盐渍海蜇,以便贮存保藏[2]。盐渍海蜇是我国重要的水产加工制品之一,也是含铝量最高的食品。铝可在人体内慢性蓄积,对神经系统、生殖系统等均具有毒性作用[3-4]。2006年,AO/WHO/JECFA(联合国粮食及农业组织、世界卫生组织、联合食品添加剂专家委员会)暂定把铝的每周可摄入量(Provisional tolerable weekly intake, PTWI)规定为1 mg/kg BW[5]。《GB 2760—2014 <食品安全国家标准 食品添加剂使用标准>实施指南》中虽规定明矾在腌渍水产品(仅限海蜇)中可按生产需要使用,但其铝残留量需≤500 mg/kg(以即食海蜇中的Al计)[6]。市面上的即食海蜇铝残留量普遍处于400 ~ 1 300 mg/kg(湿基)[7-9]。海蜇制品中铝残留超标造成的食用安全隐患成为制约海蜇产业发展的瓶颈。
目前,降低盐渍海蜇铝残留的方法有食用前的清水浸泡脱铝和酸溶液浸泡脱铝,但这两种盐渍海蜇脱铝方法不仅费时,清水脱铝效果差,而且酸溶液脱铝使海蜇出现变软、口感变差等问题[10]。因此研究通过使用对人体无害的食品添加剂代替明矾,降低成品海蜇铝含量是今后盐渍海蜇加工发展的新方向,而海蜇与铝的吸附行为关系及其背后的机制有必要进行探究。
金属盐溶液可破坏蛋白质表面水膜及其所带电荷,使蛋白质脱水、交联、聚集[11]。氨基酸是蛋白质的基本组成单位,其影响蛋白质的亲水性及带电荷情况[12],对蛋白质的铝吸附行为具有重要的影响。据不完全统计,谷氨酸、天冬氨酸、组氨酸、胱氨酸、甘氨酸是一类对金属离子有配位吸附作用的氨基酸,这些氨基酸影响金属离子在水溶液中的吸附行为。为此,本文以海蜇为实验对象,以几种常见的代表性海产品(海参、鱿鱼、虾、牡蛎、海蛏、蛤蜊)为对照,对比分析海蜇的铝吸附行为及其氨基酸组成的特点,以期为降低盐渍海蜇的生产加工过程中明矾使用量的新技术提供理论依据。
1 材料与方法
1.1 主要材料
新鲜海蜇由福建泽霖食品有限公司提供的“闽洋海蜇”;海蛏、牡蛎、鱿鱼、虾、蛤蜊购于福建省厦门市集美区灌口镇灌口菜市场;新鲜海参购于辽宁大连舱山岛。
1.2 主要试剂
十二水合硫酸铝钾、苯酚均为分析纯,购于生工生物工程(上海)股份有限公司;硝酸、盐酸购于美国Sigma公司;1 μg/L 质谱调谐液、100 μg/L的混合元素标准溶液(富含Ag、Al、As、Ba、Be等离子)均购自美国Agilent公司;17种氨基酸标准品购于美国Sigma公司; 0.22 μm WondaDisc水系针头滤器,购于岛津公司;高纯氮气;去离子水。
1.3 主要仪器
ICP-MS 7700X型电感耦合等离子体质谱仪:美国Agilent公司;BAS224S型电子分析天平:赛多利斯科学仪器(北京)有限公司;PD-5N型冷冻干燥仪:日本东京理化株式会社;SHB-Ⅲ型循环水式多用真空泵:郑州长城仪器厂;HITACHII 835-50型氨基酸自动分析仪:日本日立公司。
1.4 方法
1.4.1 不同海产品的铝吸附能力
1)海产品的储藏与运输
3只半径约为16 cm、中胶层厚度约为1.5 cm的新鲜海蜇,12只长度为8~13 cm的新鲜海参分别装于放有冰袋的泡沫保温箱中;当天派送,送达后分别于-20℃冰箱冻藏;使用时解冻,可保持新鲜海蜇较好的品质。分别将1 kg新鲜鱿鱼、海蛏、牡蛎、虾、蛤蜊洗净,并去壳取可食部分,于-20℃冰箱冻藏。
2)海产品的矾渍
800 mL蓝盖玻璃罐经高压灭菌后备用。
样品装罐:为保证矾渍条件的均一性,将各海产品可食部分切成约1 cm3大小块状装罐(海蜇矾渍样品取海蜇伞部),加入样品质量1%的明矾固体。
配制1%明矾溶液:再次称取样品质量1%的明矾固体,将明矾溶于0.9%氯化钠溶液,在1 L容量瓶中定容,配制成1%明矾溶液。
矾渍:按1∶1 (V/M)加入1% 明矾溶液,浸没样品。
分别于0、1、2、3、4、6、8、10、24、48、72、96、120、144 h准确称取约20.00 g样品(多部位取样,确保样品的代表性),4℃保存。
3)消解与分析
取出矾渍后的海产品,于100℃恒温干燥箱中烘干,用研钵研磨成粉。准确称取一定量均匀性好的样品,约50.00 mg(在研磨、称样的过程中应注意避免样品直接接触金属、玻璃、研钵,以免引入金属离子,污染样品)。加入600 μL浓硝酸,常温消解一天一夜后,于90℃恒温消解4 h,取100 μL消解液并过0.22 μm微孔滤膜,并用2%硝酸溶液进行300倍稀释。待仪器达到工作条件后,进行测定。
4)仪器工作条件
采用10 ng/mL的Li、Co、Y、Ce和T1调谐液对仪器的各项参数进行调谐。仪器分析条件,高频射发功率:1 550 W;载气流速:0.8 L/min;RF功率:4 W;雾化室温度:2℃;采样深度:7.5 mm;等离子体氩气流量:15.0 mL/min;氧化物浓度<2%;双电荷数<3%。
5)标准曲线的绘制及样品干基铝含量测定
待仪器进入工作状态。标准溶液使用2%硝酸溶液进行配制,共采用9个浓度点,分别为0、5、10、20、50、100、150、200 μg/L。将消解稀释后的样液进样分析。
1.4.2 海产品氨基酸组分测定
海产品中氨基酸组分的测定,参照GB/T 5009.124—2016 《食品安全国家标准 食品中氨基酸的测定》中规定的方法进行操作[15]。
1)样品前处理
将冻藏的海产品置于匀浆机匀浆,并冷冻干燥,磨粉,过40~60目筛,密封保存。
2)样品水解
准确称取一定量的冻干海产样品,约100.00 mg。置于水解管,加入10 ~ 15 mL盐酸(6 mol/L),滴入3~4滴新蒸馏的苯酚,抽真空充氮气,封管。于110℃恒温干燥箱水解24 h后,取出冷却,滤去水解中的固体颗粒,并定容至50.00 mL。吸取滤液1.00 mL,于40~50℃干燥;用水溶解干燥残留物,并再次干燥,反复操作3次。最后用1.00 mL盐酸溶解(0.02 mol/L),4℃保存待测[16]。
3)仪器分析条件
分析柱:(2.6 mm×150 mm)不锈钢柱,树脂2619#;柱温:53℃;反应温度:98℃;缓冲液流量:0.225 mL/min,柱压:8~9 Mpa;茚三酮流速:0.30 mL/min;柱压:2.5~3.0 Mpa。
4)样品氨基酸组分测定
待仪器进入工作状态,将水解后的样品进样测定。
1.4.3 数据统计与分析
显著性分析:使用软件OriginPro 8.0进行数据统计分析。采用单因素方差分析(ANOVA)进行统计学分析。所有结果均表示为平均值,并用显著差异的Tukey的决定测试。以P<0.05、P<0.01认为具有统计学意义。
相关性分析:将各海产品吸附铝量按大到小依次排列,利用Excel中的correl函数分析海产品铝吸附能力与氨基酸组成的相关性。
2 结果
2.1 海蜇与其它六种代表性海产品的铝吸附行为研究
以海蜇为实验组,其它海产品为对照组,不同时间点各海产品的吸附铝量(干基)见图1。由图1可知,海蜇组织吸附的铝量在0~24 h内快速增加;在18~24 h左右出现第一个拐点,之后曲线趋于平缓,数值在一个较小的范围内波动,说明24 h后海蜇组织的铝含量趋于稳定。蛤蜊、海参铝吸附行为与海蜇相似;牡蛎、海蛏、鱿鱼、虾组织吸附的铝量在0~24 h内有一定增幅,但增量较小,铝吸附能力较弱。不同海产品组织的原始铝量处于146.55~428.78 mg/kg(干基)之间,其中海蛏的原始铝含量最高,虾的原始铝含量最低。不同海产品矾渍7 d后的组织铝含量(干基)从高至低依次为海蜇2.11×104mg/kg、蛤蜊1.16×104mg/kg、海参1.12×104mg/kg、海蛏5.50×103mg/kg、牡蛎3.68×103mg/kg、鱿鱼1.62×103mg/kg、虾1.20 ×103mg/kg,在P<0.01水平上具有显著性差异。
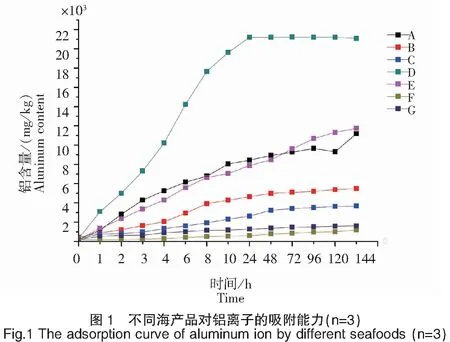
注:A为海参;B为海蛏;C为牡蛎;D为海蜇;E为蛤蜊;F为虾;G为鱿鱼。
Notes:A was sea cucumber;B was razor clam;C was oyster;D was jellyfish;E was clam;F was shrimp;G was squid.
2.2 海蜇与其它六种代表性海产品的氨基酸组成分析
冻干海蜇、蛤蜊、海参、牡蛎、海蛏、鱿鱼、虾的17种氨基酸含量的测定结果见表1。如表1所示,甘氨酸、谷氨酸、脯氨酸是海蜇中含量最高的3种氨基酸,在每100 g海蜇冻干粉中其含量分别达0.002 9 g、0.002 2 g、0.001 4 g;甘氨酸、谷氨酸,天冬氨酸是蛤蜊中含量最高的3种氨基酸,在每100 g蛤蜊冻干粉中其含量分别达0.010 9 g、0.009 7 g、0.006 3 g;谷氨酸、丙氨酸、天冬氨酸是海参中含量最高的3种氨基酸,在每100 g海参冻干粉中其含量分别达0.007 1 g、0.004 6 g、0.004 4 g;谷氨酸、天冬氨酸、丙氨酸是牡蛎中含量最高的3种氨基酸,在每100 g牡蛎冻干粉中其含量分别达0.006 4 g、0.004 0 g、0.004 6 g;谷氨酸、天冬氨酸、精氨酸是海蛏中含量最高的3种氨基酸,在每100 g海蛏冻干粉中其含量分别达0.007 8 g、0.004 9 g、0.004 1 g;谷氨酸、天冬氨酸、亮氨酸是鱿鱼中含量最高的3种氨基酸,在每100 g鱿鱼冻干粉中其含量分别达0.011 3 g、0.006 3 g、0.005 7 g;谷氨酸、天冬氨酸、精氨酸是虾中含量最高的3种氨基酸,在每100 g虾冻干粉中其含量分别达0.011 8 g、0.006 8 g、0.007 0 g。此外,海蜇的总氨基酸含量仅为0.015 7 g/100g,在所有海产品中最低。为便于比较各海产品氨基酸组成差异及其与铝吸附能力的相关性,进一步统计分析结果见表2。
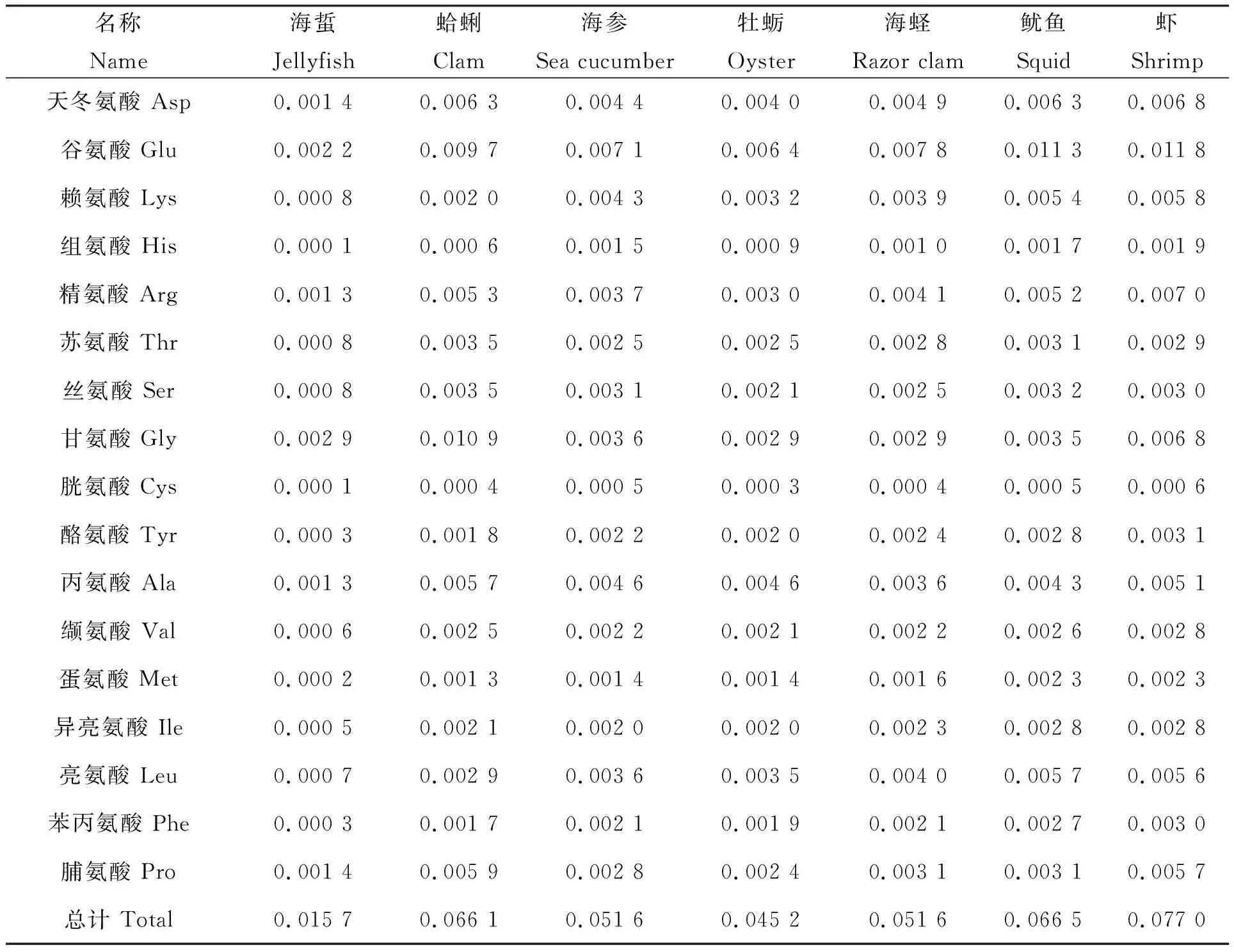
表1 不同海产品17种氨基酸含量
如表2所示,海蜇冻干粉中甘氨酸占总氨基酸的比例最高,为19%;谷氨酸占总氨基酸比例为14%;天冬氨酸占总氨基酸比例为9%;组氨酸及胱氨酸占总氨基酸比例最低,均分别为1%。蛤蜊冻干粉中甘氨酸占总氨基酸的比例最高,为16%;谷氨酸占总氨基酸比例为15%;天冬氨酸占总氨基酸比例为10%;组氨酸及胱氨酸占总氨基酸比例最低,均分别为1%。海参冻干粉中谷氨酸占总氨基酸比例最高,为14%;天冬氨酸占总氨基酸的比例为9%;丙氨酸占总氨基酸的比例为9%;胱氨酸占总氨基酸的比例为1%;组氨酸占总氨基酸的比例为3%。牡蛎冻干粉中谷氨酸占总氨基酸比例最高,为14%;天冬氨酸占总氨基酸的比例为9%;丙氨酸占总氨基酸的比例为10%;胱氨酸占总氨基酸的比例为1%;组氨酸占总氨基酸的比例为2%。海蛏冻干粉中谷氨酸占总氨基酸比例最高,为15%;天冬氨酸占总氨基酸的比例为9%;精氨酸占总氨基酸的比例为8%;胱氨酸占总氨基酸的比例为1%;组氨酸占总氨基酸的比例为2%。鱿鱼冻干粉中谷氨酸占总氨基酸比例最高,为17%;天冬氨酸占总氨基酸的比例为9%;亮氨酸占总氨基酸的比例为9%;胱氨酸占总氨基酸的比例为1%;组氨酸占总氨基酸的比例为3%。虾冻干粉中谷氨酸占总氨基酸比例最高,为15%;天冬氨酸占总氨基酸的比例为9%;精氨酸占总氨基酸的比例为9%;胱氨酸占总氨基酸的比例最低为1%;组氨酸占总氨基酸的比例为2%。
将各海产品吸附铝量按从大到小依次排列,利用Excel中的correl函数分析海产品铝吸附能力与氨基酸组成的相关性。结果表明海产品的铝吸附能力与甘氨酸、脯氨酸含量的正相关系数最高,分别为0.8、0.6。说明海产品中甘氨酸和脯氨酸占总基氨酸的比例越高,其吸附铝离子的能力就越强。海产品的铝吸附能力与苯丙氨酸、亮氨酸、酪氨酸、蛋氨酸含量的相关系数最低,分别为-0.9、-0.8、-0.8、-0.8。
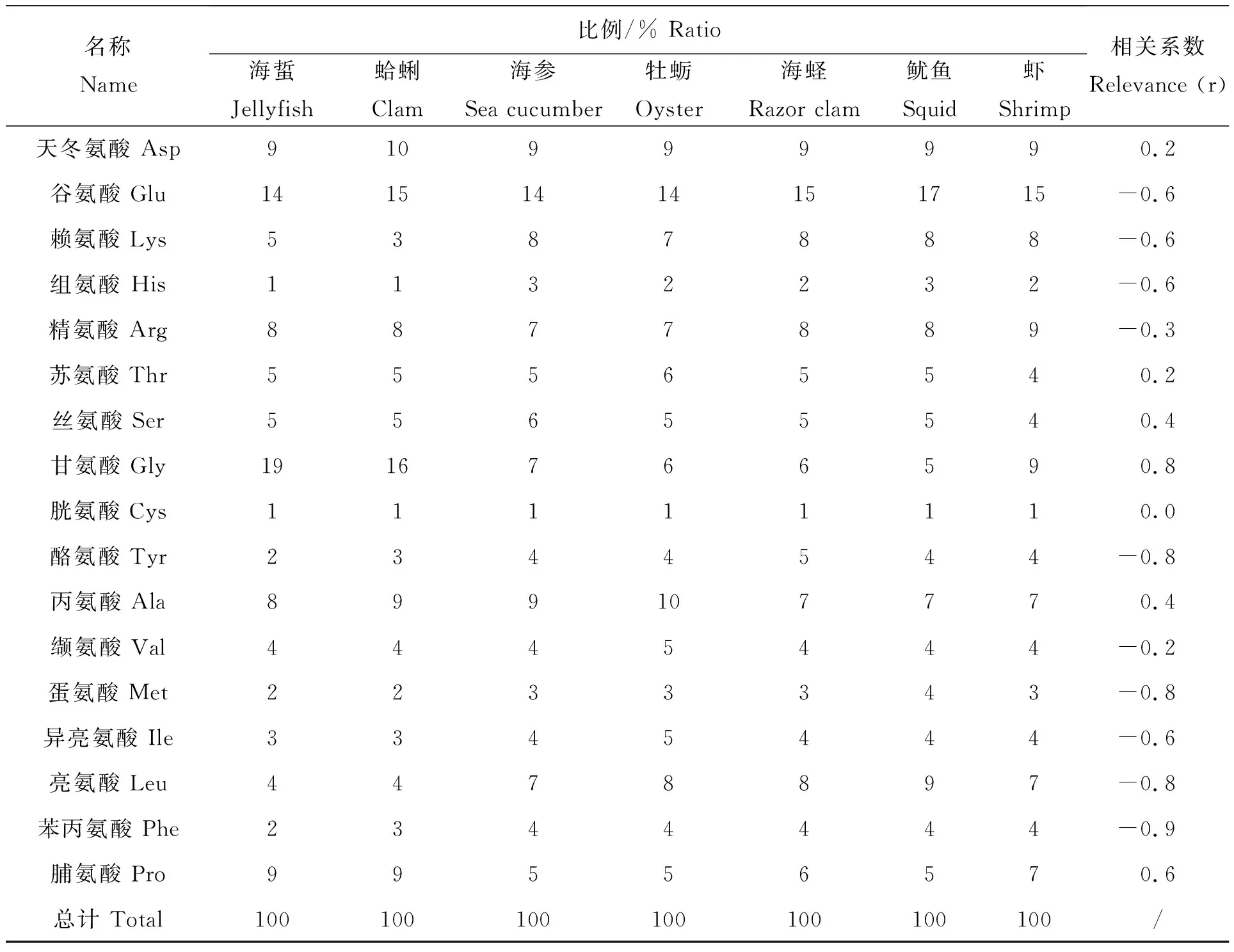
表2 不同海产品17种氨基酸比例
3 讨论
海蜇、蛤蜊、海参、牡蛎、海蛏、鱿鱼、虾的铝吸附行为试验结果表明:不同海产品的原始铝含量不同;1%明矾溶液浸渍7 d后,各海产品吸附铝量(干基)在P<0.01水平上具有显著性差异,其中海蜇的铝吸附能力最强,达2.11×104mg/kg(干基)。根据施沁璇等[17]的研究结果:在一定条件下鱼类肌肉中的金属含量与其生活水域的金属含量,及该鱼类所属食物链级别呈正相关,可推测海产品组织原始铝含量可能与其生活的水域及摄食习性相关,而各海产品吸附铝的量则与其物质结构的组成有关[18]。
蛋白质是一类具有金属吸附能力的生物大分子,而氨基酸构成对蛋白质的金属吸附能力有很大的影响。本次试验氨基酸分析结果表明:在各海产品中,海蜇的天冬氨酸及谷氨酸比例分别为9%、14%,天冬氨酸及谷氨酸带有两个羧基,为极性带负电荷氨基酸,这类氨基酸常常是蛋白质中与金属阳离子结合的位点[19]。如史位良等[20]将水杨酸与L-天冬氨酸进行缩合反应,制备水杨醛天冬氨酸席夫碱,结果表明水杨醛天冬氨酸席夫碱中L-天冬氨酸上的COO-上的氧原子、C=N上的氮原子及酚氧中的氧原子均参与了金属离子的配位吸附,所形成的配合物化学组成为K[ML]·nH2O,式中L=C11H7NO, M=Cu2+、Zn2+、Co2+、Ni2+,相应地,n=2、2、3、7/2;在李闪等[21]的研究中,利用柠檬酸与天冬氨酸去除污泥中的重金属,当柠檬酸与天冬氨酸的物质的量浓度比为0.2∶0.4,其对Zn2+的吸附率为43.9%,Cu2+为18.7%,Pb2+为30.7%,Cd2+为 74.7%,Cr2+为 27.4%;吴长平等[22]的试验表明,鳗鱼肽中的谷氨酸、天冬氨酸含量的增高可显著提高鳗鱼肽的钙螯合率。在本次试验中,各海产品均有较高的天冬氨酸及谷氨酸含量,由此推测其影响着海蜇铝吸附过程,但并不是造成各海产品铝吸附量差异的原因。
组氨酸、胱氨酸对金属离子也有吸附能力。何发虎等[23]的试验表明在水溶液中组氨酸可吸附Cd2+,并形成配合物,当溶液pH<4.0时,组氨酸中仅羧基氧参与配位;而当pH>4.0时,组氮酸中咪唑环上的N也参与了配位;组氮酸与Cd2+络合物的最高配位级数为2,故溶液中仅存在Cd(His)和Cd(His)2两种配合物,其两级稳定常数分别为log k1=6.48、log k2=4.631。郑逸之等[24]的试验表明,大豆ASR蛋白中富含组氨酸结构域是其与金属离子Cu2+、Cd2+结合的区域。何玉凤等[25]将角蛋白(FK)与组氨酸(His)复合,利用组氨酸可与金属离子(Mx)结合的性质,成功制备了角蛋白组氨酸金属复合体(FK-HisMx,Mx=Cu、Zn、Ni、Mn)。一个胱氨酸分子中含有两个羧基、两个胺基、两个S原子,是很好的金属离子络合剂。在黄冰等的[26]试验中,使用胱氨酸修饰啤酒废酵母用于吸附废水中的Hg2+,结果表明在相同条件下,修饰前后啤酒废酵母对Hg2+吸附容量由21.2 mg/g提升至42.7 mg/g。但本次实验结果中,海蜇的组氨酸、胱氨酸占总氨基酸的比例仅分别为1%,为所有海产品中最低。因此,组氨酸、胱氨酸含量也不是海蜇铝吸附能力强的影响因素。
甘氨酸是天然结构最为简单的氨基酸,α碳原子上连接着两个氢原子、一个氨基及一个羧基[27]。试验表明甘氨酸对二价及三价金属离子均具有配位吸附活性。如和芹等[28]的理论研究表明二价金属离子可与甘氨酸上的氮原子及羧基氧配位吸附,吸附稳定性与配位方式及配位位点有关;陈洪等[29]将甘氨酸固定于惰性载体上,用于吸附水溶液中的金属离子,试验结果表明16 g(湿重)吸附剂对Ca2+的饱和吸附量为16.99 mg,Mg2+为6.86 mg,Fe2+为 10.06 mg,Fe3+为4.93 mg,Mn2+为11.51 mg;朱和正等[30]的试验表明在碱性条件下,Nd3+与甘氨酸形成的配合物更为稳定;王君玉[31]的研究表明甘氨酸可吸附铝,形成甘氨酸铝盐,该化合物具有良好的抗酸性,可作为体内缓解胃酸分泌过多的药剂。这些说明甘氨酸是一种可以吸附Al3+的氨基酸,且具一定的稳定性。本次试验相关性分析结果表明海产品的铝结合能力与海产品中甘氨酸的比重呈正相关,相关系数达0.8。通过对比图1与表2,发现海产品对铝吸附量大小依次为海蜇2.11×104mg/kg >蛤蜊1.16×104mg/kg >海参1.12×104mg/kg >海蛏5.50×103mg/kg >牡蛎3.68×103mg/kg >鱿鱼1.62×103mg/kg >虾1.20 ×103mg/kg;同时,甘氨酸比例呈现海蜇19%>蛤蜊16%>海参7%>牡蛎6%>海蛏6%>鱿鱼5%。推测甘氨酸比例高是造成海蜇铝吸附量高于其它海产品的原因。
脯氨酸是一种亚氨基酸,目前尚未见脯氨酸吸附金属离子的报道。由于亚氨基酸的吡咯环可以固化二级结构,由羟脯氨酸的羟基所形成的氢键可以稳定胶原的螺旋结构,因而胶原蛋白中总亚氨基酸(脯氨酸和羟脯氨酸)含量影响其空间结构的稳定性[32]。在本次试验中,海蜇中的脯氨酸含量为0.001 4 g/100g,占总氨基酸的比例为9%。相关性分析结果表明,海产品的铝吸附量与海产品中脯氨酸占总氨酸的比例呈正相关,相关系数为0.6。
在本次试验中,海蜇所含的苯丙氨酸、亮氨酸、蛋氨酸占其总氨基酸的比例分别为2%、4%、2%,相关性分析表明此类氨基酸与海产品的铝吸附能力呈负相关,相关系数分别为-0.9、-0.8、-0.8。苯丙氨酸、亮氨酸、蛋氨酸虽同样含有羧基及氨基,理论上具有金属吸附活性,但此类氨基酸属于疏水性氨基酸,通常位于蛋白质内部,而蛋白质与金属离子的相互作用通常在蛋白质表面进行,因此,海蜇的强铝吸附能力与苯丙氨酸、亮氨酸、蛋氨酸的低比例有关。
综上所述,根据金属盐对蛋白质的脱水机理及海蜇的氨基酸构成特点,可以推测海蜇铝吸附行为受甘氨酸、谷氨酸、天冬氨酸、脯氨酸的影响。甘氨酸、谷氨酸、天冬氨酸是海蜇的主要氨基酸成分,且具备金属离子吸附能力,同时甘氨酸、谷氨酸、天冬氨酸属于亲水性氨基酸,位于蛋白质表面;当铝离子进入海蜇组织内部,由于铝离子的水化能力强于蛋白质,会导致蛋白胶粒脱水,随后铝离子首先与甘氨酸、谷氨酸、天冬氨酸接触,促使海蜇蛋白质电荷环境发生改变,引发交联聚集,在聚集过程中,脯氨酸起到稳定蛋白质空间结构的作用;待海蜇蛋白质凝固后,铝残留于海蜇组织中,从而导致海蜇的铝残留量较高。
4 结论
本试验结果表明:海蜇组织吸附铝量显著高于其它海产品,吸附量高达2.11×104mg/kg(干基)。氨基酸构成分析表明:海蜇氨基酸总量最低,为0.015 7 g/100g,说明海蜇在含有极少干物质下具有较强的铝吸附能力,且这种强铝吸附能力与海蜇氨基酸构成相关,尤其与甘氨酸、谷氨酸、天冬氨酸、脯氨酸的高比例,以及苯丙氨酸、亮氨酸、蛋氨酸的低比例相关。
