良恶性周围神经鞘瘤的CT分析
2018-12-26胡井泉张玉峰何奎钢
胡井泉 张玉峰 黄 国 何奎钢
上海市宝山区罗店医院放射科,上海 201908
周围神经鞘瘤来源于神经髓鞘的Schwann细胞,多数患者肿瘤生长速度较慢,往往仅压迫神经而不造成神经侵犯,且包膜完整,易于切除[1]。恶性周围神经鞘瘤的人群发病率约为0.001%,约占所有软组织肉瘤的6%,虽然其发病率较低,但具有侵袭性强、恶性程度高等特征,患者远期生存率较低,据报道,恶性周围神经鞘瘤患者5年生存率不足50%[2]。本研究分析了近年收集的71例良恶性周围神经鞘瘤的CT图像特点,现作报道如下。
1 对象与方法
1.1 研究对象
整理我院2013年2月至2017年10月收治的71例周围神经鞘瘤患者的临床资料,进行回顾性分析。患者均于我院接受手术治疗,经术后病理学检查明确诊断[3],其中男39例,女32例,年龄18~69岁,平均(41.38±9.52)岁,病程14 d~2年,平均(9.75±1.33)个月;主要临床表现:颈部疼痛2例,胸部疼痛8例,胃部不适5例,胸闷6例,活动后气促2例,咳嗽伴咯血2例,腹胀2例,大便带血1例,吞咽困难1例,四肢麻木17例,其余25例为体检发现;肿瘤性质:良性49例,恶性22例。
1.2 检查方法
使用Somatom Sensation 16排螺旋CT机(德国西门子公司),扫描参数[4]:管电压120 kV,管电流210 mAs;增强扫描时经肘前静脉高压注射非离子型对比剂碘帕酮(350 mgI/mL)75 mL,速率3 mL/s,注药后35 s进行采集,对采集原始图像依次进行薄层重建、多平面重组,重建层厚及层间距均为3 mm。
由2名经验丰富的影像科高年资医师分别阅片,结论不统一的讨论后决定。
2 结果
2.1 良性周围神经鞘瘤的特点
2.1.1 病灶部位、形态 49例良性病灶中,19例位于颈部,肿瘤起源神经为脊神经,生长部位包括颈根部及锁骨上窝。15例病灶位于胸部,4例病灶位于腹部,11例病灶位于四肢。
2.1.2 CT图像特点 颈部CT平扫横断面图像示肿瘤呈椭圆形,沿神经根走行生长,可见包膜,呈等或稍低密度,密度稍不均匀,可见小钙化灶、囊变;增强扫描图像示强化不均匀,瘤体中心区域呈明显丝状强化,包膜中等强化,囊变未见强化,瘤体周围组织可见受压推移改变。
胸部病灶CT平扫图像示肿块边缘光滑,平扫密度稍不均匀,CT值范围介于18~26 Hu,与邻近组织分界较清晰;增强扫描图像示病灶呈轻或中度强化,病灶周围胸膜未见增厚,未见肿大淋巴结。见图1。
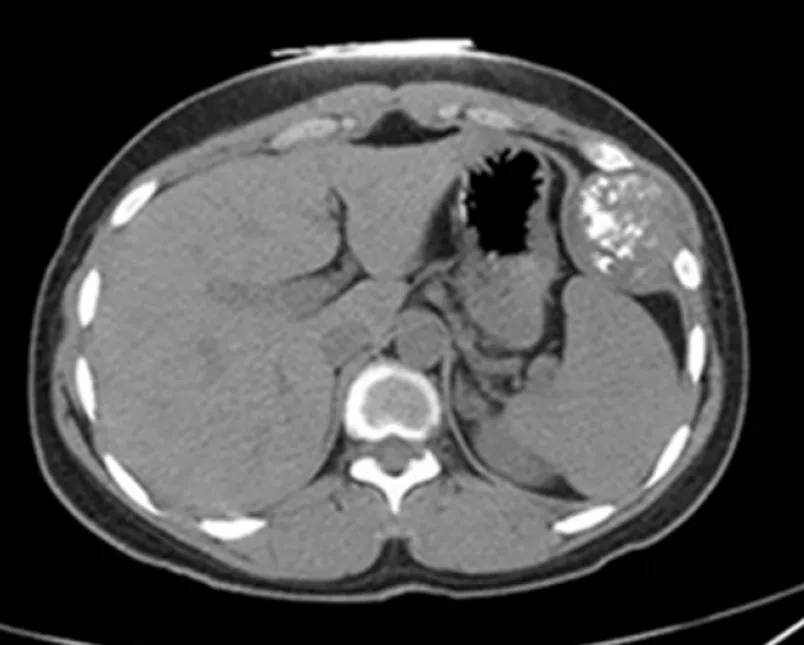
图1 胸部良性周围神经鞘瘤的CT平扫图像
腹部病灶CT平扫图像可见组织分界清,CT值约30 Hu,密度不均匀,内见多个点状钙化灶及多发小圆形脂肪密度影;增强扫描图像示轻度不均匀强化。四肢病灶平扫图像可见肿瘤呈软组织样密度,与周围组织分界清,周围结构呈不同程度受压改变;增强扫描图像示中度不均匀强化。
2.2 恶性周围神经鞘瘤的特点
2.2.1 病灶部位、形态及生长方式 22例恶性病灶中,5例位于下肢,4例位于腹腔,4例位于肩背部及脊柱,2例位于纵膈,2例位于乳腺,胸壁、前列腺、阴囊、头皮、上颌窦及眶底各1例。其中20例为肿块型,呈侵袭性生长,相邻脂肪层受累并表现为广泛或局部脂肪间隙模糊,1例为弥漫型,可见周围多发骨质破坏;17例边界欠清,5例边界清晰;转移情况:淋巴结转移7例,胸壁转移4例,肺转移、胸膜转移各2例,肾上腺转移1例。
2.2.2 CT图像特点 CT平扫图像以等或低密度为主,其中4例可见多发点状、条状、片状钙化;增强扫描图像示瘤灶实性部分呈中等或明显强化,强化不均匀,呈渐进延迟强化,囊性及坏死成分未见强化。见图2。

图2 腹部恶性周围神经鞘瘤的CT平扫图像
3 讨论
周围神经鞘瘤可广泛分布于全身各处,但以四肢屈侧、头颈部、腹膜后及脊神经后根处最为常见,既往临床关于周围神经鞘瘤的诊断多采用超声技术,虽然超声图像能够为病灶与表浅周围神经关系的判断提供参考,但由于神经鞘瘤位于神经末梢,体积较细小且位置较深,临床实践中超声图像往往难以发现[5-6]。
良性周围神经鞘瘤的病理表现为:肉眼可见肿瘤呈灰白色,包膜完整,可见旋涡状结构;镜下肿瘤细胞呈梭形,伸出双根突起,短梭形的细胞核呈较规则的栅栏状排列[7]。恶性周围神经鞘瘤的病理表现为:肉眼可见肿瘤呈灰褐色,形态不完整;镜下肿瘤细胞呈梭形,呈密集漩涡状排列[8]。虽然病理组织学是临床诊断周围神经鞘瘤并判断肿瘤良恶性的金标准,但其存在有创、耗时久等弊端,在影像学诊断无明显把握的前提下难以作为首选筛查方案。因此,影像学诊断手段,对于周围神经鞘瘤的鉴别诊断有特殊价值。
既往研究显示,CT与MRI对周围神经鞘瘤的检出率相仿,故单独实施CT检查即可达到诊断目的[9]。本研究49例良性病灶中,以颈部、胸部病灶占比最高,其CT平扫图像特点以密度不均匀、与周围组织分界清为主,增强扫描多见不均匀强化。一方面,肿瘤细胞排列较为疏松,且存在较多间质、细胞间水肿液、粘液成分,是造成肿瘤组织密度不均匀的主要原因;另一方面,Schwann细胞粘液基质水分较多,故相较于肌肉组织,神经鞘瘤的衰退减少,加之肿瘤囊变、坏死、出血等因素,增强扫描图像亦呈不均匀强化表现[10-11]。对于CT图像可见软组织肿块分布于神经走行区域者,应高度怀疑周围神经鞘瘤风险。需要注意的是,良性胃部周围神经鞘瘤往往伴有胃壁增厚、走行僵硬等表现,需注重与胃间质瘤、胃癌、胃淋巴瘤的鉴别:1)胃间质瘤属于富血供肿瘤,倾向于外生性生长,肿瘤中心常见出血、坏死,增强扫描强化明显[12],可据此鉴别;2)胃癌的CT图像可见胃内多个大小不等的肿块浸润于胃壁,根据浸润生长表现、淋巴结及其他器官转移征象的差异可做出判断;3)胃淋巴瘤亦可见广泛性胃壁增厚,但常累及多个部位并伴有表面溃疡形成,且增强扫描可见病灶分层强化[13-14],是区分胃淋巴瘤与良性周围神经鞘瘤的关键点。
恶性周围神经鞘瘤其CT平扫图像特点以密度不均匀、内可见点状钙化灶为主;增强扫描图像示强化不均匀,呈渐进延迟强化。此外,CT见瘤体巨大,囊变、坏死多发并伴淋巴结转移,可作为恶性周围神经鞘瘤的诊断依据[15]。虽然良性与恶性周围神经鞘瘤的CT平扫、增强图像存在一定差异,但恶性周围神经鞘瘤仍需与其他肿瘤相鉴别:1)外周良性神经源性肿瘤常较局限、边缘清晰,肿瘤周围无水肿或仅有轻微水肿,且无恶性肿瘤的侵袭性生长、远处转移等特点[16-17],临床鉴别难度较低;2)四肢恶性周围神经鞘瘤易与横纹肌瘤、平滑肌瘤混淆,前者CT增强扫描时肿块一般呈明显不均匀强化并可见远处转移灶,后者由于血运丰富,增强扫描图像多见斑片状不均匀强化[18],应注意区分。
总体而言,良恶性周围神经鞘瘤的CT平扫及增强图像存在一定特征性表现,可以为肿瘤性质的判断提供参考。
